博来霉素诱导系统性硬化病小鼠肠道菌群改变及醋酸泼尼松龙的干预作用①
张 羽 周雪艳 赵亮娟 李 凯 吕军影(广西医科大学第一临床医学院,南宁 530021)
系统性硬化病(systemic sclerosis,SSc)简称硬皮病,是一种结缔组织自身免疫性疾病,以皮肤、关节、内脏器官(如肺、胃肠道、心脏)的炎症及进行性纤维化为主要特征,病理表现为血管损伤和真皮中大量胶原蛋白过度积聚[1-3]。SSc 发病率为3~24 例/每10 万,好发于20~60 岁女性,可分为局限性SSc(lcSSc)和弥漫性SSc(dcSSc)两种类型,其中dcSSc死亡风险更高[4-6]。SSc 目前尚无特效治疗药物。SSc 的发生发展由免疫功能紊乱引起,但确切病因和发病机制尚不清楚。近年肠道菌群对人体生理、病理及疾病的影响日益受到关注,越来越多的研究表明,多种自身免疫性疾病如类风湿关节炎(rheumatoid arthritis,RA)、系统性红斑狼疮(systemic lupus erythematosus,SLE)、多发性硬化(multiple sclerosis,MS)和炎症性肠病(inflammatory bowel disease,IBD)的发生发展均与肠道菌群失衡有关[7-10]。但目前对属于自身免疫性疾病之一的SSc 与肠道菌群的相关研究较少。因此,本研究拟运用16S rRNA 测序技术等探讨SSc 肠道菌群变化及SSc 常用治疗药物——糖皮质激素(glucocorticoid,GCs)对其的干预作用。
1 材料与方法
1.1 材料
1.1.1 动物来源及分组 6周龄雄性SPF级BALB/c小鼠,体质量18~22 g,由湖南斯莱克景达实验动物有限公司提供,动物生产批号:SCXK(湘)2016-0002,动物使用批号:SCXK(桂)2014-0003。动物饲养温度:(25±2)℃,相对湿度为(50±5)%,普通适应性饲养1 周后随机分为对照组(Control)、SSc 模型未用药组(Model)、SSc模型醋酸泼尼松龙治疗组(Pred),每组12 只。本研究经广西医科大学实验动物伦理委员会批准(编号:201809031),整个实验程序符合《动物实验管理条例》。
1.1.2 药物、试剂和仪器 注射用盐酸博来霉素(BLM,15 mg/瓶,浙江汉辉药业有限公司,批号:H20055883);醋酸泼尼松龙片(PAT,5 mg/片,浙江仙居药业有限公司,批号:H33021207);Sirius Red染色试剂盒(武汉博士德生物公司);DNA 提取试剂盒、DNA 纯化试剂盒(北京天根生化科技有限公司);高保真PCR 预混液(批号:M0532S,美国NEB公司);T100 梯度PCR 仪(美国Bio-Rad 公司);电泳装置DYY-6C(北京市六一仪器厂);Invitrogen qubit 3.0 分光光度计(美国Invitrogen 公司);Agilent 2100生物分析仪系统(美国Agilent 公司);NovaSeq 6000测序仪(美国Illumina公司)。
1.2 方法
1.2.1 SSc 小鼠模型构建与药物干预 依据文献[11],采用BLM 诱导SSc 小鼠模型。剔除各组小鼠背部相同区域面积约1.5 cm×1.5 cm 被毛,皮下注射0.1 ml 磷酸BLM 缓冲液(200 µg/ml),建立SSc 小鼠模型。模型成功标准:BALB/c 小鼠连续4 周每日皮下注射BLM 后诱导皮肤硬化和皮肤增厚,组织学表现为胶原束增粗、均质化,肺纤维化诱导形成,胶原在肺内积累。本研究共获得24 个成功模型。Control 组皮下注射等体积PBS(0.01 mol/L)。造模期间,根据动物与人体表面积剂量折算表计算Pred组小鼠灌胃醋酸泼尼松龙药液(0.45 mg/ml)等效剂量为0.2 ml,Control 组和Model 组分别给予等剂量生理盐水灌胃。以上操作1次/d,连续28 d。
1.2.2 样品采集与处理 第28 天末次给药结束后,禁食禁水12 h,收集每只小鼠新鲜粪便5~8 粒,放入灭菌PE 管,-80 ℃超低温保存,以备肠道菌群16S rRNA 基因测序。实验结束第2 天,麻醉处死小鼠,留取皮肤、肺组织分装于冻存管,用于Sirius Red染色。
1.2.3 一般生存状态 造模期间每天观察记录各组小鼠精神状态、饮食及形体变化、活动能力、被毛生长情况、皮肤弹性及硬度。
1.2.4 病理观察 根据文献[12],Sirius Red 染色观察各组小鼠皮肤、肺组织病理改变,测定组织胶原纤维含量。
1.2.5 16S rRNA 测序技术检测 参考文献[13],使用基因组DNA 提取试剂盒提取粪便样品中(200 mg)细菌基因组DNA。以细菌基因组DNA 为模板,分别以341F(5´-CCTAYGGGRBGCASCAG-3´)和806R(5´-GGACTACNNGGGTATCTAAT-3´)作 为正向和反向引物扩增16S rRNA 基因V3-V4高变区。扩增体系30 µl:15 µl Phusion®High-Fidelity PCR Master Mix with GC Buffer、3 µl 引物、5~10 ng DNA模板和12 µl H2O。扩增过程:98 ℃初始预变性1 min;98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸30 s,30 个循环;最终72 ℃延伸5 min。DNA 纯化试剂盒纯化等质量混合物PCR 产物,TruSeq DNA PCR-Free高通量文库制备试剂盒构建文库,Invitrogen Qubit 3.0 分光光度计和Agilent 2100 生物分析仪系统评估DNA 文库质量。Illumina NovaSeq 6000 平台进行双端测序(2×250,PE250),使用FLASH 进行合并reads,Qiime 进行质量过滤。通过截断低质量碱基和筛选高质量碱基,过滤后的Tags 序列与Gold 数据库对比,UPARSE 软件7.0.1001 进行操作分类单位(OTU)聚类,一致性为97%,再利用UCHIME 对嵌合体序列进行鉴定和去除,获得有效Tags。使用Silva 16S rRNA 数据库的RDP 分类器算法分析对应各16S rRNA 基因序列分类群,置信阈值为70%(以上操作均在广西普斐信息科技有限公司实验室进行)。
1.3 统计学分析 所有数据采用表示,采用SPSS23.0 软件进行统计学分析。数据具有正态性且方差齐时,采用t检验,方差不齐时采用Wilcoxon秩和检验。P<0.05表示差异有统计学意义。
2 结果
2.1 小鼠一般生存状态 造模前各组一般情况无差异。Control 组小鼠精神良好,动作灵活敏捷,活泼好动,食量正常,体形发育正常,体毛光亮顺滑,生长迅速,背部皮肤结构完整,皮肤柔软弹性好,无死亡。造模后,Model 组小鼠精神萎靡,反应迟钝,行动缓慢,活动减少,进食减少,体形逐渐消瘦,被毛暗淡无光泽,体毛无新长,背部皮肤增厚粗糙、硬化,与皮下组织粘连,部分出现结痂现象。Pred 组小鼠精神状态好转,行为能力稍恢复,但动作仍缓慢,较安静,食量增加不明显,体形仍偏小,被毛缺乏光泽,体毛基本无再生,背部皮肤粗糙、硬化及结痂情况明显改善,弹性逐渐恢复(图1)。
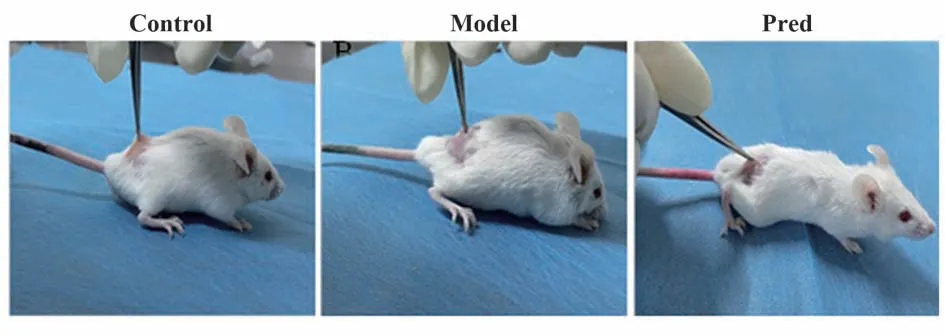
图1 各组小鼠一般生存状态Fig.1 General survival status of mice in each group
2.2 皮肤、肺组织病理学指标 Control 组小鼠皮肤组织未见明显病理改变,皮肤胶原纤维排列规整,形态结构完整,未出现紊乱现象;与Control 组比较,Model 组小鼠皮肤成纤维细胞及胶原纤维明显增加,出现较多纤维束,形态较粗,结构紊乱,相互缠绕螺旋排列,肺组织红色胶原纤维明显增多、沉积,肺泡间隔增大、增多,肺组织正常结构损坏,伴有形状不同、大小不等的结节和条索样改变,呈弥漫性肺纤维化表现。醋酸泼尼松龙干预后,Pred 组小鼠皮肤和肺组织成纤维细胞及胶原纤维明显减少,可见少量纤维束形成,形态变细,部分组织疏松呈网状,纤维结构排列逐渐恢复有序、规则。肺泡间隔缩小、减少,肺组织破坏程度、弥漫性肺纤维化程度均改善(图2)。
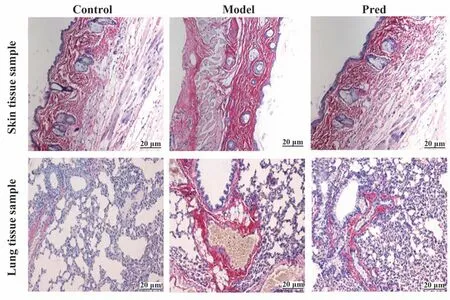
图2 各组小鼠皮肤和肺组织Sirius Red染色Fig.2 Sirius Red staining of skin and lung tissues of mice in each group
2.3 皮肤、肺组织胶原纤维含量变化 Control 组小鼠皮肤及肺组织胶原纤维含量正常;与Control 组比较,Model 组小鼠皮肤、肺组织胶原纤维含量明显增加(P<0.01)。与Model组比较,Pred组皮肤、肺组织胶原纤维含量明显降低(P<0.01,图3)。

图3 各组小鼠皮肤及肺组织胶原纤维含量Fig.3 Contents of collagen fibrils in skin and lung tissues of mice in each group
2.4 OTU 物种注释 共得到4 311 212 个原始读数,过滤后剩余3 477 520个读数。对36个样本序列进行分析聚类,筛选频数最高的代表序列共1 542个OTU。使用GraPhlAn 结合OTU Table 对各分组样本分别进行单独OTU 物种注释,以总体报告形式展示优势菌种(图4)。Control 组优势菌主要分布于拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形杆菌门(Proteobacteria);Model 组优势菌主要分布于拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形杆菌门(Proteobacteria)、螺旋体菌门(Saccharibacteria)、疣微菌门(Verrucomicrobia);Pred组优势菌主要分布于拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形杆菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)。

图4 基于GraPhlAn的OTU注释结果等级树图Fig.4 GraPhlAn based hierarchical tree plot of OTU annotation results
2.5 α 多样性分析 物种累积箱形图可用于描述样本量增加与新物种出现速度的关系,是评价样本量充分与否以及物种丰富度的有效工具。横坐标表示样本量进一步加大,箱形图位置逐渐趋于平缓,表明样本量对该环境中的物种增加产生影响较小,提示样本量充分,物种足够丰富(图5)。

图5 物种累积箱形图Fig.5 Species cumulative box plot
分别对三组及两组间进行聚类分析(图6),三组共有OTUs 575 个。Control 组与Model 组共有OTUs 610个,其中Control 组特有OTUs 735 个,Model 组特有OTUs 56 个;Control 组与Pred 组共有OTUs 620 个,其中Control 组特有OTUs 725 个,Pred组特有OTUs 53 个;Pred 组与Model 组共有OTUs 606 个,Pred 组特有OTUs 67 个,Model 组特有OTUs 60个。

图6 韦恩图Fig.6 Venn diagram
Observed_species 指数表示实际观测到的OTU数,反映物种丰富度信息;PD_whole_tree 指数可显示微生物群落系统遗传多样性。Model组Observed_species 和PD_whole_tree 指数显著低于Control 组(P<0.01),而Pred 组与Model 组差异无统计学意义(P>0.05,图7、表1)。
表1 肠道菌群多样性指数分析(,n=12)Tab.1 Analysis of diversity indexes of intestinal flora(,n=12)

表1 肠道菌群多样性指数分析(,n=12)Tab.1 Analysis of diversity indexes of intestinal flora(,n=12)
Note:Compared with Control group,1)P<0.01.
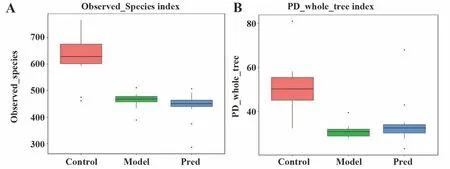
图7 Alpha多样性箱型图Fig.7 Alpha diversity boxplots
2.6 β多样性分析
2.6.1 主成分分析(PCA)及无度量多维标定法(NMDS)分析 Model 组与Control 组各点间距离较远,菌群组成差异较大;Model 组与Pred 组样品距离较近,菌群组成较为相似,第一主成分对样品差异的贡献值为16.72%,第二主成分对样品差异的贡献值为13.87%(图8A)。NMDS 分析显示,Stress=0.073,样本组成差异显著。Control 组与Model 组各点距离较远,样本间物种组成存在显著差异;Model组和Pred 组间各点距离较近,物种组成差异较小,Control组与Pred组物种组成差异较大(图8B)。

图8 PCA及NMDS分析图Fig.8 PCA and NMDS analysis plots
2.6.2 门和属水平微生物区系组成比较 组间T-test 评估肠道菌群在门和属水平上组间差异显著(P<0.05)的物种,Control 组相比,Model 组变形杆菌门(Proteobacteria)丰度明显偏高;而酸杆菌门(Acidobacteria)仅在Control 组富集。与Model 组相比,醋酸泼尼松治疗后,放线菌门(Actinobacteria)、螺旋体菌门(Saccharibacteria)丰度显著降低。与Control组相比,Pred组中厚壁菌门(Firmicutes)、变形杆菌门(Proteobacteria)丰度偏高,拟杆菌门(Bacteroidetes)、螺旋体菌门(Saccharibacteria)丰度偏低,酸杆菌门(Acidobacteria)缺乏(图9A)。属水平物种比较表明,与Control 组比较,Model 组拟杆菌属(Bacteroides)、乳杆菌属(Lactobacillus)、普雷沃氏菌科_UCG-001(Prevotellaceae_UCG-001)丰度均值显著降低(P<0.05);螺杆菌(Helicobacter)、瘤胃梭菌属_6(Ruminiclostridium_6)、文肯菌属(Rikenella)、罗斯氏菌属(Roseburia)、瘤胃菌科_UCG-005(Ruminococcaceae_UCG-005)丰度均值显著升高(P<0.05)。醋酸泼尼松干预治疗后,与Model 组比较,Pred 组蓝绿藻菌属(Lachnoclostridium)、颤杆菌属(Oscillibacter)、粪球菌属_1(Coprococcus_1)、瘤胃球菌属_1(Ruminococcus_1)丰度均值升高(P<0.05);别样杆菌属(Alistipes)、文肯菌属(Rikenella)、瘤胃菌科_UCG-005(Ruminococcaceae_UCG-005)、双歧杆菌属(Bifidobacterium)、Candidatus_Saccharimonas丰度均值降低(P<0.05)。与Control 组比较,Pred 组小鼠肠道螺杆菌(Helicobacter)、蓝绿藻菌属(Lachnoclostridium)、未确定的瘤胃菌科(unidentified_Ruminococcaceae)、瘤胃球菌属_1(Ruminococcus_1)、支原体菌属(Mycoplasma)、颤杆菌属(Oscillibacter)丰度均值显著升高(P<0.05),缠结优杆菌(Eubacterium_nodatum_group)、Marvinbryantia、瘤胃菌科_NK4A214_组(Ruminococcaceae_NK4A214_group)丰度均值显著降低(P<0.05,图9B)。
2.6.3 组间特征差异物种比较 线性判别分析LEfSe(LDA Effect Size)寻找组间差异显著的物种,即Biomarker,具有高维生物标识特点。LDA 值分布柱状图展示,门水平上,Control 组小鼠肠道富集拟杆菌门下的普雷沃氏菌科(Prevotellaceae)、普雷沃氏菌科_UCG-001(Prevotellaceae_UCG-001)(倍变化评分分别为4.2 和4.125,图10A);与Model 组对比,Pred 组普雷沃氏菌科(Prevotellaceae)丰度差异最大(倍变化评分为4.3,图10B)。与Control 组对比,Pred组厚壁菌门下的梭菌纲(Clostridia)、梭菌目(Clostridiales)丰度差异最大(倍变化评分均为4.65),而Control 组丰度差异最大的为拟杆菌纲(Bacteroidia)、拟杆菌目(Bacteroidales)、拟杆菌科(Bacteroidetes)、拟杆菌科_S24_7_组(Bacteroidales_S24_7_group)(倍变化评分为4.6、4.6、4.6 和4.7,图10C)。

图10 组间LDA值分布柱状图及进化分支图Fig.10 LDA score bar graphs and evolutionary cladogram between groups
3 讨论
SSc 是一种病因和发病机制尚不明确的难治性自身免疫性疾病。研究报道,多种环境因素(感染因子、血管损伤、免疫异常、化学暴露和维生素D 缺乏)及遗传易感性驱动SSc发病,其中免疫异常被认为与SSc关系最为密切[14-16]。近年研究表明,肠道菌群失衡可导致肠道黏膜损伤、免疫功能紊乱,出现炎症细胞因子IL-6、IL-17 和TNF-α 等过表达诱发慢性炎症,持续慢性炎症诱发结缔组织免疫性疾病,累及全身多个器官或组织[17-18]。肠道菌群与自身免疫性疾病的关系已成为当下研究热点。
正常情况下,菌群维护肠道黏膜屏障,对机体免疫、生长发育和代谢起重要调节作用[19]。一旦菌群在定植部位发生丰度、多样性、结构及生物特性改变,平衡即被打破进而诱发疾病[20]。许多疾病进程及转归均与肠道菌群关系密切,LU 等[21]研究2 型糖尿病时发现肠道菌群失衡是胰岛素抵抗进展的重要危险因素。聂源等[22]研究肝癌与肠道微生态关系时也得到了同样结论。研究显示自身免疫性疾病与肠道菌群失衡有重大关系,RA、SLE 是菌群失调引起的异常免疫应答[23-25]。目前关于自身免疫性疾病与肠道菌群失调的关系研究主要集中于强直性脊柱炎、自身免疫性胰腺炎和克罗恩病等疾病,对SSc与肠道菌群的研究很少[26-28]。根据以上研究及SSc发病特点,推测SSc发生发展可能也与肠道菌群失调有关。本研究运用16S rRNA 基因测序技术对博来霉素诱导的SSc 小鼠肠道菌群状况进行观察,同时观察了SSc 常用药物GCs(醋酸泼尼松龙)在治疗SSc小鼠过程中对肠道菌群的影响。
本研究采用BLM 诱导SSc 小鼠模型,这一建模方法最先由YAMAMOTO 等[29]于1999 年建立,具有与人类SSc 皮肤、肺组织学特征相似的特点,是目前学界公认的SSc 模型之一。实验发现造模后小鼠出现精神差、活动慢、进食少、体型瘦小及皮肤明显硬化等生存状况不佳表现。病理发现皮肤、肺组织成纤维细胞及胶原纤维明显增多,纤维束增粗,结构排列紊乱;肺泡间隔增大、增多,肺组织正常结构损坏,伴有弥漫性肺纤维化表现,符合SSc 模型特征,与人体SSc 临床表现及病理改变基本一致。泼尼松龙能改善小鼠一般生存状况及病理表现,皮肤、肺组织胶原蛋白含量改善最为明显。
16S rRNA 细菌基因测序技术是通过对细菌16S rRNA 基因可变区进行特异性引物设计,利用高通量测序平台对不同样品进行高通量测序,获得16S rRNA 基因序列,比对基因库数据分析环境样本中细菌的技术,目前广泛用于肠道菌群谱鉴定分析。本研究发现,Model组与Control 组小鼠比较,肠道菌群发生明显变化,通过Observed_species 和PD_whole_tree 指数图发现肠道菌群丰富度、系统谱系多样性显著下降;通过韦恩图、PCA 及NMDS图分析发现Model组小鼠菌群组成结构与Control组小鼠存在显著差异;通过GraPhlAn 图、T-test 图得到两组间门及属水平上丰度差异显著的大量具体物种;通过LEfSe 图获得组间最具特征性差异的生物标志物。菌群这些改变可能参与SSc 发病及发展过程。变形菌门(Proteobacteria)包括很多病原菌属,在Model 组中丰度异常升高,可通过肠道运输至体循环,启动免疫细胞,影响远端器官炎症/纤维化反应,与ANDRÉASSON 等[30]近期对瑞典隆德大学、美国加利福尼亚大学洛杉矶分校的两组SSc 患者粪便菌群研究结论相似。瘤胃梭菌属_6(Ruminiclostridium_6)为致病菌,研究证实其丰度显著升高可加速高脂饮食导致的动脉硬化合并RA 疾病进展[31]。文肯菌属(Rikenella)丰度比例与甲状腺功能亢进引起的代谢异常程度呈正相关[32]。螺杆菌(Helicobacter)介导局部炎症及免疫应答,诱发宿主免疫损伤,与消化道疾病、免疫性疾病有关,其中幽门螺杆菌(H.pylori,HP)、肝螺杆菌是引起消化性溃疡、胃癌、肝癌的病原菌,且在HP 感染自身免疫性疾病包括SSc患者比例普遍偏高[33]。RADIĆ 等[34]研究表明HP 阳性与SSc 患者中皮肤及内脏临床受累程度有关,与疾病严重程度评分呈正相关,Model 组肠道中这些致病菌丰度显著升高可能与SSc 发病密切相关。拟杆菌属(Bacteroides)在Model 组丰度降低,与VOLKMANN等[35]报道加州大学洛杉矶分校17例SSc门诊患者研究结果一致,丰度低可导致免疫功能紊乱、内源性感染而致病;研究报道,乳酸杆菌属(Lactobacillus)是益生菌,可保护肠道黏膜屏障,通过调控炎症因子维持机体适度免疫,丰度低下可导致Th1/Th2 失衡,诱发RA[36]。本研究中Model 组其丰度降低,进而打破免疫平衡,促发自身免疫异常而致病。普雷沃氏菌_UCG-001(Prevotellaceae_UCG-001)丰度与抗炎因子呈正相关,与促炎因子呈负相关[37]。Model 组小鼠皮肤、肺部炎症浸润可能与其丰度显著降低有关;普雷沃氏菌科(Prevotellaceae)作为维持健康小鼠肠道微生态平衡的生物标志物,能维持肠道正常通透性及屏障功能,其丰度下降可导致免疫活性增加进而引发自身免疫病[38]。瘤胃球菌科_UCG-005(Ruminococcaceae_UCG-005)、罗斯氏菌属(Roseburia)可产生短链脂肪酸(SCFA),参与炎症反应和肠黏膜免疫,调控肿瘤免疫[39]。研究表明,瘤胃球菌科_UCG-005数量减少会加剧炎症性肠病、胃癌癌前病变进程,而丰度过高促使肝细胞损伤诱发癌变[40-41]。罗斯氏菌属在一定条件下具有抗炎作用,在慢性风湿性疾病、特发性关节炎等疾病中丰度持续下降,但在非病毒性肝细胞肝癌患者肠道中丰度显著升高[42-43]。因此,Model组这些条件致病菌丰度显著升高,可能与SSc 持续慢性炎症病变最终导致免疫功能失调有关。
GCs 是SSc 常用治疗药物,一般认为GCs 治疗SSc 的机制主要是抗炎、免疫抑制及抗纤维增生,GCs 对肠道菌群的影响研究较少,尤其是对SSc 肠道菌群的影响尚未见报道。本研究观察GCs药物醋酸泼尼松龙对SSc 小鼠治疗效果的同时,也观察了对SSc 小鼠肠道菌群的影响,发现醋酸泼尼松龙治疗过程中可有效改善SSc 小鼠一般生存状态及皮肤和肺组织纤维化程度,治疗28 d 后,肠道菌群也发生一系列变化。普雷沃氏菌科(Prevotellaceae)(Biomarker)在Pred组丰度回调。既往研究表明,别样杆菌属(Alistipes)可致炎症和肿瘤,驱动人类结肠炎和结直肠癌发病[44];Pred 可下调其丰度抑制炎症反应和过度免疫应答。蓝绿藻菌属(Lachnoclostridium)、颤杆菌属(Oscillibacter)、粪球菌属_1(Coprococcus_1)、瘤胃球菌属_1(Ruminococcus_1)均为产丁酸盐菌,具有抗炎作用,在Pred 组丰度显著增加可能发挥积极抗炎作用[45-48]。双岐杆菌属(Bifidobacterium)是公认的益生菌,为肠道提供酸性环境,维持肠道正常免疫功能,MS 状态下,丰度降低导致Th17 过度激活,免疫耐受失控而发病[49]。另有报道,Candidatus_Saccharimonas肠道丰度显著升高有利于减轻肠道炎症损伤,参与免疫调节及肠道修复[50]。实验中还观察到Pred 组与Control 组比较,致病菌螺杆菌(Helicobacter)、支原体菌属(Mycoplasma)丰度显著升高[51]。推测Pred 对上述有益菌属及致病菌丰度的逆向调节可能与激素治疗后出现肠道屏障破坏、菌群失调导致肠道炎症反应加重、炎症刺激自身抗原暴露、继发自身免疫性疾病等副作用有关[52]。同时,Pred 组厚壁菌门的梭菌纲(Clostridia)、梭菌目(Clostridiales)、未确定的瘤胃菌科(unidentified_Ruminococcaceae)丰度显著增多,有益菌Marvinbryantia、瘤胃菌科_NK4A214 组(Ruminococcaceae_NK4A214_group)、拟杆菌科_S24_7 组(Bacteroidales_S24_7_group),致病菌缠结真杆菌Eubacterium_nodatum_group丰度显著降低[53-56]。Pred 对模型小鼠肠道各分类细菌群的丰度调节与Control 组存在明显差异,Pred 组小鼠肠道菌群丰富度、谱系多样性有一定程度改善,但菌群组成结构与Model组相似,醋酸泼尼松龙无法完全恢复小鼠肠道微生态,可能是无法达到最佳SSc 治疗效果的原因之一。提示醋酸泼尼松龙有限影响了SSc 小鼠失衡的肠道菌群谱,但并不能根本改善SSc 小鼠失调菌群。研究结果给SSc 治疗带来了一些启示,应用GCs 治疗SSc 过程中尚需注意纠正肠道菌群失调状态,联用能够调控肠道菌群紊乱的药物和/或微生物制剂修复菌群失衡可能有利于提高SSc治疗效果。
本研究的局限表现为样本量小及缺乏时间纵向研究。尽管样本量小,本研究观察到了一些显著关联,表明本研究结果不是偶然的。此外,观察到疾病表型影响,尚未研究至分子水平,对菌群与SSc病程中炎症及纤维化的直接或间接联系以及激素通过菌群对SSc的分子调控机制有待进一步研究。

