miR-203 靶向调节PEG3/NF-κB 信号通路对糖尿病肾病大鼠肾纤维化的影响①
赵力敏 李雅婧 张勇刚 张颖玮(深圳市龙华区中心医院老年医学科,深圳 518110)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病患者死亡的主要原因[1]。目前研究认为,炎症-纤维化是DN 肾脏损伤的重要发展过程[2]。但引起DN患者肾脏炎症-纤维化发展的靶向调控机制还不十分明确。
父本表达基因3(paternally expressed gene 3,PEG3)位于人类染色体19q13.43,为人类印迹基因之一,既往研究认为PEG3 可作为肿瘤抑制启动子而介导癌细胞发展[3]。近来研究发现,PEG3 还可通过激活核转录因子-κB(nuclear transcription factorκB,NF-κB)通路来调控细胞的炎症、凋亡及纤维化过程[4]。已有研究证实,下调DN 模型大鼠中PEG3/NF-κB 表达,可显著阻断DN 大鼠肾脏的炎症-纤维化发展过程,从而改善肾损伤,提示PEG3/NF-κB 通路活化可能与DN 肾脏纤维化损伤关系密切[5]。但PEG3/NF-κB 信号通路的基因靶向调控机制不明确。
本研究应用基因信息预测软件发现miR-203 与PEG3 有靶向结合位点,进一步研究发现miR-203 异常表达也是引起DN患者肾损伤的风险因素之一[6]。已有研究证实miR-203 低表达可诱发DN 大鼠肾脏NF-κB 炎症通路活化而参与肾纤维化病变[7],预示干预miR-203表达,很可能通过影响PEG3/NF-κB通路活化,治疗DN 肾脏炎症-纤维化病变。本研究建立大鼠体内外DN 模型,对此进行探究验证,以期为DN新药研发及基因靶向治疗提供新的思路。
1 材料与方法
1.1 材料 SPF 级健康雄性SD 大鼠,体质量180~200 g,3 月龄,购自北京科兴中维生物技术有限公司,许可证号:SYXK(京)2020-0054。本实验符合3R原则,经广东医科大学实验动物伦理委员会批准(GDY2102633)。肾小管上皮细胞(NRK-52E)(货号:BH0361,ATCC公司);链脲霉素购自北京索莱宝公司;miR-203 模拟物(miR-203 mimic)及阴性对照(mimic NC)、PEG3 高表达重组载体(pcDNA-PEG3)及阴性对照(pcDNA-NC)均由上海生工生物有限公司构建;Lipofectamine®2000 转染试剂购自美国Invitrogen 公司;双萤光素酶报告基因检测试剂盒购自上海碧云天生物技术有限公司;PEG3、NF-κB、p-NF-κB、IL-6、IL-1β、Ⅰ型胶原(Collagen Ⅰ)、α-SMA、TGF-β1抗体均购自美国Abcam公司。
1.2 方法
1.2.1 DN动物模型建立及分组 取SD大鼠50只,给予高脂饲料(含12%蛋白、38%脂肪、50%碳水化合物)喂养5 周后,参照文献[8]方法于大鼠腹腔注射65 mg/kg 链脲霉素溶液3 d,1 次/d,建立大鼠DN模型,取大鼠腹主动脉血测空腹血糖,选择空腹血糖超过200 mg/dl 的大鼠(共50 只)进行后续试验,按随机数字表法分为模型组、miR-203 mimic 组、mimic NC 组、miR-203 mimic+pcDNA-PEG3 组、miR-203 mimic+pcDNA-NC 组,每组10 只。另取10 只大鼠正常饲养作为对照组。
miR-203 mimic 组及mimic NC 组大鼠分别于造模成功后,经尾静脉注射miR-203 模拟物(miR-203 mimic)及阴性对照(mimic NC)载体质粒;miR-203 mimic+pcDNA-PEG3 组及miR-203 mimic+pcDNANC 组大鼠注射miR-203 mimic 载体的同时,分别经尾静脉注射PEG3 高表达重组蛋白载体(pcDNAPEG3)及阴性对照(pcDNA-NC),各质粒注射浓度及体积分别为1 nmol/50 µl 及200 µl/kg,各组连续注射4周,2 次/周;模型组及对照组经尾静脉注射10 ml/kg生理盐水。
给药期间观察大鼠饮食及活动状况。给药结束后,收集24 h 尿液,试剂盒法测24 h 尿蛋白含量;大鼠禁食禁水12 h,取腹主动脉血3 ml,ELISA 法测空腹血糖、血清肌酐(serum creatinine,Scr)、尿素氮(blood urea nitrogen,BUN)水平,以评价肾功能水平。处死大鼠取肾,左肾切取一半组织,送电镜室观察肾组织结构变化、另一半组织用甲醛固定后制成石蜡切片,行Masson 染色观察纤维化变化,右肾精密称重后在液氮中保存备用。
1.2.2 DN 细胞模型及分组 取NRK-52E 细胞株,37 ℃水浴复苏后,取适量,用含10%胎牛血清的低糖培养基重悬后,接种于25 cm2培养瓶中,在37 ℃、5%CO2培养箱中进行常规传代培养及计数。待细胞融合度达70%时,换为无胎牛血清的低糖培养基培养12 h 后,分为对照组、模型组、miR-203 mimic 组、mimic NC 组、miR-203 mimic+pcDNA-PEG3 组、miR-203 mimic+pcDNA-NC组,每组设置6个复孔。
对照组用含10%胎牛血清的低糖培养基常规培养48 h;高糖组参照文献[9]方法用含2%胎牛血清的高糖培养基(30 mmol/L葡萄糖)进行干预培养,以模拟DN 肾间质纤维化模型;miR-203 mimic 组及mimic NC 组用Lipofectamine 2000 转染试剂向NRK-52E细胞转染miR-203 mimic及mimic NC质粒,转染12 h 后用含2%胎牛血清的高糖培养基(30 mmol/L葡萄糖)处理48 h;miR-203 mimic+pcDNA-PEG3 组及miR-203 mimic+pcDNA-NC 组在miR-203 mimic组基础上分别转染pcDNA-PEG3 及pcDNA-NC质粒。
各组处理培养48 h 后,取细胞检测培养基中炎症因子IL-6、IL-1β 水平及促纤维化因子TGF-β1、Collagen Ⅰ水平,以评价肾小管上皮细胞发生炎症-纤维化变化。
1.2.3 qRT-PCR 检测肾组织及细胞miR-203 表达 取冰冻肾组织及处理培养的各组细胞,粉碎、研磨及匀浆处理后,Trizol抽提总RNA,以总RNA 为模板反转录得cDNA,行PCR 扩增反应。miR-203以U6 为内参基因,2-ΔΔCt算法计算miR-203 表达水平。引物由上海生工生物工程股份有限公司合成。
1.2.4 ELISA 法检测细胞中炎症因子和促纤维化因子水平 取处理培养的各组细胞,匀浆处理后,取匀浆上清液,使用ELISA 试剂盒检测细胞中IL-6、IL-1β、TGF-β1、Collagen Ⅰ含量。
1.2.5 Western blot检测肾组织及细胞PEG3、NF-κB及相关蛋白表达 取冰冻肾组织及处理培养的各组细胞,粉碎、研磨及匀浆处理后,取匀浆上清液,提取蛋白,BCA法测总浓度后,制备分离胶,取100 µg蛋白,进行电泳及转膜反应,5%脱脂奶粉封闭及TBST洗膜后,滴加1∶500的一抗抗体(PEG3、NF-κB、p-NF-κB、IL-6、IL-1β、Collagen Ⅰ、α-SMA、TGF-β1)及β-actin(1∶800)内参抗体孵育过夜,1∶1 000 的HRP 羊抗兔二抗室温孵育1 h 后,化学发光液浸膜显色后,Image J软件分析蛋白条带相对灰度值。
1.2.6 双荧光素酶报告试验验证miR-203 与PEG3的靶向关系 通过Starbase 网站预测miR-203 与PEG3 存在互补配对的碱基序列。构建含有miR-203 结合位点的PEG3-3´UTR 野生型(WT)和突变型(MUT)片段,并分别克隆至荧光素酶报告质粒中,得到PEG3-3´UTR-WT 及PEG3-3´UTR-MUT 荧光素酶报告质粒,Lipofectamine 2000 转染试剂将PEG3-3´UTR-WT 及PEG3-3´UTR-MUT 质粒分别与mimic NC 或miR-203 mimic 试剂共转染至NRK-52E 细胞中,48 h后添加萤火虫和海参荧光素酶试剂,检测荧光素酶活性。
1.3 统计学分析 以SPSS22.0软件对实验数据进行统计分析,计量资料以表示,多组间比较采用单因素方差分析,进一步两组间比较行SNK-q检验,P<0.05表示差异有统计学意义。
2 结果
2.1 DN 细胞模型中miR-203 及PEG3/NF-κB 通路蛋白表达变化 与对照组相比,DN 细胞模型中miR-203 表达降低(P<0.05),PEG3、p-NF-κB/NF-κB蛋白表达升高(P<0.05)。见图1、表1。
表1 DN 模型细胞中miR-203、PEG3、p-NF-κB/NF-κB 表达变化比较()Tab.1 Comparison of expression changes of miR-203,PEG3 and p-NF-κB/NF-κB in DN model cells()

表1 DN 模型细胞中miR-203、PEG3、p-NF-κB/NF-κB 表达变化比较()Tab.1 Comparison of expression changes of miR-203,PEG3 and p-NF-κB/NF-κB in DN model cells()
Note:Compared with control group,1)P<0.05.

图1 Western blot 检测DN 模型细胞中PEG3、p-NF-κB、NF-κB蛋白表达Fig.1 Western blot detection of protein expressions of PEG3,p-NF-κB and NF-κB in DN model cells
2.2 DN模型大鼠肾组织中miR-203及PEG3/NF-κB通路蛋白表达变化 与对照组相比,DN 模型大鼠肾组织及细胞中miR-203 表达降低(P<0.05),PEG3、p-NF-κB/NF-κB 蛋白表达升高(P<0.05)。见图2、表2。
表2 DN 模型大鼠肾组织中miR-203、PEG3、p-NF-κB/NF-κB表达变化比较()Tab.2 Comparison of expression changes of miR-203,PEG3 and p-NF-κB/NF-κB in kidney tissue of DN model rats()
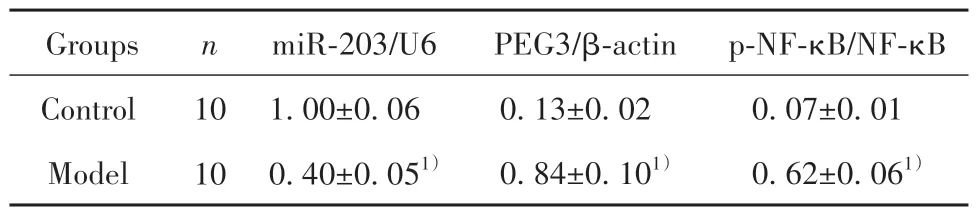
表2 DN 模型大鼠肾组织中miR-203、PEG3、p-NF-κB/NF-κB表达变化比较()Tab.2 Comparison of expression changes of miR-203,PEG3 and p-NF-κB/NF-κB in kidney tissue of DN model rats()
Note:Compared with control group,1)P<0.05.
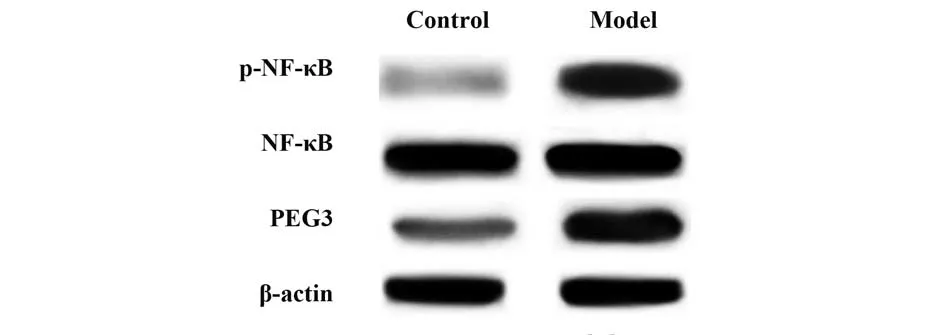
图2 Western blot 检测DN 模型大鼠肾组织中PEG3、p-NF-κB、NF-κB蛋白表达Fig.2 Western blot detection of protein expressions of PEG3,p-NF-κB and NF-κB in kidney tissue of DN model rats
2.3 miR-203 对PEG3 的靶向调控作用 Starbase数据库预测试验及双荧光素酶报告试验发现,miR-203与PEG3之间存在靶向结合位点,NRK-52E 细胞共转染miR-203 mimic 和无突变的PEG3-WT 载体,可使NRK-52E 细胞中荧光素酶活性显著下降(P<0.05),而共转染miR-203 mimic 和发生突变的PEG3-MUT 载体对荧光素酶活性无显著影响(P>0.05)。见图3、表3。
表3 荧光素酶活性比较()Tab.3 Comparison of luciferase activity()

表3 荧光素酶活性比较()Tab.3 Comparison of luciferase activity()
Note:Compared with PEG3-MUT+mimic-NC group,1)P<0.05.
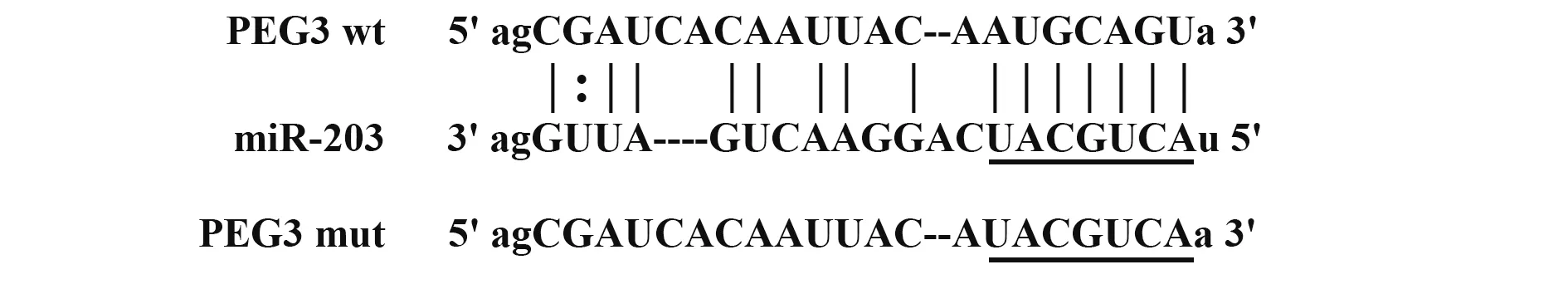
图3 Starbase数据库预测图Fig.3 Starbase database forecast
2.4 miR-203 对肾组织及细胞PEG3/NF-κB 通路靶向调控的影响 与对照组相比,DN 模型组肾组织及细胞中miR-203 表达降低(P<0.05),PEG3、p-NFκB/NF-κB 蛋白表达升高(P<0.05)。与DN 模型组相比,miR-203 mimic 组肾组织及细胞中miR-203 表达升高(P<0.05),PEG3、p-NF-κB/NF-κB 蛋白表达降低(P<0.05);mimic NC 组miR-203及PEG3、p-NFκB/NF-κB 蛋白表达差异无统计学意义(P>0.05)。与miR-203 mimic 组 相比,miR-203 mimic+pcDNAPEG3 肾组织及细胞中miR-203 表达差异无统计学意义(P>0.05),PEG3、p-NF-κB/NF-κB 蛋白表达升高(P<0.05)。miR-203 mimic+pcDNA-NC组miR-203及PEG3、p-NF-κB/NF-κB 蛋白表达与miR-203 mimic组相比差异无统计学意义(P>0.05)。见图4、表4。
表4 DN肾组织及细胞中miR-203、PEG3、p-NF-κB/NF-κB蛋白表达变化比较()Tab.4 Comparison of protein expressions of miR-203,PEG3 and p-NF-κB/NF-κB in DN renal tissues and cells()
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with miR-203 mimic group,3)P<0.05.

图4 肾组织及细胞中PEG3、p-NF-κB、NF-κB蛋白表达Fig.4 Protein expression of PEG3,p-NF-κB,NF-κB in renal tissues and cells
2.5 上调miR-203 对DN 大鼠肾组织结构、纤维化病变及肾功能的影响 电镜观察可见,对照组大鼠肾组织结构正常,模型组大鼠肾小球基底膜分层不清晰、增厚、细颗粒状物质沉积明显,肾小囊呈玻璃滴状病变,肾血管中不规则形态的红细胞形成较多。miR-203 mimic组大鼠肾小球基底膜增厚减轻,分层(外疏松层、致密层和内疏松)较清晰,细颗粒状物质沉积减少,肾小囊未见明显玻璃滴状病变,肾血管中红细胞形态逐渐规则。mimic NC 组肾组织结构病变与模型组相近。miR-203 mimic+pcDNANC 组肾组织结构病变与miR-203 mimic 组相近。miR-203 mimic+pcDNA-PEG3 肾组织结构病变较miR-203 mimic组严重,但较模型组减轻,见图5。

图5 大鼠肾组织电镜、Masson染色图(×400)Fig.5 Electron microscope and Masson staining of rat kidney chart(×400)
Masson 染色可见对照组肾组织胶原沉积染色较浅;模型组可见肾间质胶原沉积染色加深,肾组织纤维化严重。miR-203 mimic 组大鼠肾间质胶原沉积染色变浅,纤维化减轻。mimic NC 组肾组织纤维化与模型组相近。miR-203 mimic+pcDNA-NC 组肾组织纤维化与miR-203 mimic 组相近。miR-203 mimic+pcDNA-PEG3肾组织纤维化较miR-203 mimic组严重,但较模型组减轻,见图5。
与对照组相比,模型组大鼠血糖、24 h 尿蛋白、血清SCr、BUN 水平升高(P<0.05)。与模型组相比,miR-203 mimic 组血糖、24 h 尿蛋白、血清SCr、BUN水平降低(P<0.05);mimic NC 组血糖、24 h 尿蛋白、血清SCr、BUN 水平与模型组相比差异无统计学意义(P>0.05)。与miR-203 mimic 组相比,miR-203 mimic+pcDNA-PEG3 组大鼠血糖、24 h 尿蛋白、血清SCr、BUN 水平升高(P<0.05)。miR-203 mimic+pcDNA-NC组血糖、24 h 尿蛋白、血清SCr、BUN 水平较模型降低(P<0.05),见表5。
表5 大鼠24 h尿蛋白、血清Scr、BUN比较()Tab.5 Comparison of 24 h urinary protein,serum Scr and BUN in rats()

表5 大鼠24 h尿蛋白、血清Scr、BUN比较()Tab.5 Comparison of 24 h urinary protein,serum Scr and BUN in rats()
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with miR-203 mimic group,3)P<0.05.
2.6 上调miR-203 对DN 细胞炎症-纤维化的影响 与对照组相比,模型组肾小管上皮细胞炎症因子IL-6、IL-1β 及促纤维化因子TGF-β1、Collagen Ⅰ水平升高(P<0.05)。与模型组相比,miR-203 mimic组肾小管上皮细胞炎症因子IL-6、IL-1β及促纤维化因子TGF-β1、Collagen Ⅰ水平降低(P<0.05);mimic NC 组肾小管上皮细胞炎症因子IL-6、IL-1β 及促纤维化因子TGF-β1、Collagen Ⅰ水平与模型组相比差异无统计学意义(P>0.05)。与miR-203 mimic 组相比,miR-203 mimic+pcDNA-PEG3 组肾小管上皮细胞炎症因子IL-6、IL-1β 及促纤维化因子TGF-β1、Collagen Ⅰ水平升高(P<0.05)。miR-203 mimic+pcDNA-NC 组肾小管上皮细胞炎症因子IL-6、IL-1β及促纤维化因子TGF-β1、Collagen Ⅰ水平较模型组降低(P<0.05),见表6。
表6 各组细胞IL-6、IL-1β、TGF-β1及CollagenⅠ水平比较()Tab.6 Comparison of IL-6,IL-1β,TGF-β1 and Collagen Ⅰ of cells in each group()
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with miR-203 mimic group,3)P<0.05.
2.7 上调miR-203 对DN 大鼠肾组织IL-6、IL-1β、Collagen Ⅰ、α-SMA、TGF-β1蛋白表达的影响 与对照组相比,模型组大鼠肾组织IL-6、IL-1β、Collagen Ⅰ、TGF-β1 蛋白表达升高(P<0.05)。与模型组相比,miR-203 mimic组大鼠肾组织IL-6、IL-1β、Collagen Ⅰ、TGF-β1 蛋白表达降低(P<0.05);mimic NC 组大鼠肾组织IL-6、IL-1β、Collagen Ⅰ、TGF-β1 蛋白表达与模型组相比差异无统计学意义(P>0.05)。与miR-203 mimic 组相比,miR-203 mimic+pcDNA-PEG3 组大鼠肾组织IL-6、IL-1β、Collagen Ⅰ、TGF-β1 蛋白表达升高(P<0.05)。miR-203 mimic+pcDNA-NC 组大鼠肾组织IL-6、IL-1β、Collagen Ⅰ、TGF-β1 蛋白表达较模型组降低(P<0.05),见图6、表7。
表7 各组大鼠肾组织IL-6、IL-1β、CollagenⅠ和TGF-β1蛋白表达比较()Tab.7 Comparison of protein expressions of IL-6,IL-1β,Collagen Ⅰand TGF-β1 in renal tissue of rats in each group()

表7 各组大鼠肾组织IL-6、IL-1β、CollagenⅠ和TGF-β1蛋白表达比较()Tab.7 Comparison of protein expressions of IL-6,IL-1β,Collagen Ⅰand TGF-β1 in renal tissue of rats in each group()
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with miR-203 mimic group,3)P<0.05.

图6 各组大鼠肾组织IL-6、IL-1β、Collagen Ⅰ和TGF-β1蛋白表达Fig.6 Protein expressions of IL-6,IL-1β,Collagen Ⅰand TGF-β1 in renal tissue of rats in each group
3 讨论
据国际糖尿病联盟统计表明,预计到2035年糖尿病患者将达到5.52 亿,到2040 年,中国糖尿病患者将高达1.5 亿,位居世界第一[10]。DN 一旦发现临床症状时往往已发展成为肾衰竭,发达国家已将DN 认为是引起终末期肾衰竭死亡的首位原因,我国DN 引起的终末期肾衰竭已高居第二位[11]。因此,防治DN的发生发展迫在眉睫。
持续的高脂高糖刺激,可引起动物模型肾小球持续的滤过增加,导致肾小球硬化及间质纤维化的发展,并表现为蛋白尿及持续的肾功能下降[12]。本研究用高脂饲料持续喂养+链脲霉素诱导肾损伤建立大鼠DN 模型后发现,大鼠出现血糖升高及蛋白尿升高、肾功能下降(血清SCr和BUN升高)、肾小球基底膜增厚及肾纤维化胶原沉积严重等类似人类DN 病理改变,提示造模成功。高糖刺激肾小管上皮细胞,可促进细胞炎症因子如IL-6、IL-1β释放,而IL-6、IL-1β 的释放一方面会诱导组织细胞损伤,另一方面会促进TGF-β1 活化来导致细胞由上皮特性转化为间质表型(即EMT 特性改变),EMT 特性改变过程中胞外基质增厚及胶原沉积而引起纤维化[13-14]。大量体外实验发现,高糖刺激可促进肾小管上皮细胞发生炎症-纤维化病变,而模拟DN 肾纤维化发生机制[15]。本研究发现,体外DN 模型细胞及DN 模型大鼠,肾小管上皮细胞及肾组织中IL-6及IL-1β、TGF-β1 及纤维化标志因子如Collagen Ⅰ、CollagenⅣ、α-SMA 及FSP-1 表达均升高,进一步证实,高糖环境下,炎症与肾纤维化发展关系密切。
抑制炎症反应是缓解DN 肾纤维化发展的重要手段之一。HASSAN等[16]及XU等[17]发现阻断NF-κB炎症通路活化,可显著抑制TGF-β1 促纤维化活化,而改善DN 体内外模型肾纤维化病变。miRNA 与DN炎症-纤维化病变发生关系密切,并在DN诊断及靶向治疗方面有潜在应用价值。大量体内外研究实验发现,DN 患者或模型中,miRNA 异常表达可间接或直接影响炎症通路NF-κB 活化,参与肾脏间质纤维化改变[18]。miRNA中的miR-203在某些肿瘤发展中作为抑制因子,近来研究发现,miR-203 的异常改变是引起脏器如心脏纤维化发展的重要原因[19]。LIU 等[7]发现miR-203 也与NF-κB 依赖的炎症反应强度有关,且miR-203 可靶向作用于Toll 样受体而间接影响NF-κB 活性,来参与DN 肾脏发展,提示干预miR-203 表达可能为缓解DN 炎症-纤维化发展的重要机制之一。本研究发现,DN 大鼠及细胞模型中miR-203表达,异常低于正常大鼠及正常细胞,进一步上调miR-203 表达后,大鼠及细胞DN 模型NF-κB 炎症通路活化被抑制,促纤维化通路及细胞因子表达也显著降低,证实上调miR-203 可通过抑制NF-κB 炎症通路活化,来改善DN 肾脏炎症-纤维化发展。
PEG3 为NF-κB 炎症通路活化的上游重要调控因子。过往研究发现,PEG3 可通过肿瘤坏死因子受体转导蛋白活化来刺激NF-κB 活化而引起肿瘤微环境改变,来影响肿瘤发展[20]。近来研究发现敲低PEG3,可通过抑制NF-κB 活化来降低肝脏、肾脏及心脏纤维化,预示PEG3/NF-κB 通路在组织炎症-纤维化病变过程中扮演重要角色[4-5,21]。本研究发现,PEG3 在DN 大鼠肾组织及细胞模型中表达异常升高,且PEG3 与miR-203 之间有靶向结合位点,上调PEG3表达后,可部分逆转miR-203高表达发挥的抑制NF-κB 活化、改善炎症-纤维化等作用,提示miR-203 发挥抗DN 炎症-纤维化作用,可能与靶向抑制PEG3/NF-κB通路活化有关。
综上所述,miR-203 可靶向负调控PEG3/NF-κB通路,上调miR-203 表达,可靶向抑制PEG3/NF-κB通路活化,发挥抗DN 肾脏炎症-纤维化病变。这为DN 的基因靶向治疗提供一定思路。但PEG3 的上调并不能完全逆转miR-203 的抗炎症-纤维化作用,预示miR-203 还可能通过其他通路改善DN 肾脏损伤,这有待后续继续研究。