大豆基冻干酸奶块工艺条件和产品特性研究
胡泊潇, 李兴飞, 张 钊, 曹连锋, 王才立, 华欲飞*
(1. 江南大学食品学院,江苏无锡 214122;2. 山东嘉华生物科技股份有限公司,山东聊城 252499)
液态酸奶产品的货架期较短,通过冷冻干燥或喷雾干燥等方法制得的固体酸奶产品在一定程度上弥补了这一缺陷。 固体酸奶产品包括酸奶粉和酸奶块,前者主要应用于冲饮,烘焙[1-3],而酸奶块是指以酸奶为基料,加入一定的助剂,经冷冻干燥制成的块状食品,具有方便即食、口感酥脆等特点,目前市场认可度较高。 与采用喷雾干燥生产的酸奶粉不同,酸奶块采用冷冻干燥法制备,能够最大限度地保存活性乳酸菌, 并且有效保证产品的口味和营养。 近年来植物基酸奶越来越受到关注,其中大豆酸奶是研究和产品开发的热点[4-6]。 然而截至目前,市场上以植物基酸奶为原料的酸奶固体产品还很少。 因此以植物基原料开发冻干酸奶块,既能够填补市场空白,也能够丰富植物基产品的品类。
目前关于酸奶冷冻干燥的研究较少,研究内容也较为分散。Carvalho 等提出将酸奶与糖、增稠剂等辅料混合后使用氮气发泡后进行干燥[7]。 与热风干燥产品相比, 冷冻干燥相产品具有堆积密度低,孔隙率高,口感松脆细腻等优点。 Wang 等考察了原料预处理和几种冻干赋形剂对产品质构的影响[8],发现添加质量分数0.1%的果胶和冻干前加热处理能够有效增强产品的硬度和脆度,并可改善冻干酸奶中钙的生物可及性;Ismail 等研究了助剂添加对冻干酸奶块理化特性、结构和乳酸菌存活情况的影响[9],发现嗜热链球菌在该体系内的存活能力较强,乳清蛋白的添加能够使产品结构更加疏松, 孔隙度更高。 到目前为止,关于冻干工艺条件对酸奶块性质影响的研究报道较少。
作者对比了大豆基冻干酸奶块料液与牛乳基冻干酸奶块料液的关键参数,并在此基础上选取预冻温度、混料温度对冻干酸奶块物理性质和乳酸菌存活率的影响较大的因素进行了考察和优化,并以牛乳基冻干酸奶块体系为对照比较了乳酸菌存活情况,为植物基冻干酸奶块的开发和改进提供参考。
1 材料与方法
1.1 材料
东北大豆:市售产品;直投式发酵剂(含嗜热链球菌、保加利亚乳杆菌、双歧杆菌、嗜酸乳杆菌):市售。
1.2 试剂
MRS 固体培养基:杭州百思生物技术有限公司产品;冰乙酸,乳酸,氢氧化钠:均为分析纯,国药集团化学试剂有限公司产品;2-甲基-3-庚酮标准物:西格玛-奥德里齐公司产品。
1.3 仪器与设备
AB204-N 型分析天平、PHS-3C pH 计: 梅特勒-托利多仪器有限公司产品;HHS 恒温水浴锅:金坛医疗仪器厂产品;UMC5 斩拌锅:德国Stephan 产品;SCIENTZ-10ND 型冷冻干燥机: 宁波新芝生物科技股份有限公司产品;超净工作台:无锡一净设备有限公司产品; 手提式不锈钢压力蒸汽灭菌锅:上海申安医疗器械厂产品;TA-XTPlus 质构仪:英国SMS 公司产品;SC202-2 电热恒温干燥箱: 江苏南通实验电器厂产品;DSC3 差示扫描量热仪:瑞士梅特勒-托利多公司产品;DVB/CAR/PDMS,50/30 μm萃取头:美国Supelco 公司产品;气质联用仪(SCION SQ 456GC-MS): 美国bruker 公司产品;FA25 高速剪切乳化机:上海弗鲁刻流体机械制造有限公司产品;磨浆系统:作者所在实验室自制。
1.4 实验方法
1.4.1 大豆酸奶的制备方法大豆→浸泡 (25 ℃,12 h)→磨浆→灭酶(95 ℃,10 min)→调配(质量分数2.5%蛋白质溶液)→均质 (40 MPa)→杀菌(95℃,10 min)→冷却至42 ℃左右→接种→发酵(42℃,5 h)→后熟(4 ℃,12 h)
1.4.2 冻干酸奶块制备方法按照质量分数3%麦芽糊精,质量分数2%甘露醇,质量分数2%预糊化淀粉, 酸奶补足质量至100%配料, 在斩拌锅中以600 r/min 恒温真空混料20 min,获得分散均匀的料液。 将以上料液倒入模具中,铺料厚度为5 mm,转入冻干机内进行预冻和冷冻干燥,预冻阶段通过对隔板制冷与物料进行接触换热, 预冻结束后抽真空,通过控制隔板程序升温向物料供热以达到使物料中水分升华的目的。
1.4.3 差示扫描量热 (DSC)参照Rahman 的方法[10], 取经过混料所得的冻干前的原料液精确称量约10 mg 放入铝制坩埚中封装,并按照以下程序进行测定。
程序1: 将精确计重的10 mg 左右样品放入密封的铝盒中, 从25 以10 ℃/min 的速率冷却至-30℃并保持2 min。 从-30 ℃到25 ℃以10 ℃/min 的速率进行扫描。 用该方法确定样品的共晶点和共熔点, 通过STARe Evaluation 软件对峰面积积分获得样品的结晶热和熔化热,结合水的单位相变热和样品质量可计算得样品中的自由水含量。
程序2: 将精确计重的10 mg 样品放入密封样品盒中,从25 ℃以10 ℃/min 冷却至-40 ℃,保温2 min;以10 ℃/min 的速率扫描至-30 ℃退火处理20 min;以5 ℃/min 扫描至-40 ℃,保温2 min;以5 ℃/min 扫描至25 ℃,从热图中识别出玻璃化转变(台阶)。
样品中自由水含量按照公式(1)进行计算。
式中:x为自由水质量,g;△H为样品结晶或熔化的相变热,J;334.72 为水的单位结晶热或熔化热,J/g。
1.4.4 质构分析参照Carvalho 的方法[7],使用TA.XT-plus 物性分析仪对冻干产品进行测定。 探头:P/0.25s 球形探头;测前速度:2 mm/s;测试速度:2 mm/s;测后速度:10 mm/s; 触发力:5 g; 终止条件: 形变70%(确保样品发生断裂)。每个样品重复测定3 次。
定义峰值力为断裂力(g),并记录断裂时间(s)辅助评价。
1.4.5 可滴定酸度的测定参照国标GB009.239—2016 食品酸度的测定中的第二法即pH 计法。 称取10 g(精确到0.001 g)混匀的样品,置于50 mL 一次性塑料盒中, 加入10 mL 新煮沸冷却至室温的水,加入转子混匀, 在搅拌的情况下用精确标定过的0.05 mol/L 的氢氧化钠溶液滴定至pH 稳定在8.30±0.01 处4~5 s, 记录所用的氢氧化钠标准溶液的体积。 实验结果以酸度表示,按照公式(2)进行计算。
式中:X为试样的酸度,°T;c为氢氧化钠标准溶液的浓度,mol/L;V为试样滴定至终点时所消耗的氢氧化钠标准溶液的体积,mL;m为试样的质量,g;0.1为酸度理论定义氢氧化钠的浓度,mol/L。
1.4.6 乳酸菌活菌的测定在GB4789.35—2016中的乳酸菌计数方法的基础上,参考岳林芳[11]和谭允冰[12]的选择性计数方法进行优化。 取一定量样品精确称重(精确至0.001 g),加入质量分数0.85%~0.90%的无菌生理盐水进行10 倍稀释,不断重复该操作稀释至106倍,选取2~3 个连续的适宜稀释度,每个稀释度取1 mL 匀液于无菌培养皿中, 每个稀释度做2 个平行,倒入10~15 mL 冷却至48 ℃左右的MRS-pH 6.2(针对乳酸菌总数)或MRS-pH 5.4(使用醋酸进行酸化, 选择性计数除嗜热链球菌以外的乳酸菌)琼脂固体培养基,转动培养基使其混合均匀,37 ℃培养48~72 h,计算平板上的单菌落总数,结合取样质量和稀释倍数,按照CFU/g 干物质计算得出样品中的乳酸菌数。
1.5 数据处理
实验均重复3 次,采用Origin 对数据进行分析和绘图,结果用“平均值±标准偏差”表示,通过SPSS Statistic 25 软件对数据结果进行分析(ANOVA),并采用Dunkan 进行显著性分析, 以不同字母角标代表具有统计学差异(P<0.05)。
2 结果与分析
2.1 酸奶块原料液的冻干参数
图1所示为大豆基酸奶块冻干原料液的DSC测定曲线, 从该曲线可以了解原料液的共晶点、共熔点及玻璃化转变温度。 由图1 可知,大豆基酸奶块冻干原料液的结晶峰(共晶点)为-9.04 ℃,熔化峰起点(共熔点)为-3.32 ℃,玻璃化转变温度为-30.73 ℃。 根据结晶或融化峰所得焓值计算得到原料液的自由水质量分数为62.41%,而根据原料液配方可知总水分质量分数为78.56%。 由此可见,大豆基酸奶块冻干原料液的结合水质量分数为16.16%。
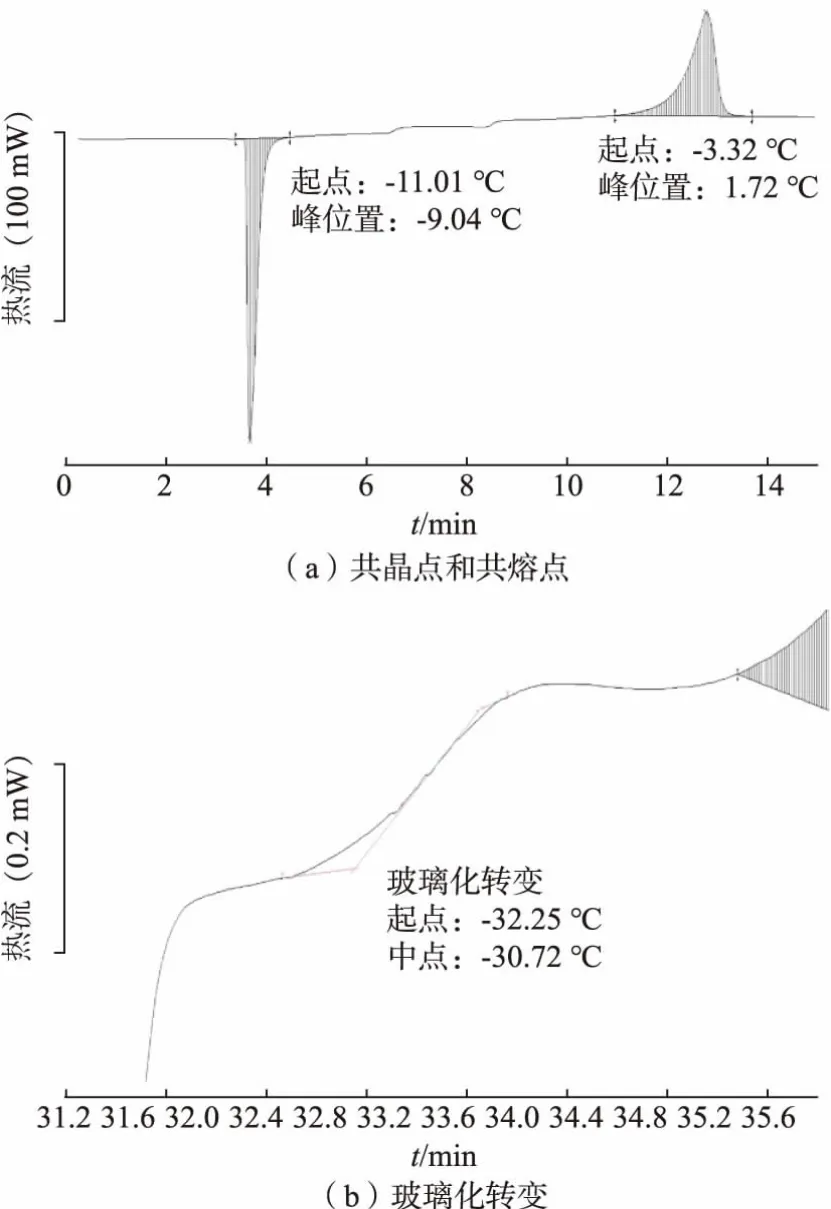
图1 大豆基冻干酸奶块冻干原料液共晶点、 共熔点及玻璃化转变温度DSC 热图Fig. 1 DSC thermogram of the eutectic point, melting point, and glass transition temperature of freezedried soy-based yogurt block raw material solution
作为比较,研究中以脱脂乳粉复原乳和大豆油为原料, 配制与大豆基冻干酸奶块相同固形物、蛋白质和脂肪含量牛乳基酸奶块原料液,其DSC 分析结果如图2 所示。 从图中可知牛乳基酸奶块原料液的的共晶点、共熔点以及玻璃化转变温度分别为-9.79,-3.87 ℃和-30.27 ℃。另外,其总水分、自由水和结合水质量分数分别为77.97%、59.46%和18.25%。 从以上结果看,牛乳基冻干酸奶块原料液与大豆基酸奶块原料液的冻干参数无明显差别,因此两体系的冻干程序可以通用。
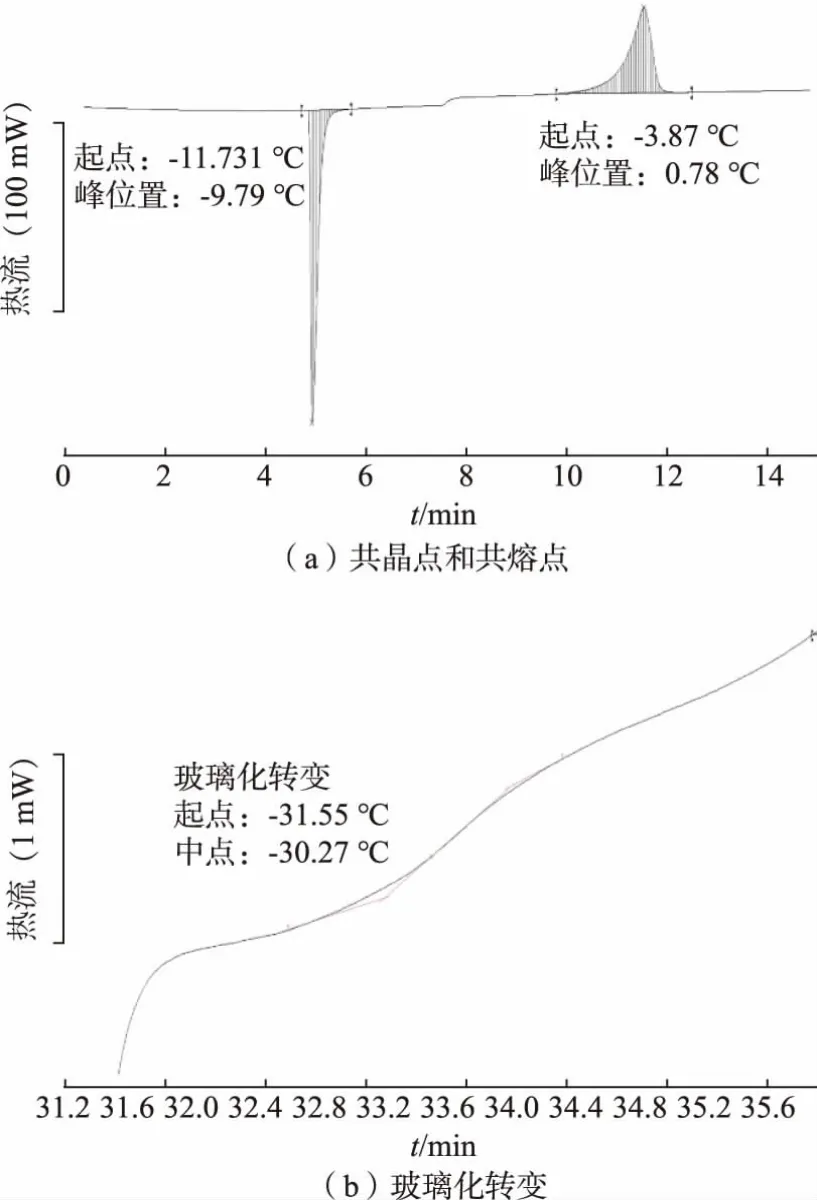
图2 牛乳基冻干酸奶块冻干原料液共晶点、 共熔点及玻璃化转变温度DSC 热图Fig. 2 DSC thermogram of the eutectic point, melting point, and glass transition temperatures of freezedried dairy-based yogurt block raw material solution
原料液的共晶点和共熔点对产品的冻干曲线设计具有重要意义。 物料的共晶点是指混合体系内的水完全冻结成为冰晶时的温度,共熔点是指已冻结物料在加热升温开始熔化时的温度。 理论上,预冻温度只要低于物料共晶点温度即可,而在实际生产中,为保证冻实,一般设定预冻温度为物料共晶点以下10~15 ℃[13]。抽真空后,冻干机开始加热为水分升华提供热量,但是要控制热量输入水平,保证温度接近且低于共晶点温度,防止产品结构崩解。
2.2 预冻温度对大豆基冻干酸奶块产品品质的影响
2.2.1 预冻温度对产品结构及质构的影响图3 显示采用不同隔板温度进行预冻时,物料温度随时间变化的曲线。 从图3 可以看出,当温度分别设定-18 ℃和-25 ℃时, 隔板在10 min 之内即下降到设定温度; 当设定温度为-45 ℃时, 隔板需要90 min才能下降到设定温度。 物料温度降低明显滞后于隔板温度。 在室温至0 ℃区间,对应不同隔板设定温度的料液温度具有几乎相同的变化趋势。 然而,不同隔板温度使物料达到共晶温度所需要的时间有一定的差别,隔板温度为-45、-25、-18 ℃时,样品冻结时间分别为0.6、0.6、1.3 h,预冻温度越高,样品的冻结时间越晚。
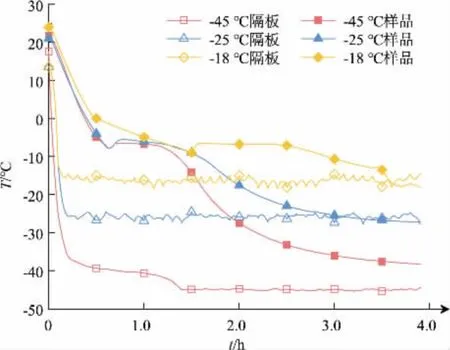
图3 不同预冻温度下隔板与样品的温度Fig. 3 Temperature of baffle and sample at different prefreezing temperatures
图4显示不同隔板温度预冻条件下产品的断面结构,-18 ℃预冻所得产品的结构较为疏松,冰晶斜向生长产生较大的内部空间;-25 ℃预冻样品内部结构致密, 且内部空间大多为纵向生长冰晶产生,-45 ℃预冻产品出现较多塌陷,结构致密,几乎没有内部空间产生。 预冻温度对产品结构的影响使产品反映出不同的质构特性,如表1 所示,随预冻温度降低,结构愈加紧密,产品的断裂力有上升趋势,-18 ℃预冻样品断裂时间最长,-25 ℃和-45 ℃预冻样品的断裂时间略有缩短。
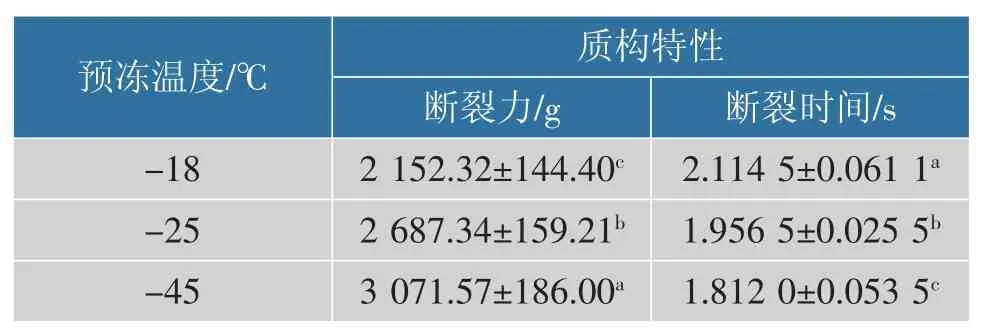
表1 不同预冻温度获得产品的质构特性Table 1 Textural characteristics of products obtained at different pre-freezing temperatures

图4 不同预冻温度下的样品断面外观Fig. 4 Cross-sectional appearance of samples at different pre-freezing temperatures
隔板设定温度低可快速冻结,有利于较小冰晶的生成;隔板温度设定高,慢速冻结则易产生较大冰晶。 预冻温度为18 ℃时,料液内上下层温度差别不大,冰晶不定向生长,冻干产品具有疏松甚至易碎的质构特性,因此产品的断裂力最小,断裂时间最短;预冻温度为-25 ℃时,较快的冻结速度,导致样品料液内出现较明显的温度梯度,因此出现冰晶定向生长的现象[14]。同时由于生成冰晶较小,冻干产品结构更为致密,在质构特性上表现出较高的断裂力,断裂时间比-18 ℃预冻所得产品稍短;-45 ℃预冻样品料液温度距玻璃化转变温度较近,冰晶生成较小,升华形成的水汽通路过于狭小,易引起局部高压或塌陷[15],并使产品质构强度过高。
2.2.2 预冻温度对乳酸菌存活率的影响图5 显示以不同温度预冻对产品中乳酸菌存活情况的影响,从图5 可见,预冻过程会造成乳酸菌活菌数严重降低。 而不同预冻温度对产品的乳酸菌存活率的影响有较大的差异。 其中-18 ℃预冻所得产品的乳酸菌存活率为33.29%,乳杆菌和双歧杆菌存活率为14.11%;-25℃预冻所得产品乳酸菌存活率最高,为68.04%,乳杆菌及双歧杆菌存活率为62.59%;-45 ℃预冻所得产品的乳酸菌存活率为58.22%,乳杆菌及双歧杆菌存活率为36.24%。
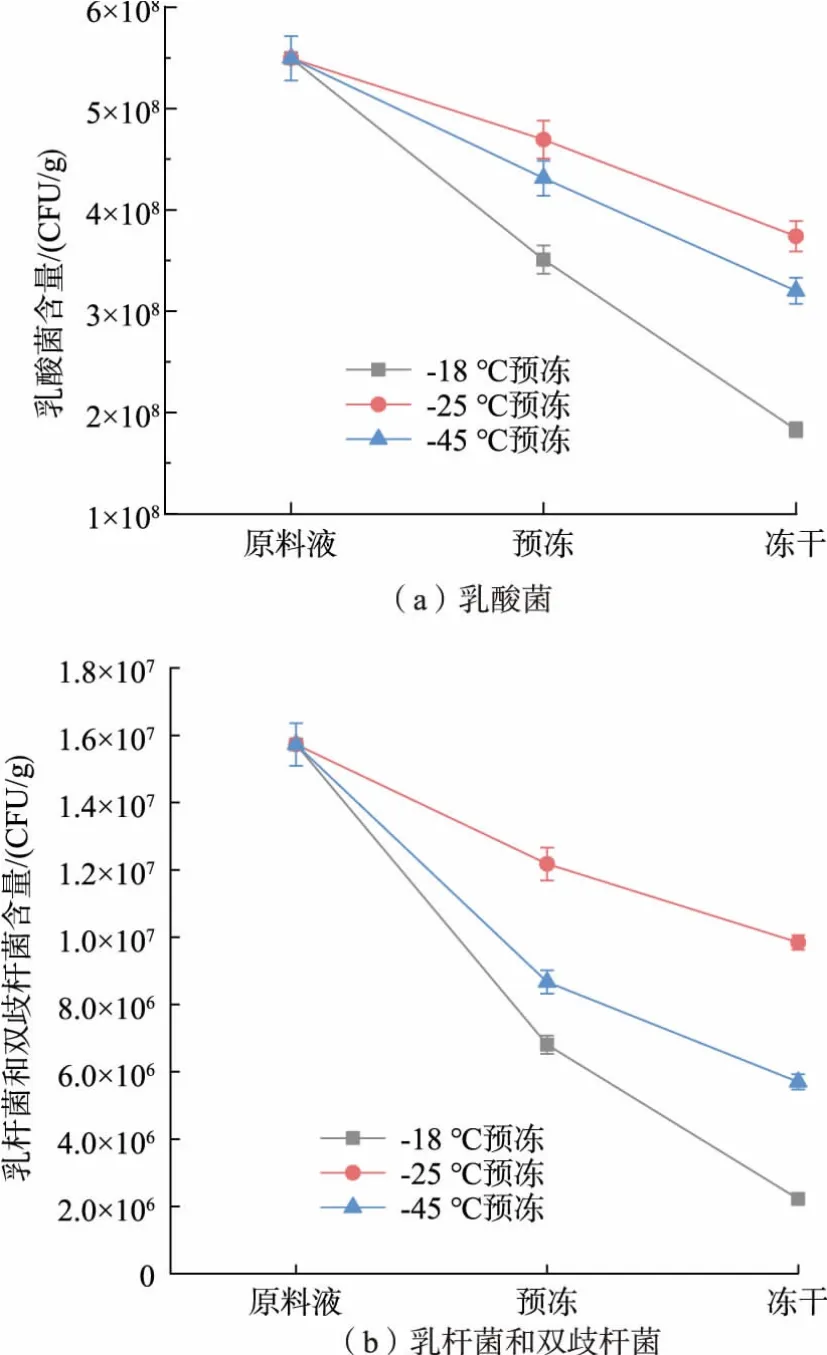
图5 不同预冻温度对乳酸菌存活情况的影响Fig. 5 Effects of different pre-freezing temperatures on the viability of lactic acid bacteria
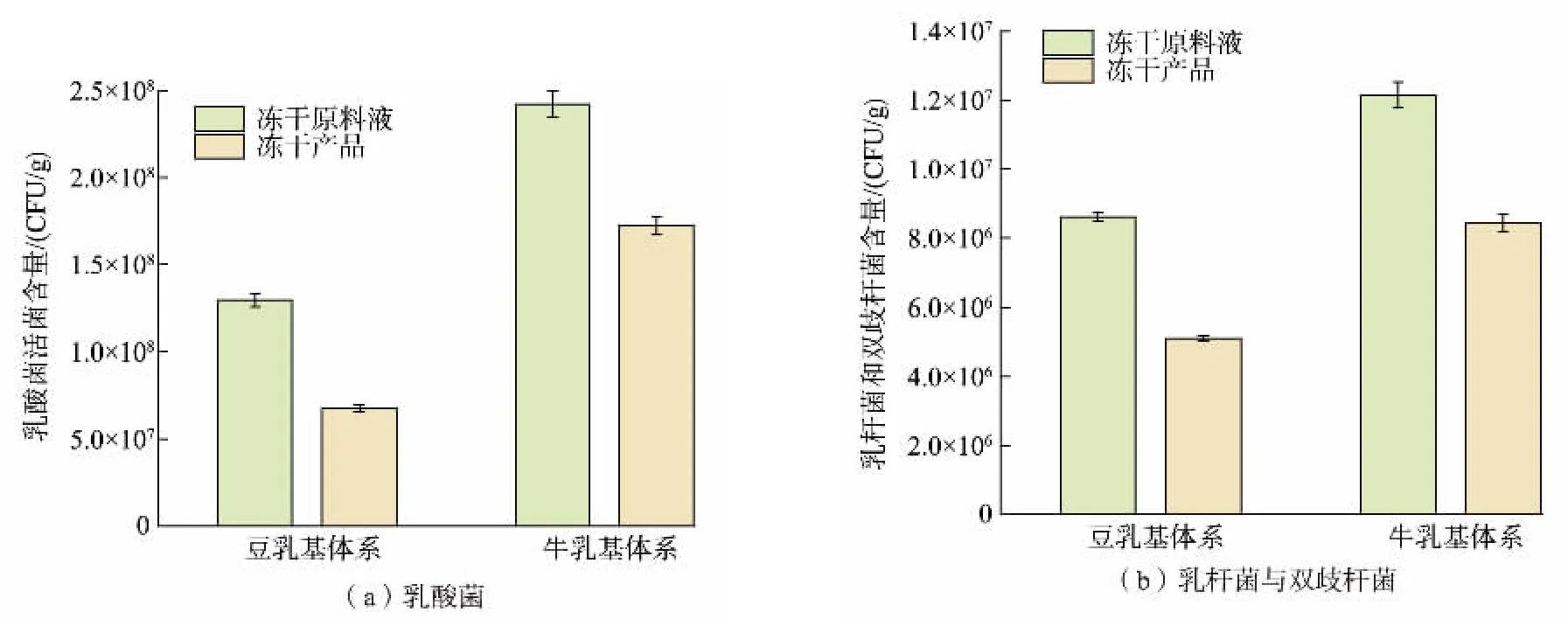
图6 大豆基及牛基乳酸奶块冻干前后乳酸菌活菌计数Fig. 6 Lactic acid bacteria count before and after freeze-drying in soy-based and dairy-based yogurt blocks
可以看出,-18 ℃预冻与-45 ℃预冻所得冻干产品的乳酸菌存活率均显著低于-25 ℃。 在-18 ℃的预冻温度下,料液降温较慢,大量水分渗出细胞外,使细胞内的离子浓度过高造成胞内敏感蛋白质的失活,同时细胞外冰晶较大,对乳酸菌活菌的杀伤效果最强;-25 ℃预冻条件下料液降温速率适中,水分渗透和冰晶生成状况较为平衡,因此对细胞造成的伤害较小[16];-45 ℃可能是由于预冻温度过低,水分来不及渗出胞外而在细胞内生成冰晶导致细胞机械损伤,但由于降温和结晶的速度较快,冰晶生成较小,因此对乳酸菌活菌总数影响较小。 不同体系内的预冻过程,需要考虑冻结过程对细胞液渗透平衡的影响,冻结速度过快或过慢都对体系内的活菌不利。
2.3 混料温度对产品品质的影响
2.3.1 不同混料温度对冻干原料液及理化性质的影响表2 显示不同混料温度所得料液的酸度与pH。混料前,大豆酸奶的初始酸度均为45.31 °T,pH为4.61。 从表2 可看出,真空混料后料液酸度均较混料之前有小幅度下降,但随混料温度上升,料液酸度稍有上升, 混料温度对冻干原料液的酸度及pH 无显著影响,主要是由于在该酸奶体系内,所使用发酵剂中菌种主要为嗜热链球菌,嗜热链球菌在低pH 的条件下活动能力较弱, 且在该体系内的活菌基本处于稳定期,产酸量少,较高的混料温度可能会加强体系内乳酸菌活菌的活动能力,因此料液酸度出现了小幅度上升。 表3 为不同混料温度对产品质构特性的影响,因体系内成分稳定,在同等冻干条件下产品质构无较大变化。
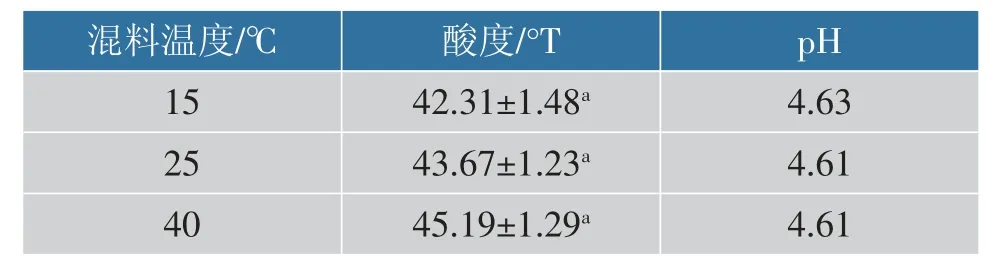
表2 不同混料温度所得料液的滴定酸度及pHTable 2 Titratable acidity and pH of the feed solution obtained at different mixing temperatures

表3 不同混料温度所得冻干产品的质构特性Table 3 Texture characteristics of freeze-dried products obtained at different mixing temperatures
2.3.2 不同混料温度对乳酸菌存活率的影响表4与表5 分别显示不同混料温度所得冻干产品的总乳酸菌的存活情况以及乳杆菌和乳双歧杆菌的存活情况。 从表4 可以看出,相较于15 ℃混料,25 ℃的混料温度能够显著提高乳酸菌总数的冻干存活率,40 ℃混料对冻干产品的乳酸菌总数存活率提升作用不显著, 并且其活菌数与25 ℃混料所得冻干产品无显著差异;从表5 可以看出,该范围内混料温度的调整对乳杆菌及乳双歧杆菌的存活情况无显著影响。 目前已有研究表明,冻干前进行适当的温度处理对活菌的冻干存活能力有影响,据Broadbent 等[17]在对乳酸菌进行的抗冻性研究中发现,在冻干前对活菌体系进行热处理或冷处理能够诱导细胞的胁迫应激反应,提高冻干体系内活菌的存活率;Ziadi 等[18]也通过热胁迫预处理的方式提高了乳酸乳球菌的冻干存活率。 冻干前进行特定温度的处理能够诱导细胞产生相应的应激蛋白质[19],覆盖在细胞膜表面从而形成一层假定的水化膜,在脱水过程中保证膜结构的稳定[20],有效增强细胞的抗冻能力和抗冻干能力,目前制备活菌粉的工艺中有较为理想的效果。 但由于在酸奶体系内本身含有质量分数3%的牛乳或大豆蛋白, 以及小分子糖等具有较好冻干保护能力的成分,并且在混料前酸奶已经经过长时间的冷藏后熟处理,因此在混料过程中调整混料温度对产品的复杂体系内乳酸菌存活率的提升作用比较有限,在实际生产中无需特别控制。
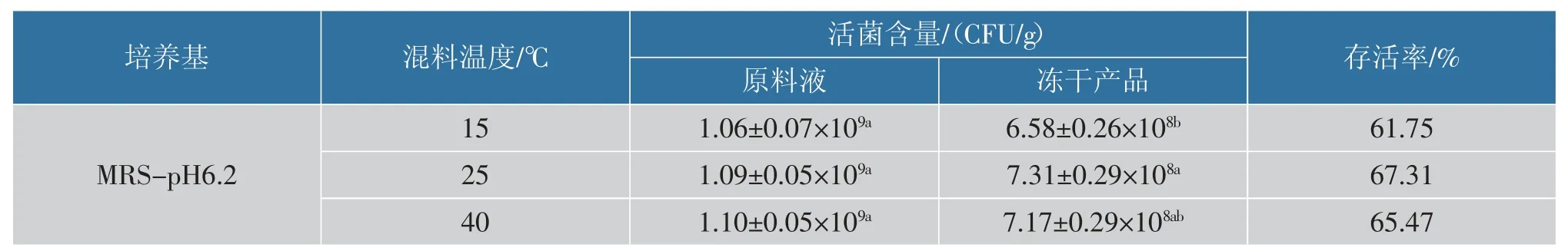
表4 不同混料温度所得冻干产品的乳酸菌存活情况Table 4 Viability of lactic acid bacteria in freeze-dried products-at different obtained mixing temperatures
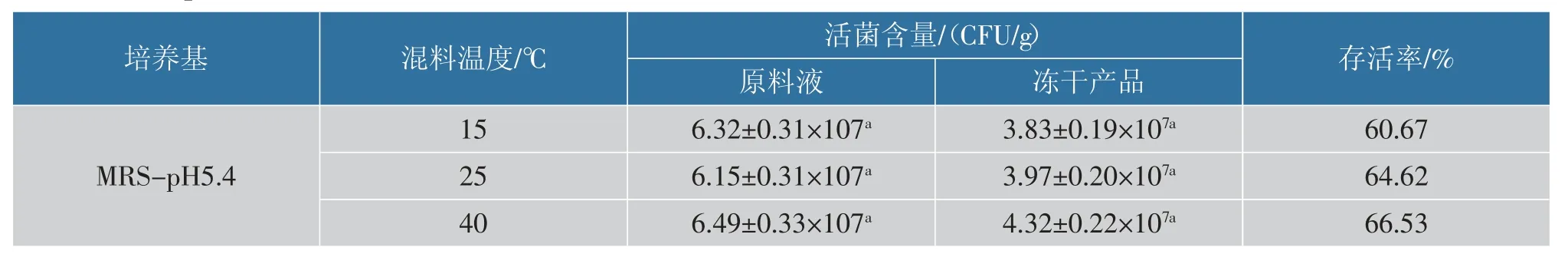
表5 不同混料温度所得冻干产品的乳杆菌& 乳双歧杆菌存活情况Table 5 Viability of Lactobacillus and Lactobacillus bifidobacterium in freeze-dried products obtained at different mixing temperatures
2.4 乳基变化对冻干酸奶块性质的影响
在保证主要成分(蛋白质、脂肪、碳水化合物等)含量不变的情况下,将冻干酸奶原料液中的豆乳改变为牛乳,从而考察乳基对冻干酸奶块性质的影响。
2.4.1 质构特性经测定,大豆基冻干酸奶块断裂力为1 255.87 g,断裂时间为2.281 3 s,牛乳基冻干酸奶块的断裂力为937.75 g,断裂时间为1.7207 s,可以看出,相较于牛乳基冻干酸奶块,大豆基冻干酸奶块的硬度显著更高,断裂时间明显更长,可能在产品上体现出更强的硬度和韧性,酥脆度可能会成为相关产品的弱项。
2.4.2 乳酸菌存活情况图7 显示大豆基及牛乳基冻干酸奶块的乳酸菌存活情况,牛乳基体系的产品中乳酸菌存活率约为71.12%,乳杆菌及双歧杆菌存活率为69.31%;而大豆基体系中乳酸菌存活率仅为52.33%,乳杆菌及双歧杆菌存活率为59.25%。
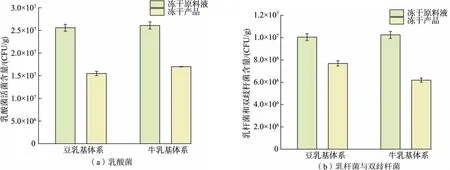
图7 大豆基及牛乳基酸奶模拟体系中冻干前后乳酸菌活菌含量Fig. 7 Lactic acid bacteria count before and after freeze-drying in simulated systems of soy-based and dairy-based yogurt
由于两体系发酵基的发酵能力和缓冲能力有一定差异,并且所使用的商业发酵剂更适合于牛乳环境的发酵,因此同等的发酵条件下,牛乳体系的pH 稍低,酸度稍高,同时具有更高的乳酸菌活菌基数, 经测定, 大豆基酸奶块冻干原料液的pH 为4.62,酸度为39.78 °T;而牛乳基冻干酸奶块冻干原料液的pH 为4.50,酸度为42.59 °T。 可能由于发酵后更强的酸性环境更有利于诱导菌群之间的酸胁迫保护效应[21],再加上更高的活菌基数,使得牛乳体产品具有显著高于大豆酸奶块冻干原料液体系的菌体存活率。
由于牛乳和豆浆的发酵能力差异,牛乳基冻干料液和大豆基酸奶块冻干料液中乳酸菌活菌的数目和生理状态存在差异,为考察在活菌数量和生理状态相同的条件下两体系对乳酸菌的冻干保护能力,取调配后未接种的料液,用质量分数10%乳酸溶液调节pH 至4.60, 杀菌后接入等量发酵剂制备成活菌含量相等的模拟体系, 分散均匀后直接冻干,并在冻干前后测定乳酸菌总数和乳杆菌及双歧杆菌总数,结果如图8 所示。
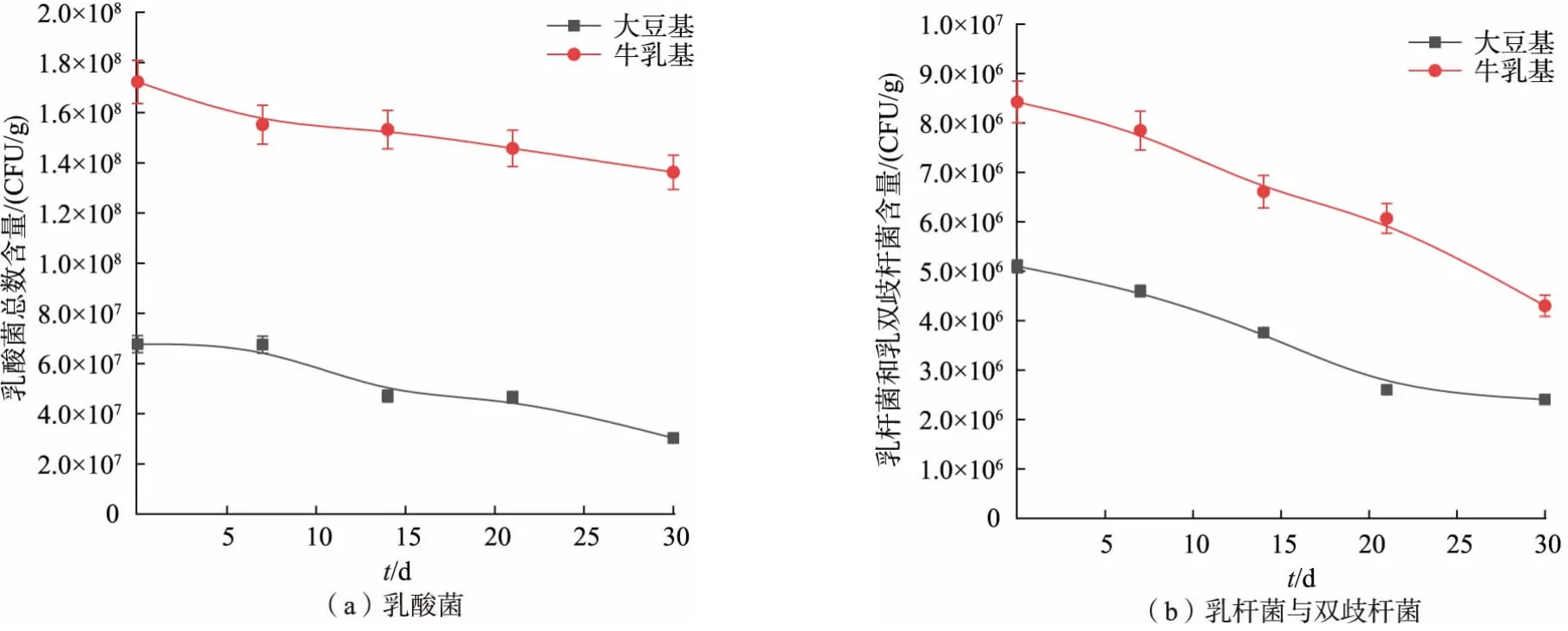
图8 充氮包装冻干产品中乳酸菌活菌含量随贮藏时间的变化情况Fig. 8 Changes of live lactic acid bacteria with storage time in nitrogen-packed freeze-dried products
模拟体系中出现了与以上实验结果不同的实验结果, 在大豆基体系内, 总乳酸菌的存活率为60.58%, 乳杆菌及双歧杆菌的存活率约为76.53%;而牛乳体系内总乳酸菌的存活率为65.17%,乳杆菌及双歧杆菌存活率为60.39%。从以上实验结果可以看出,在活菌基数相同,菌体状态一致,环境pH 相同的条件下,大豆酸奶体系的冻干保护能力与牛乳体系的冻干保护能力较接近,甚至乳杆菌及双歧杆菌的存活率显著高于牛乳体系的存活率。 付博在研究不同保护剂对长双歧杆菌的冻干保护作用的实验中, 发现质量分数10%的脱脂乳粉与质量分数8%的大豆蛋白的添加均能够起到较好的冻干保护作用, 分别能够使长双歧杆菌的冻干存活率达到80%和75%左右[22]。
2.4.3 贮藏期间乳酸菌活菌数的变化市面上的冻干酸奶块一般采用铝箔袋封装, 并置于室温贮藏。因此模仿市面通常的包装和贮藏方式,取上述2种原料制备的冻干酸奶块,分别采用充氮或不充氮的铝箔自封袋进行封装后置于室温贮藏,每周取样测定样品的乳酸菌活菌数和乳杆菌和双歧杆菌活菌数,得出活菌数变化曲线如图8 所示。 表6 显示室温贮藏30 d 后充氮和空气包装条件下大豆基及牛乳基酸奶块的乳酸菌、乳杆菌及双歧杆菌的存活情况。 可以看出,充氮包装的条件下,贮藏期间牛乳基冻干酸奶块产品中的总乳酸菌下降幅度最小,30 d时存活率为79.10%, 几乎为大豆基产品的2 倍,说明嗜热链球菌在牛乳体系内的生理状态和存活能力更好。 而乳杆菌和双歧杆菌的计数结果上,两样品在30 d 时的存活率较为接近,且绝对数量处于同一数量级,益生菌含量均大于1.0×106CFU/g。
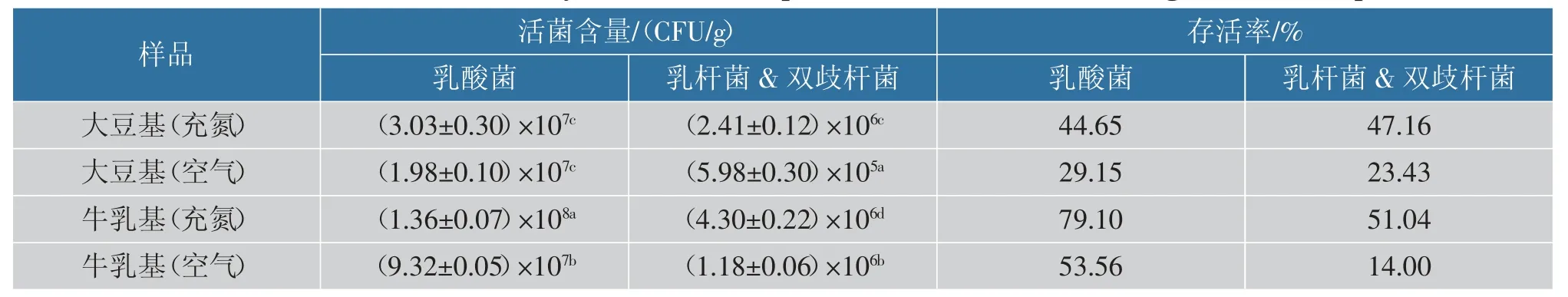
表6 冻干产品室温贮藏1 个月后的乳酸菌存活情况Table 6 Lactic acid bacteria viability in freeze-dried products after one month storage at room temperature
从表6 可以看出, 在不充氮的包装条件下,相较于牛乳基冻干酸奶块,大豆基冻干酸奶块的总乳酸菌的存活率低于牛乳基,而乳杆菌及双歧杆菌的存活率相对高于牛乳基;从菌种的角度分析,在两体系中,嗜热链球菌的存活率均明显高于乳杆菌和双歧杆菌的存活率,可能是由于乳杆菌和双歧杆菌为专性厌氧菌,而嗜热链球菌为兼性厌氧菌,对氧气的耐受能力更好,因此在采用空气封装的贮藏条件下,嗜热链球菌的存活情况更好。 为保证冻干产品在储藏期间较高的益生菌活菌量,建议对该产品采用充氮包装。
3 结 语
以大豆和脱脂乳粉为原料分别制备大豆基和牛乳基冻干酸奶块,探究了冻干原料液的理化性质差异,并考察了预冻温度和混料温度对大豆基冻干酸奶块的品质的影响,以及大豆基与牛乳基冻干酸奶块的品质差异。结果表明,-25 ℃预冻条件下产品具有相对合适的质构和乳酸菌存活率,25 ℃和40℃的混料温度能够小幅提高产品的乳酸菌存活率。相较于以复原牛乳为原料的冻干酸奶块,以大豆为原料的冻干酸奶块的硬度和韧性更强,乳酸菌存活率较低,但大豆浆原料所含大豆蛋白自身具有较好的冻干保护能力。在贮藏30 d 后,充氮包装条件下,乳杆菌和双歧杆菌在大豆基冻干酸奶块产品中的存活率同牛乳基产品中的存活率较为接近,空气包装条件下大豆基冻干酸奶块的乳杆菌和双歧杆菌的存活率则高于牛乳基产品。

