马铃薯淀粉汁水混菌发酵条件优化及应用
胡 羚, 张惠玲, 周慧宁, 李海峰*
(1. 宁夏大学食品与葡萄酒学院,宁夏银川 750021;2. 宁夏食品微生物应用技术与安全控制重点实验室,宁夏银川 750021)
马铃薯(Solanum tuberosumL.)产业近年来在国内迅速发展,在青海、宁夏、甘肃等西北地区形成了产业化基地[1]。 仅宁夏南部山区的马铃薯加工企业就有近3 000 家[2],已成为当地经济增长的支柱产业之一。 而在马铃薯加工中,会产生大量的汁水,其中约90%来自土豆淀粉、 土豆粉生产等加工工业[3],平均每处理6.5 t 马铃薯,就会产出1 t 淀粉、5 t 薯渣和20 t 汁水[4]。大量的马铃薯淀粉汁水的排放处理已成为马铃薯加工中亟待解决的问题。
研究表明,马铃薯淀粉加工汁水中主要含有碳水化合物、蛋白质、脂类、有机酸、多酚、矿物质、纤维和生物碱[5],同时汁水具有“三高”的特点,即高泡沫、高化学需氧量、高生化需氧量[6]。 如果直接排放,汁水中的有机物质非常有利于微生物或致病菌的大量生长繁殖,可能造成环境中的生物污染问题[7],且废水中的蛋白质会在自然发酵后释放出硫化氢、氨气、腐胺、尸胺等恶臭气味污染环境[8]。 因此对马铃薯淀粉加工汁水进行合理化处理至关重要。
目前马铃薯淀粉加工汁水的处理方式有物理法、化学法、生物法[9]。 生物法因相对物理法和化学法具有操作简便,成本低廉等优势,受到广泛关注。但马铃薯淀粉加工主要集中在当年的9 月至次年3 月[10],由于秋冬季环境温度较低(3~20 ℃),菌株生长缓慢,从而延长了发酵周期,明显增加了发酵过程中的能耗。 相比于单菌发酵,混菌发酵过程菌种之间存在相互协同作用,能够扩大对原料的适应性和防杂菌的能力,因此作者选择混合菌发酵马铃薯淀粉汁水。
选用能在低温(15 ℃)发酵降解马铃薯淀粉加工汁水的好氧型苔藓假单胞菌和厌氧型黏质沙雷氏菌混合使用,通过单因素实验、响应面实验提高马铃薯淀粉加工汁水中蛋白质的降解率,缩短发酵周期,降低臭味物质的产生,提高植物生长所需的生长素、氨基酸等,并将发酵后的汁水进行应用,以促进黄瓜种子发芽。 在马铃薯淀粉废水绿色化处理的基础上,将其综合利用开发,实现了环境效益与社会效益双赢。 尤其对于自然资源匮乏、干旱落后、 水资源极度短缺的宁夏南部山区而言,本研究为马铃薯产品加工后汁水的处理与利用提供了参考。
1 材料与方法
1.1 材料与试剂
黏质沙雷氏菌(0 号菌):由作者所在实验室筛选并保藏于广东省微生物菌种保藏中心(GDMCC);苔藓假单胞菌(4 号菌):由作者所在实验室筛选并保藏。
甲醇、乙腈(色谱纯):Merck 公司产品;腐胺、酪胺、 组胺、 精胺、 亚精胺、 尸胺、 色胺标准品:Olchemim/isoReag 公司产品;BCA 试剂盒:赛默飞世尔科技有限公司产品;NB 培养基、 酪蛋白培养基:北京索莱宝科技有限公司产品; 磷酸盐试剂盒:上海齐源生物科技有限公司产品。
1.2 仪器与设备
气相色谱-质谱(GC-MS)联用仪和1100 Series高效液相色谱仪: 美国安捷伦科技有限公司产品;NBS-I 型氮吹仪:合肥艾本森科学仪器有限公司产品;FR980 恒温培养箱: 上海复日科技有限公司产品;全自动氨基酸分析仪:苏州华美辰公司产品;酶标仪:山东博科生物产业有限公司产品;冷冻高速离心机:美国Applied Biosystems 公司产品。
1.3 实验方法
1.3.1 菌株活化将保藏在甘油管中的菌株按接种体积分数2% 分别接种在NB 液体培养基中活化,28 ℃恒温培养24 h,转接到酪蛋白固体培养基上培养48 h。
1.3.2 混合菌株拮抗实验采用划线法[11],将活化的菌株在酪蛋白平板上两两划线,一个菌株先平行划4 条直线,另一个菌株在其垂直方向划4 条与其相交的线,观察16 个相交点上是否有抑菌圈,若无则表示2 个菌株间无拮抗作用,反之,则有拮抗作用。
1.3.3 单菌发酵实验参考前期单菌发酵最优条件进行单菌发酵[8],4 号菌株在15 ℃发酵48 h、pH为5.35、接种体积分数为2.37% 的条件下发酵马铃薯汁水, 测其蛋白质降解率;0 号菌株在15 ℃发酵48 h,pH 为6.18,接种体积分数为4.99% 的条件下发酵马铃薯汁水,测其蛋白质降解率。
1.3.4 混合菌单因素实验
1) 接种体积分数对蛋白质降解率的影响 发酵温度为15 ℃, 发酵时间为48 h,1∶1 的质量比混合,接种体积分数分别为1%、2%、3%、4%、5%,测定发酵后蛋白质质量浓度的变化。
2) 菌种配比对蛋白质降解率的影响 发酵温度为15 ℃,发酵时间为48 h,接种体积分数为2%,0 号菌与4 号菌质量比分别为1∶3、1∶2、1∶1、2∶1、3∶1,测定发酵后蛋白质质量浓度的变化。
1.3.5 混合菌响应面优化实验根据单因素试验,选择菌种复配比、接种体积分数这2 个因素中自变量的最佳参数, 进行两因素三水平的正交试验,并利用 Design Expert 8.0 软件, 采用 Central Composite Design 进行响应面优化。 实验设计因素见表1。
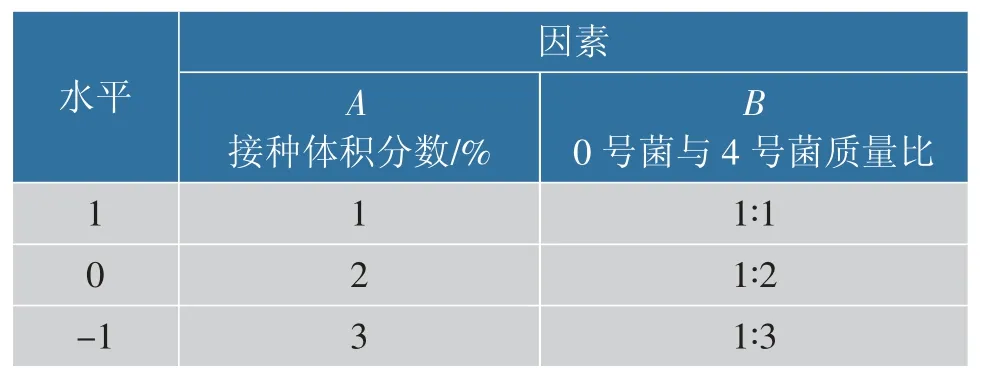
表1 实验设计因素Table 1 Experimental design factors
1.3.6 验证实验将响应面优化后得到的最适条件进行验证实验,在15 ℃发酵48 h,测定空白(未发酵)、0 号菌、4 号菌、最优混合菌发酵液中的蛋白质、氨氮、磷酸盐、胺类物质、挥发性物质、氨基酸及植物生长激素。
1.3.7 黄瓜种子发芽实验每个培养皿中加适当稀释的自然发酵汁水、混菌发酵汁水各10 mL,将预处理好的30 粒黄瓜种子均匀摆入培养皿中, 以去离子水作对照, 每个处理6 次重复,28 ℃恒温培养2 d,发芽结束后统计发芽势、发芽率、胚轴长度。
1.4 测定方法
1.4.1 蛋白质质量浓度测定取发酵后的汁水,用BCA 蛋白质试剂盒在酶标仪中测定样品中的蛋白质质量浓度,蛋白质标准曲线见图1。Fig. 1 Protein standard curve
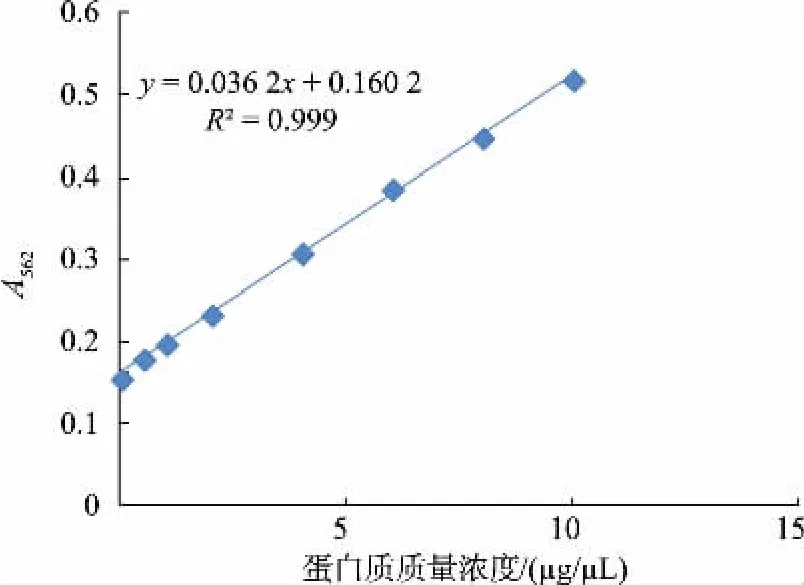
图1 蛋白质标准曲线
1.4.2 氨氮质量浓度测定参考GB/T 6432—2018《饲料中粗蛋白的测定凯氏定氮法》[12]进行测定。
1.4.3 磷酸盐质量浓度测定磷酸盐质量浓度的变化采用孔雀绿显色剂和钼酸盐,钼酸盐可与无机磷酸盐特异结合形成一种稳定的有色化合物[13]。
1.4.4 氨基酸质量分数测定采用全自动氨基酸分析仪测定汁水中各必需氨基酸质量分数。
1.4.5 胺类物质测定采用高效液相色谱法测定,参考GB 5009.208—2016《食品安全国家标准食品中生物胺的测定》进行测定[14]。
1.4.6 挥发性气体测定取5 mL 样品置于顶空瓶中,用带有50/30 μm DVB/CAR on PDMS 萃取纤维头的自动进样器插入瓶内,于90 ℃平衡30 min,再压缩手柄伸出萃取头萃取30 min,取出,立即插入气相色谱仪进样口(温度250 ℃)解析3 min[15]。 GC条件为:HP-5 MS 石英毛细管柱(0.25 mm×30 mm,0.25 μm),程序升温(初始温度50 ℃,保持1 min;以4 ℃/min 升温至250 ℃,保持5 min),进样口温度250 ℃,载气高纯度氦气,载气流量1.0 mL/min,不分流进样。 MS 条件为:电子轰击离子源(EI),离子源温度230 ℃,四级杆温度180 ℃,电子能量70 eV,m/z检测范围35~550[16]。
1.4.7 植物生长激素质量浓度测定
1) 样本前处理 移取50 μL 样本,用1 mL 甲醇-水-甲酸(体积比15∶4∶1)进行提取浓缩[17],后用100 μL 体积分数80% 甲醇溶液复溶, 过0.22 μm滤膜,置于进样瓶中,等待LC-MS/MS 分析[18]。
2) 液相条件 色谱柱:Waters ACQUITY UPLC HSS T3 C18 柱(1.8 μm,100 mm×2.1 mm);流动相:A 相超纯水,B 相乙腈,梯度洗脱程序:流动相体积比A/B在0~8.0 min 为95∶5;8.0 min 时变至5∶95,保持1 min;9.1 min 时变为95∶5,保持至12.0 min。流量0.35 mL/min,柱温40 ℃,进样量2 μL[19-20]。质谱条件主要包括:电喷雾离子源(Electrospray Ionization,ESI)温度550 ℃,正离子模式下质谱电压5 500 V,负离子模式下质谱电压-450 0 V, 气帘气(Curtain Gas)241 kPa。在Q-Trap 6500+中,根据优化的去簇电压(DP)和碰撞能(CE)对每个离子进行扫描检测[21-22],再利用软件Analyst1.6.1 处理所得数据。
3) 标准曲线 配制0.05、0.5、1、5、10、50、100 ng/mL 的标准品溶液,测定各个质量浓度的峰面积,以各质量浓度为横坐标,峰面积为纵坐标,绘制不同物质的标准曲线[23],标准曲线线性方程及相关系数见表2。
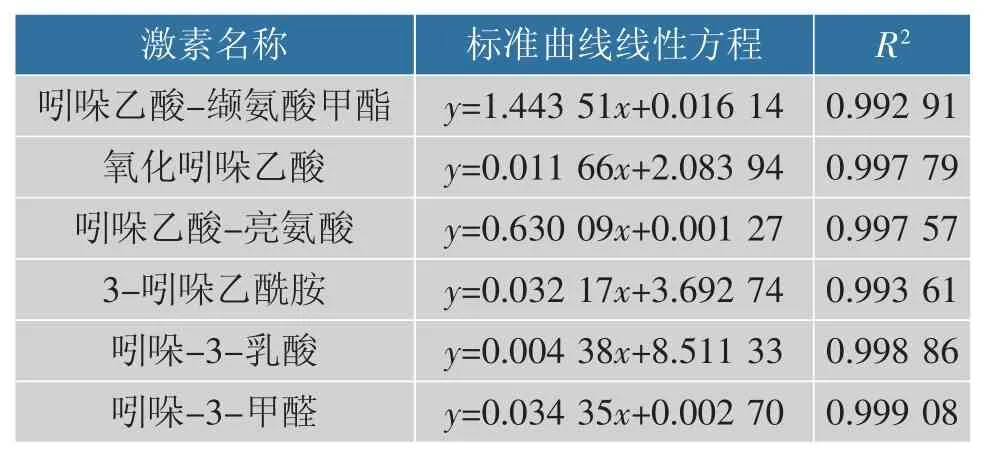
表2 标准曲线线性方程及相关系数Table 2 Standard Curves
4) 各激素质量浓度的计算 将检测到的所有样本的积分峰面积比值代入标准曲线线性方程进行计算。
式中:Cs为样本中激素质量浓度,ng/mL;c为样本中积分峰面积比值代入标准曲线得到的质量浓度,ng/mL;V1为复溶时所用溶液的体积,μL;V2为移取的样本体积,mL。
2 结果与分析
2.1 拮抗实验
如图2 所示, 酪蛋白平板上2 株菌均生长良好,两两交叉处无抑菌圈,说明2 株菌之间无拮抗作用,可以用于混合发酵。
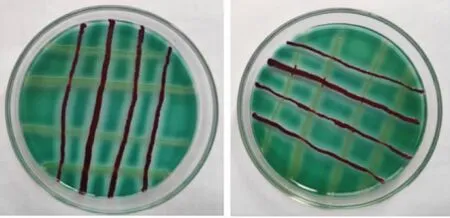
图2 2 株菌的拮抗实验Fig. 2 Antagonistic effect test of 2 strains of bacteria
2.2 单因素实验
2.2.1 不同接种体积分数对蛋白质降解率的影响马铃薯淀粉汁水中的有机物的降解率往往会随着微生物浓度的提高而增加。 由图3 可知,随着接种质量分数的增加,蛋白质降解率先升高后又逐渐降低, 接种体积分数在2% 时蛋白质降解率最高,达26.91%。 当接种体积分数过小时,菌种浓度过低,在低温环境过久菌种活性可能会降低, 生长缓慢,导致蛋白质的利用率低;接种体积分数过大时,可能导致菌种因营养物质不足相互竞争, 导致菌体死亡,降解率下降;而当接种体积分数为5%时,蛋白质降解率有一定回升,可能是汁水中有微生物在竞争中处于优势地位,导致某些菌种死亡。

图3 不同接种体积分数对蛋白质降解率的影响Fig. 3 Effect of different inoculation amount on protein degradation rate
2.2.2 不同菌种配比对蛋白质降解率的影响混菌发酵时,菌种会有协同作用,也会抑制其他杂菌的生长。 当0 号菌与4 号菌质量比为1∶2 时,蛋白质降解率最高,为31.36%;当0 号菌∶4 号菌比例增大时,蛋白质降解率呈下降趋势,见图4。 这可能是由于混菌中的0 号菌为黏质沙雷氏菌,会产生一种具有生物活性的天然色素——灵菌红素[24]。 研究发现,灵菌红素具有广谱的杀菌能力,可高效杀死大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌和新生隐球菌等多种细菌和真菌[25]。 可能在发酵过程中灵菌红素抑制了其他微生物的生长,导致蛋白质的降解率下降。
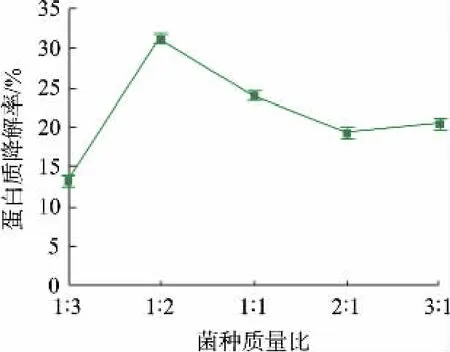
图4 不同菌种质量比对蛋白质降解率的影响Fig. 4 Effect of different mass ratio of strains on protein degradation rate
2.3 响应面优化实验
通过Design Expert 8.0 软件对表3 实验结果进行多元回归拟合,根据实际因素建立二次多项式回归方程:Y=56.32-0.069A+2.80B-1.18AB-2.92A2-8.30B2
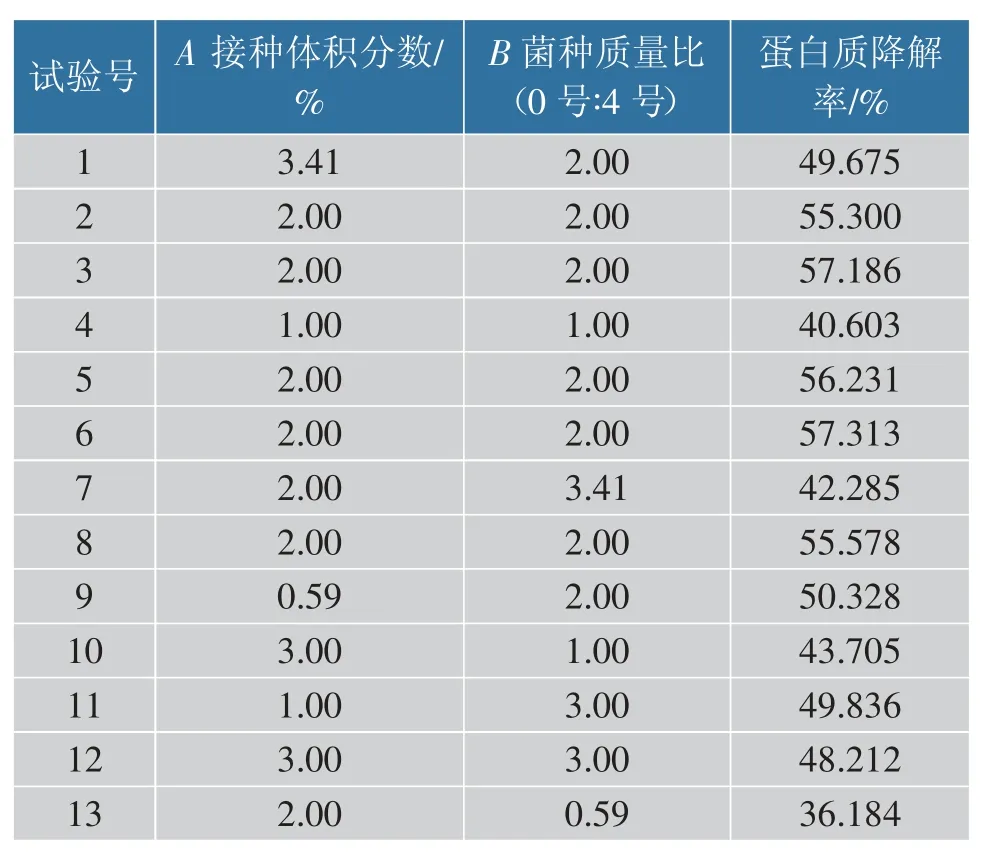
表3 响应面实验设计及结果Table 3 Design and results of response surface experimental
由表4 可知,模型方差分析P<0.05 显著,失拟项P=0.213 9,不显著,决定系数R2=0.984 1,R2adj=0.972 8, 表明该模型能够解释97.28%的关键因子对蛋白质降解的影响, 可用于预测蛋白质降解条件。 根据方程标准化回归系数中一次项系数的绝对值(A=0.069,B=2.8)可以得出,所选2 个变量对蛋白质降解的影响大小为:B>A, 即菌种质量比>接种体积分数。
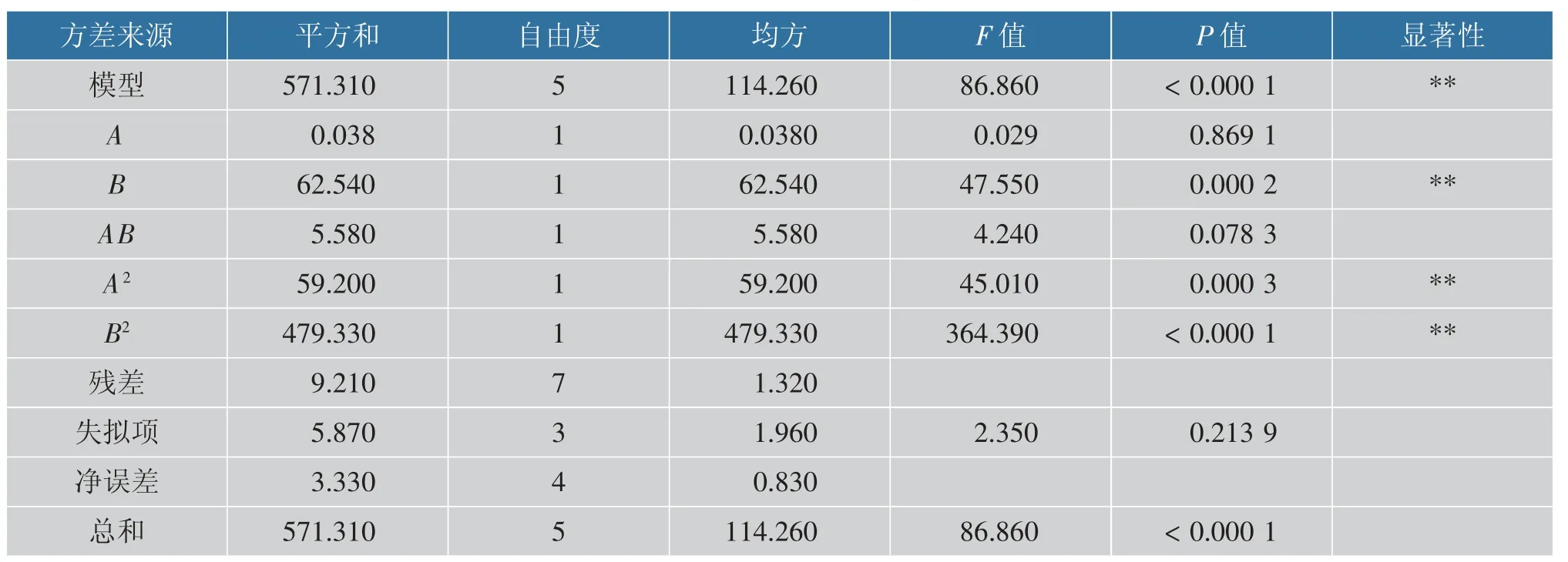
表4 回归模型方差分析表Table 4 Analysis of variance of regression model
菌种质量比和接种体积分数呈向上凸包裹状且等高线呈椭圆形, 说明其具有一定的交互作用,配比对蛋白质降解影响最大,但并未显现出与其他因素的显著交互作用, 见图5。 通过Design Expert 8.0 软件计算得出蛋白质降解的最佳发酵条件为:0号菌与4 号菌质量比为2.0∶1.7, 接种体积分数为1.98%;预测此时蛋白质降解率为56.56%。
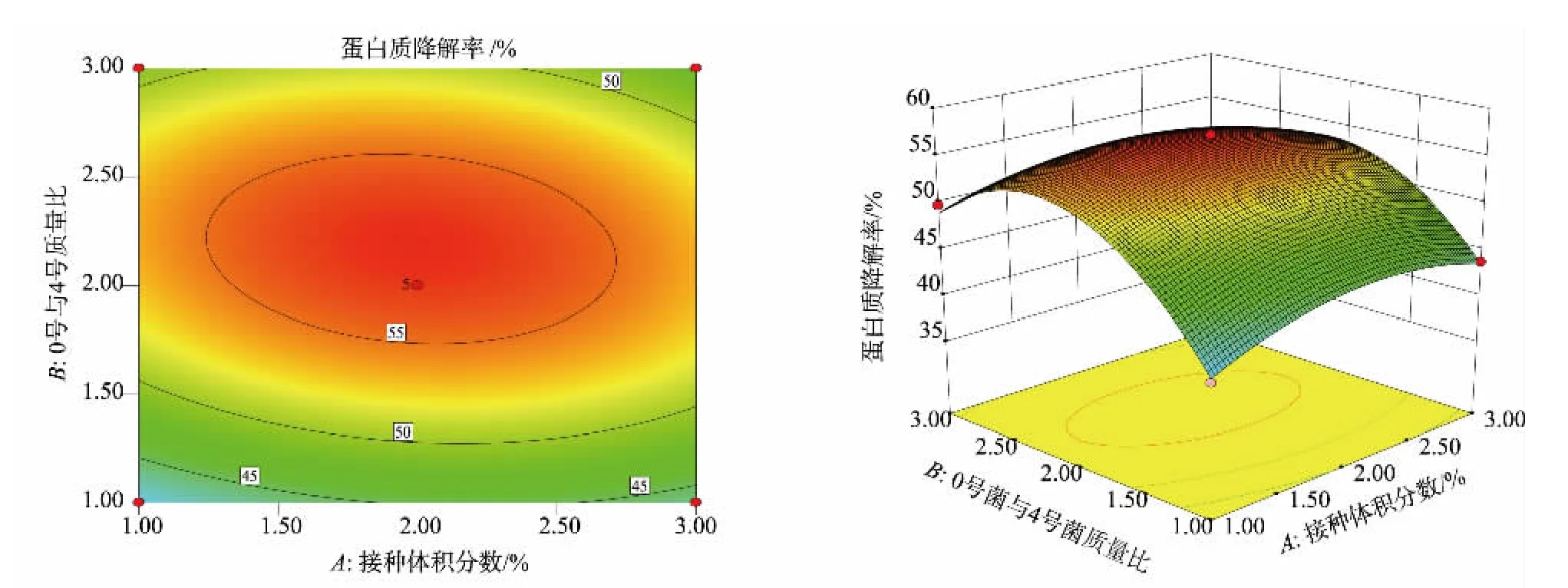
图5 两因素交互作用对蛋白质降解率影响的响应面图Fig. 5 Response surface diagram of the effect of the interaction of two factors on protein degradation rate
2.4 验证实验结果
2.4.1 不同发酵组对蛋白质、磷酸盐、氨氮质量浓度的影响马铃薯淀粉汁水具有高泡沫性,会减少汁水中的溶氧量[1],而利用好氧菌与厌氧菌相互作用,可减少单菌发酵时的动力消耗,加快蛋白质的降解速率。 利用最适发酵条件发酵马铃薯淀粉加工汁水,发现混菌的蛋白质降解率为65.32%,显著高于单菌种发酵(P<0.05),说明混菌发酵性能显著高于单菌发酵,见图6。 在发酵过程中,磷酸盐的质量浓度无论单菌发酵或者混菌发酵都有一定程度提高,混菌发酵时磷酸盐质量浓度达2.86 mg/dL,较未发酵组显著(P<0.05)升高,且显著(P<0.05)高于单菌发酵,见图7。 经过微生物发酵,汁水中的磷酸盐质量浓度升高, 可能是因为在微生物的作用下,汁水中部分有机磷被分解为磷酸盐,使得汁水中磷酸盐质量浓度增加。 氨氮质量浓度过高会引起水体富营养化,而少量的氨氮有利于植物生长,未发酵的马铃薯淀粉汁水中氨氮质量浓度为3.33 g/L, 显著高于其他组(P<0.05)。汁水经微生物发酵后,氨氮含量降低, 混菌发酵后汁水中氨氮质量浓度为1.63 g/L,较未发酵组降低51.05%,见图8。 菌种在发酵过程中都能降低马铃薯淀粉加工汁水中的氨氮含量, 这可能是由于混菌由好氧菌与厌氧菌相组合,而这2 种菌种拥有硝化和反硝化微生物特性,能够同时进行硝化和反硝化,从而有效降低了马铃薯淀粉汁水中氨氮的质量浓度。
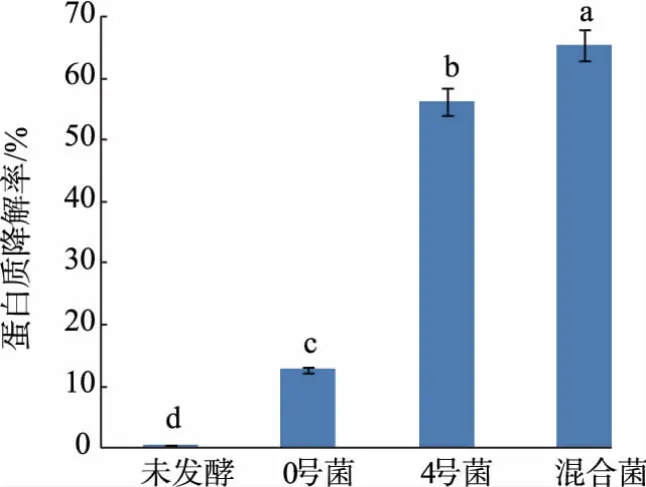
图6 蛋白质降解率验证实验Fig. 6 Verification experiment of protein degradation rate
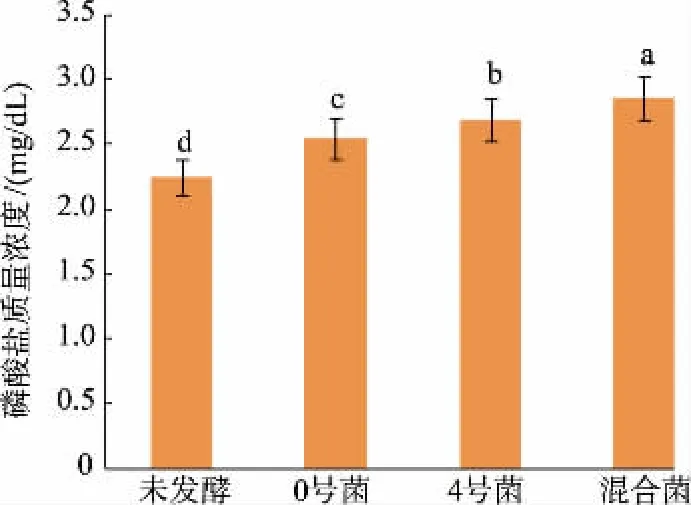
图7 磷酸盐质量浓度验证实验Fig. 7 Verification experiment of phosphate content
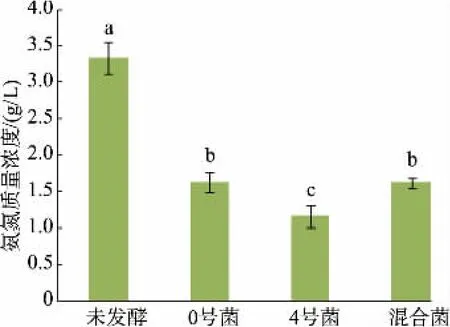
图8 氨氮质量浓度验证实验Fig. 8 Verification test of ammonia nitrogen content
2.4.2 不同发酵组对臭味物质的影响马铃薯淀粉废水中含有大量的有机物质,是微生物生长的天然培养基, 当马铃薯淀粉加工汁水自然发酵时,会有大量的微生物聚集,其中蛋白质是微生物的主要有机氮来源,一些异养微生物可以产生胞外蛋白酶将其水解成可利用的氨基酸和寡肽,为自身提供营养,也可能为其他不能产生胞外蛋白酶的微生物提供营养[26]。 而蛋白质在水解过程中会产生具有刺激性臭味的硫化氢、氨气,且有些氨基酸经脱羧酶的作用会产生尸胺、腐胺等恶臭味物质。由表5 可知,未发酵的马铃薯淀粉汁水中尸胺质量浓度为4.72 mg/L,总生物胺质量浓度为9.66 mg/L,均显著高于其他处理组(P<0.05),而通过混菌发酵马铃薯淀粉汁水中总生物胺仅含0.93 mg/L,且没有产生尸胺等恶臭味物质。 单菌及混菌发酵的汁水中均未检测到有吲哚、3-甲基吲哚、 硫化氢等刺激性恶臭味挥发物质,见表6。表明混菌在发酵马铃薯淀粉汁水降解蛋白质的同时没有产生多余的恶臭味物质,所以该混菌可用于发酵降解马铃薯淀粉汁水,减少臭味物质的产生。
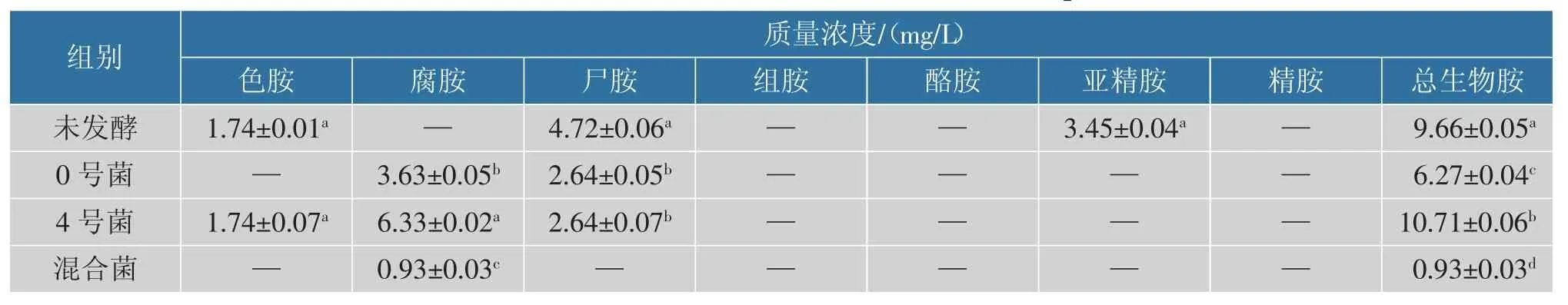
表5 验证实验中主要生物胺质量浓度Table 5 Main substance content in the verification experiment
2.4.3 不同发酵组对氨基酸、植物激素的影响有研究表明,胞外蛋白酶可能是通过一个或多个特定氨基酸或寡肽、或氨基酸和寡肽同时作为信号分子与膜传感器相互作用,将信号传递到细胞中刺激产生的[24]。 表7 中混菌发酵后马铃薯汁水中氨基酸质量分数比单菌株发酵高,但没有未发酵的高。 可能是由于菌株在发酵过程中将部分氨基酸转化为其他物质,也可能菌种将氨基酸作为一种信号分子传递到细胞中产生胞外蛋白酶,从而减少了氨基酸的量。由表8 可知,经混合菌发酵后汁水中吲哚乙酸-缬氨酸甲酯、氧化吲哚乙酸、吲哚乙酸-亮氨酸、3-吲哚乙酰胺等植物激素的质量浓度增高,因此该发酵汁水可能对植物生长有益。
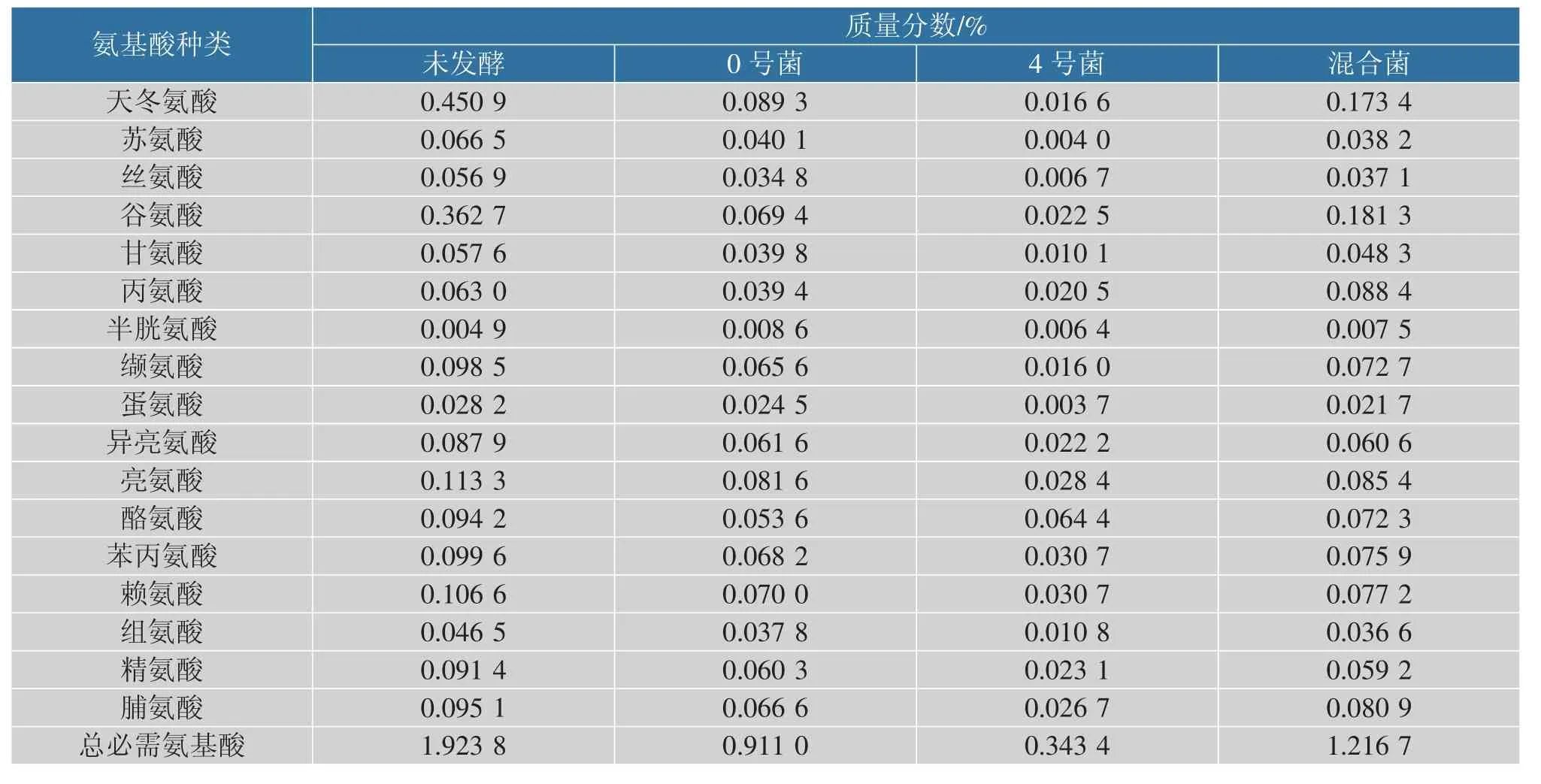
表7 混菌发酵后马铃薯淀粉汁水中各氨基酸质量分数Table 7 Content of amino acids in potato starch juice after mixed bacteria fermentation
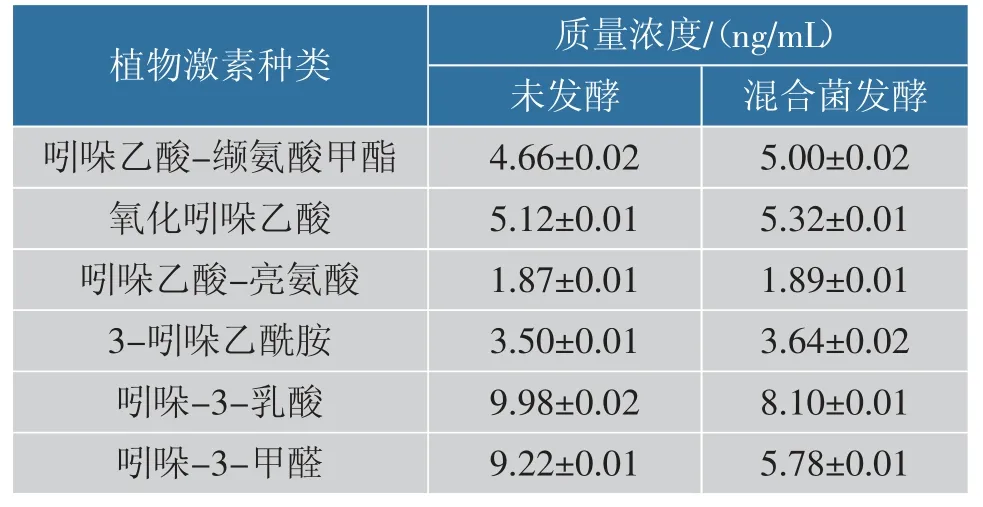
表8 混菌发酵后汁水中植物激素的质量浓度Table 8 Content of plant hormones in the juice after mixed bacteria fermentation
2. 5 黄瓜种子发芽结果
经混菌发酵后的马铃薯淀粉加工汁水稀释后对黄瓜种子的发芽势、发芽率、胚轴长度的作用效果均最好,可有效促进黄瓜种子萌发,见表9。
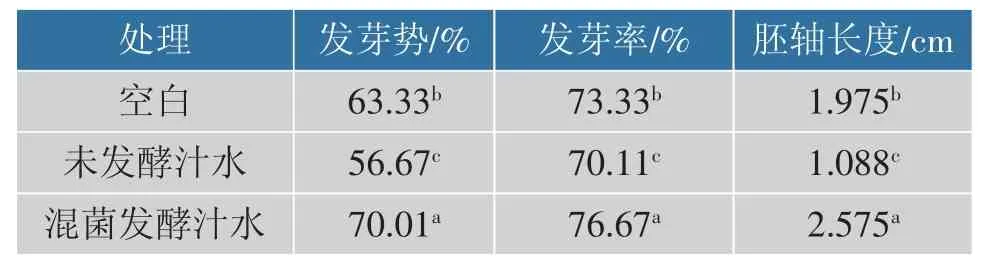
表9 发芽结果Table 9 Germination results
可能是由于混菌发酵可将蛋白质降解为小分子氨基酸、氮磷等营养元素,更有利于黄瓜发芽过程中对营养物质的吸收。 因此,马铃薯淀粉加工汁水经混菌发酵后进行适当稀释,可有效促进黄瓜种子萌发,同时为使用该汁水进行还田灌溉提供了依据。
3 结 语
作者以苔藓假单胞杆菌(4 号菌)与黏质沙雷氏菌(0 号菌)混合发酵马铃薯淀粉加工汁水,通过单因素和响应面实验优化发酵工艺,并对其进行营养物质与气味分析。在15 ℃发酵48 h 的最适发酵条件为苔藓假单胞菌:黏质沙雷氏菌质量比为1.7∶2.0,接种体积分数为1.98%。 在此优化工艺条件下进行验证实验,结果表明:蛋白质降解率为65.32%,显著高于单菌发酵 (P<0.05); 磷酸盐质量浓度为2.86 mg/dL,较未发酵组升高了18.67%;氨氮质量浓度较未发酵组降低了51.05%;且尸胺、组胺、色胺等生物胺未检出,总生物胺质量浓度仅为0.93 mg/L,显著低于其他处理组(P<0.05);吲哚、硫化氢、3-甲基吲哚等恶臭味物质未检出;同时混合菌在发酵过程中植物生长激素质量浓度增加, 且氨基酸含量丰富;将其进行一定稀释后可以促进黄瓜种子的发芽,因此将好氧型苔藓假单胞菌和厌氧型黏质沙雷氏菌混合应用于马铃薯淀粉加工汁水的发酵,可显著提高蛋白质降解率和减少臭味物质产生,减少了对环境的污染,并对植物生长具有一定促进作用。

