一株适用于苦荞米发酵的红曲霉菌株分离与筛选
张艳艳,孙晓康,张晓元,张林军,袁丹丹,刘英梅,陈 勉,张秀华,刘 飞
(山东省药学科学院,山东省生物药物重点实验室,山东省多糖类药物工程实验室,多糖类药物发酵与精制国家地方联合工程实验室,山东 济南 250101)
中国是苦荞麦生产大国,面积和产量均居世界第二位,出口量居第一位。苦荞麦中富含多种营养成分,具有保健功能,是一种“药食两用”产品[1]。据《本草纲目》记载,苦荞麦具有益气、利目、健胃等功效。苦荞麦富含芦丁等黄酮类化合物[2],药理学研究表明,苦荞麦的初级加工品苦荞米具有降糖降脂、抗氧化、预防心脑血管系统疾病等作用[3-5],是一种颇具开发潜力的功能性食品[6]。
红曲霉属于真菌门,是红曲科腐生丝状真菌,种类丰富[7],广泛用于传统食品加工过程。红曲色素是安全的天然色素[8],广泛用于食品着色。研究表明,红曲霉代谢产物有非常重要的生理活性[9],如洛伐他汀有降低胆固醇和降血脂的功效[10-12];γ-氨基丁酸有降血压的作用[13-14]。然而红曲霉的产物桔青霉素[18]是对人畜有害的一种真菌毒素[19],毒性主要作用于肾脏[20],还有诱发突变、致畸、导致肿瘤等潜在危险[21-23]。不同红曲霉产桔青霉素的能力各不相同[24],因此高产洛伐他汀和γ-氨基丁酸、低产桔青霉素成为筛选红曲霉菌株重要指标。
苦荞米产品深层次、细化的开发研究较少,本研究结合苦荞米的天然属性和红曲霉的代谢产物特性,以总黄酮、红曲色素、洛伐他汀、γ-氨基丁酸和桔青霉素的产量为综合考察指标,筛选合适的发酵菌株,旨在进一步深化苦荞米开发。
1 材料与仪器
1.1 材料
豆腐乳、红曲米、苦荞米(市售);洛伐他汀、γ-氨基丁酸对照品(分析纯,阿拉丁);芦丁对照品(分析纯,纯度:98 %,北京百灵威科技);孟加拉红固体培养基(青岛海博);邻苯二醛、巯基乙醇、磷酸(分析纯,国药集团)、乙腈、甲醇(色谱纯,德国默克公司);AlCl3(分析纯、天津科密欧);玻璃纤维滤纸、桔青霉素标准品,桔青霉素免疫亲和柱(Pribolab、青岛普瑞邦生物)。
1.2 仪器
LC-20AT高效液相色谱仪、SPD-M20A紫外检测器、RF-20A荧光检测器(日本岛津);Agilent ZORBAX C18(250 mm×4.6 mm,5 μm);Agilent ZORBAX SB-Aq色谱柱(250 mm×4.6 mm,5 μm);U-T6紫外可见分光光度计(屹谱仪器);Legend micro 21R低温高速离心机(美国Thermo);BSA1245电子天平(德国赛多利斯);KQ-600E超声波清洗器(昆山市超声仪器公司);GM-0.33A隔膜真空泵(天津津腾);S201K pH计(瑞士梅特勒);FXB101-3电热恒温鼓风干燥箱(上海树立)。
2 方法
2.1 红曲霉菌株分离纯化、鉴定
取豆腐乳50 g、红曲米50 g,分别置入200 ml无菌生理盐水,漩涡震荡,无菌条件下于孟加拉红固体平板中划线,28 ℃培养3 d,挑取少量菌丝接种于孟加拉红固体平板中继续恒温培养7 d,继续挑取少量菌丝转接纯化,直至得到纯菌株,30 %甘油洗脱孢子置入-80 ℃冰箱保藏备用。样品送济南博尚生物技术有限公司进行ITS1基因序列测序,用于菌株鉴定。
2.2 红曲霉发酵苦荞米样品制备
2.2.1 苦荞米预处理 称取苦荞米500 g,加入1000 ml纯净水浸泡2 h,冲洗干净后,沥干水分,蒸煮1 h,加入0.5 %酵母粉,121 ℃高压蒸汽灭菌20 min,4 ℃冰箱保藏备用。
2.2.2 孢子悬液制备 将-80 ℃冰箱保藏的菌株于孟加拉红固体平板中进行活化,培养7 d,用无菌生理盐水洗脱孢子,转入带有无菌玻璃珠的三角瓶中,150 r/min震荡30 min,打散孢子,采用4层无菌擦镜纸过滤除去菌丝后,利用血球计数板在光学显微镜下计数,调整孢子数量级约为106/ml,备用。
2.2.3 红曲霉发酵 将1 ml孢子悬液接种于200 g苦荞米固体发酵培养基中,28 ℃静止发酵11 d。每间隔2 d混匀一次。
2.2.4 发酵样品后处理 将发酵结束的固体发酵物置入烘箱,65 ℃烘干6~8 h至恒重,备用。
2.3 红曲色价的测定方法
红曲色价的测定参照GB1886.181-2016食品安全国家标准食品添加剂红曲红[25]的方法进行。称取样品5 g,沸水100 ml溶解,摇匀,静止放凉后,混匀过滤。取此溶液置入1 cm比色皿,分光光度计505 nm测定其吸光度值(A)。色价计算:以试样溶液浓度为1 %,1 cm比色皿,在505 nm波长处测的A计。
2.4 总黄酮的测定方法(AlCl3法[26])
芦丁标准溶液(1 mg/ml)制备:称取芦丁0.0255 g,采用70 %乙醇溶液溶解后,定容至25 ml,于4 ℃冰箱保藏备用。
标准曲线绘制:分别取0,0.050,0.075,0.100,0.125,0.150,0.200 ml芦丁标准溶液,加入1.5 % AlCl3溶液2 ml,最终用70 %乙醇定容至10 ml,混匀后,室温静置30 min,于273 nm波长处测定A。以芦丁标准溶液浓度为横坐标,A为纵坐标,绘制芦丁标准曲线。
样品溶液的制备:称取苦荞麦和发酵后样品各50 g,采用料理机粉碎,取粉碎后样品1 g,加入70 %乙醇10 ml,溶解2 h,于273 nm波长处测定A。
2.5 洛伐他汀的测定方法
HPLC条件[27]:色谱柱 ZORBAX SB-Aq;流动相乙腈:0.01 %磷酸(V:V)=60:40;紫外检测器;检测波长:238 nm;流速1 ml/min;进样量20 µl。
标准曲线绘制:称取洛伐他汀对照品16 mg,溶于4 ml乙腈,逐步稀释至浓度为0.1,0.2,0.4,0.8,1.0 mg/ml,0.22 µm滤膜过滤,HPLC进样分析,以洛伐他汀浓度为横坐标,峰面积为纵坐标,绘制洛伐他汀标准曲线。
样品溶液的制备:称取样品5.0 g,溶于25 ml乙腈,浸泡30 min,超声20 min后,0.22 µm滤膜过滤,HPLC进样分析。
2.6 γ-氨基丁酸的测定方法
HPLC条件[28]:色谱柱 ZORBAX C18;流动相:甲醇:1 %冰乙酸水(V:V)=60:40;紫外检测器;检测波长:332 nm;流速1 ml/min;进样量20 µl。
柱前衍生化:衍生试剂[29]:称取邻苯二醛3 mg,溶于1 ml甲醇,加10 µl巯基乙醇,用0.4 mol/L(pH 10.2)硼酸缓冲溶液定容至10 ml。取0.2 ml待测样品与0.1 ml衍生试剂,混匀反应1 min,0.22 µm滤膜过滤,HPLC进样分析。
标准曲线绘制:称取0.2 gγ-氨基丁酸溶于70 %甲醇中,定容至10 ml,逐步稀释至浓度为0.003,0.005,0.01,0.02,0.04 mg/ml,0.22 µm滤膜过滤,经柱前衍生化后,HPLC进样分析,以γ-氨基丁酸浓度为横坐标,峰面积为纵坐标,绘制γ-氨基丁酸标准曲线。
样品溶液的制备:称取样品5 g,溶于25 ml,70 %甲醇超声20 min,5000 r/min 离心5 min,经柱前衍生化后,0.22 µm滤膜过滤,HPLC进样分析。
2.7 桔青霉素检测的测定方法
参考国标GB5009.222-2016食品安全国家标准食品中桔青霉素的测定[30],红曲类产品中桔青霉素的测定方法。HPLC条件:色谱柱 ZORBAX C18;流动相:乙腈:0.1 %磷酸(V:V)=90:10;荧光检测器;激发波长:350 nm,发射波长500 nm;流速0.8 ml/min;进样量20 µl。
桔青霉素对照品溶液:取桔青霉素标准品(5 µg/ml)4 µl,溶于996 µl甲醇溶液,即得20 ng/ml桔青霉素对照品溶液,逐步稀释得到浓度5,4,2,1,0.5 ng/ml桔青霉素对照品。
样品溶液的制备:分别称取苦荞米及发酵样品各1.0 g,加入20 ml,70 %甲醇提取液,超声提取20 min,8000 r/min离心5 min,吸取上清1 ml加入49 ml 10 mmol/L磷酸溶液(pH 7.5)稀释,采用纤维滤纸过滤,取10 ml过桔青霉素免疫亲和柱,采用甲醇:10 mmol/L磷酸溶液(pH 2.5)洗脱,0.22 µm滤膜过滤,液相色谱检测。
3 结果与分析
3.1 红曲霉分离纯化、鉴定
红曲霉在孟加拉红固体培养基生长会产生红色素,基于此分离纯化得到25株疑似菌株,经济南博尚生物技术有限公司鉴定,22株为红曲霉,优选长势较快的5株菌株,编号为MZ1、MZ7、MZ18、MZ20和MZ23,此5株菌在孟加拉红固体培养基上培养7 d(见图1),其中MZ1、MZ7和MZ18红曲霉菌丝体呈黄色,MZ20和MZ23的菌丝体犹如白色毛毯状。成熟后均具有皱褶,呈红色。针对5株菌的ITS1基因序列,采用软件MEGA11.0进行序列比对,构建系统发育树(见图2),结果表明,各菌株均属红曲霉种。
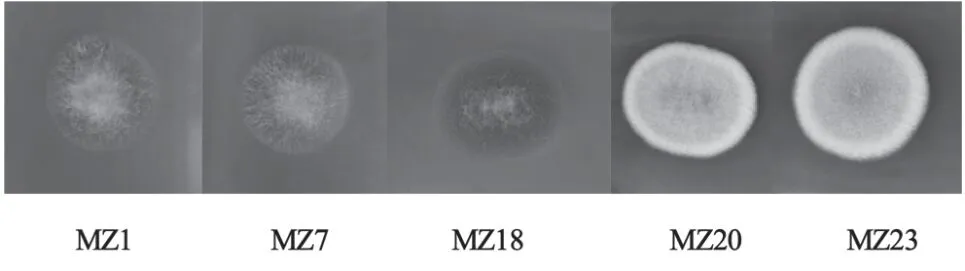
图1 5株红曲霉菌株形态
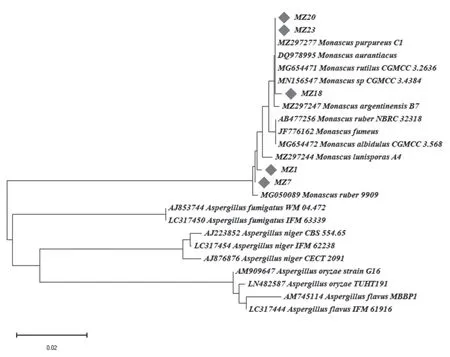
图2 基于ITS1基因序列建立的红曲霉菌株系统发育树
3.2 发酵后样品色价分析
经MZ1、MZ7、MZ18、MZ20和MZ23红曲霉菌株发酵苦荞米的样品,分别命名为MY1、MY7、MY18、MY20和MY23,其色价测定结果见图3。结果表明,不同红曲霉菌株发酵的苦荞米样品色价均有所不同,其中样品MY20的颜色最深,色价最高,样品浓度为1 %、1 cm比色皿,在505 nm波长处测得A为0.395±0.008。
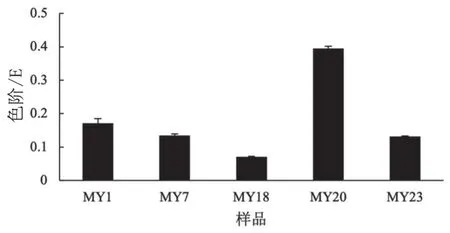
图3 各样品色价
3.3 总黄酮测定结果
以芦丁为对照品测定总黄酮的含量,测定芦丁标准曲线为Y=0.0332X+0.001,R2=0.9998,芦丁在0~25 µg/ml浓度范围内与A呈良好的线性关系。以此方法测定苦荞米及发酵后各样品中总黄酮的含量,结果见图4。苦荞米的总黄酮含量为6.49±1.61 mg/g,发酵后样品的总黄酮含量均有不同程度的提高,其中样品MY20的总黄酮含量最高,可达29.03±4.39 mg/g,是发酵之前的4.47倍。
3.4 洛伐他汀测定结果
以洛伐他汀对照品测定的标准曲线为Y=27 910 846.6667X+16 856.9778,R2=0.9978,洛伐他汀在10~60 µg/ml浓度范围内与峰面积呈良好的线性关系。采用此方法测定苦荞米及发酵后各样品中洛伐他汀的含量,结果见图5。苦荞米中洛伐他汀含量为零,不同红曲霉菌株发酵后的洛伐他汀含量相差较大,其中样品MY20的洛伐他汀含量最高,可达0.52±0.04 µg/g。

图5 样品中洛伐他汀含量
3.5 γ-氨基丁酸测定结果
以γ-氨基丁酸对照品测定的标准曲线为Y=47 319 479.1394X-10 311.0746,R²=0.9997,γ-氨基丁酸在3~40 µg/ml浓度范围内与峰面积呈良好的线性关系。苦荞米及发酵各样品中的γ-氨基丁酸含量见图6。苦荞米中γ-氨基丁酸含量为41.06±6.58 µg/g,发酵后样品γ-氨基丁酸含量均高于苦荞米,MY7、MY20和MY23的γ-氨基丁酸含量分别为139.45±6.10,135.89±7.22,135.31±5.83 µg/g。
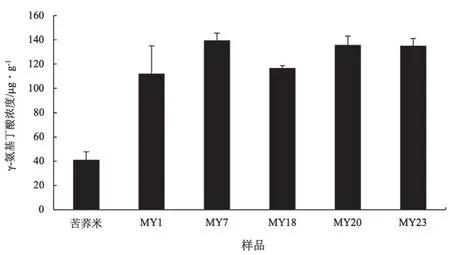
图6 样品中γ-氨基丁酸含量
3.6 桔青霉素测定结果
欧盟规定在红曲霉发酵大米的食品补充剂中桔青霉素的最大限量值为 2.0 mg/kg[31],日本规定在红曲色素中桔青霉素的最大限量值 0.2 mg/kg[32],食品安全国家标准GB 1886.181-2016对食品添加剂红曲红色素中的桔青霉素含量限定为40 μg/kg,轻工行业标准QB/T2847-2007对功能性红曲米(粉)桔青霉素含量限定为50 μg/kg。
以桔青霉素对照品测定的标准曲线为Y=105 397X-7599.3,R²=0.9909,桔青霉素在0.5~5 ng/ml浓度范围内与峰面积呈良好的线性关系。苦荞米及发酵各样品中的桔青霉素含量见图7。发酵后样品的桔青霉素均不高于国家标准和轻工行业标准。
4 结论
本研究中通过分离纯化鉴定,优选5株红曲霉菌株,经发酵苦荞米,检测发酵后样品的色价、总黄酮、洛伐他汀、γ-氨基丁酸和桔青霉素的含量,结果显示红曲霉菌株MZ20发酵样品MY20的色价、总黄酮和洛伐他汀的含量最高,样品MY7的γ-氨基丁酸含量最高,所有样品桔青霉素含量均不高于40 µg/kg。综合上述实验结果选择红曲霉菌株MZ20作为苦荞米的发酵菌株。后续的实验计划优化发酵条件提高色价、总黄酮、洛伐他汀、γ-氨基丁酸的含量,降低桔青霉素含量。

