口服补液盐散(III)中元素杂质的研究
史大勇,郭 伟,颜世强,李亮亮,解春文
(山东达因海洋生物制药股份有限公司,山东 威海 264300)
国际人用药注册技术协调会议(International Conference on Harmonization,ICH)批准的Q3D元素杂质指南中,将药品中的“重金属”一词变为“元素杂质”。元素杂质不仅对药物药效产生影响,也会导致人体中毒,因此,元素杂质检测在药物研发过程中至关重要。我国于2017年加入ICH,在ICH Q3D的基础上,《中华人民共和国药典》2020年版[1-2]收录适合我国国情的元素杂质控制要求。一般原料药的元素杂质来源有:有意加入的合成原料残留物;无意加入的原料负载杂质和生产设备等杂质,且最终能被检测到的元素杂质[3-4]。
口服补液盐散(III)是世界卫生组织推荐的治疗急性腹泻脱水的药物,其纠正脱水的速度优于静脉滴注,主要由氯化钠、氯化钾、枸橼酸钠和葡萄糖组成。除具有补充水、钠和钾的作用外,对急性腹泻有治疗作用,临床主要用于补充水、钠和钾,治疗急性腹泻[5-8]。
本文参照《中华人民共和国药典》2020年版和ICH Q3D元素杂质指南要求,创建电感耦合等离子体质谱(ICP-MS)法测定口服补液盐散(III)中多元素杂质的方法,灵敏度高,干扰少,简便准确,可用于对口服补液盐散(III)中各元素杂质的质量控制[9-10]。
1 仪器与试药
7700X型电感耦合等离子体质谱仪(美国安捷伦公司);MS105DU电子分析天平(梅特勒-托利多);MARS 20微波消解仪(美国CEM公司)。
口服补液盐散(III)(批号:150802,150803,150804,山东达因海洋生物制药股份有限公司);多元素标准溶液(铅、镉、砷、汞、钴、钒、镍、镁、铝、锰,唯一标识:175056,国家有色金属及电子材料分析测试中心);汞单元素标准溶液(唯一标识:158022-1,国家有色金属及电子材料分析测试中心);硝酸(优级纯,含量≥70 %,天津科密欧);水为超纯水。
2 方法与结果
2.1 仪器参数与样品测定
仪器参数见表1。

表1 金属离子含量测定ICP-MS实验参数
2.2 溶液制备
2.2.1 对照品储备溶液(各元素含量:10 ng/ml)精密量取多元素标准溶液0.5 ml与汞元素标准溶液0.05 ml,置于50 ml量瓶,加5 %硝酸水溶液稀释至刻度,摇匀,再精密量取混合液0.5 ml,置于50 ml量瓶,加5 %硝酸水溶液稀释至刻度,摇匀即得。
2.2.2 对照品溶液 精密量取对照品储备溶液0.1,0.4,2,8,12,24 ml,分别置于50 ml量瓶,再以5 %硝酸水溶液稀释至刻度,摇匀即得。
2.2.3 供试品溶液(10 mg/ml溶液) 精密称取样品0.5 g,置消解罐中,加入浓硝酸5 ml,消解 30 min,以5 %硝酸水溶液稀释至50 ml即得。
2.3 方法学验证
参考美国药典<233>[11],验证口服补液盐散(III)元素杂质的测定方法,其验证结果如下。
2.3.1 线性与定量限 精密量取各元素杂质标准溶液适量,在0~5 ng/ml浓度范围内,配制各元素杂质的混合线性试液,以元素浓度(X)及校正数值(Y)进行线性回归,计算回归方程。结果,铅、镉、砷、汞、钴、锰、钒和镍在0.01~4.99 ng/ml内,镁元素的浓度在0~4.89 ng/ml内,铝元素的浓度在0.16~5.02 ng/ml内,线性关系良好,其R2均大于0.9940。取空白溶剂平行测定11次,计算定量限,均低于各元素相应限度。结果见表2。
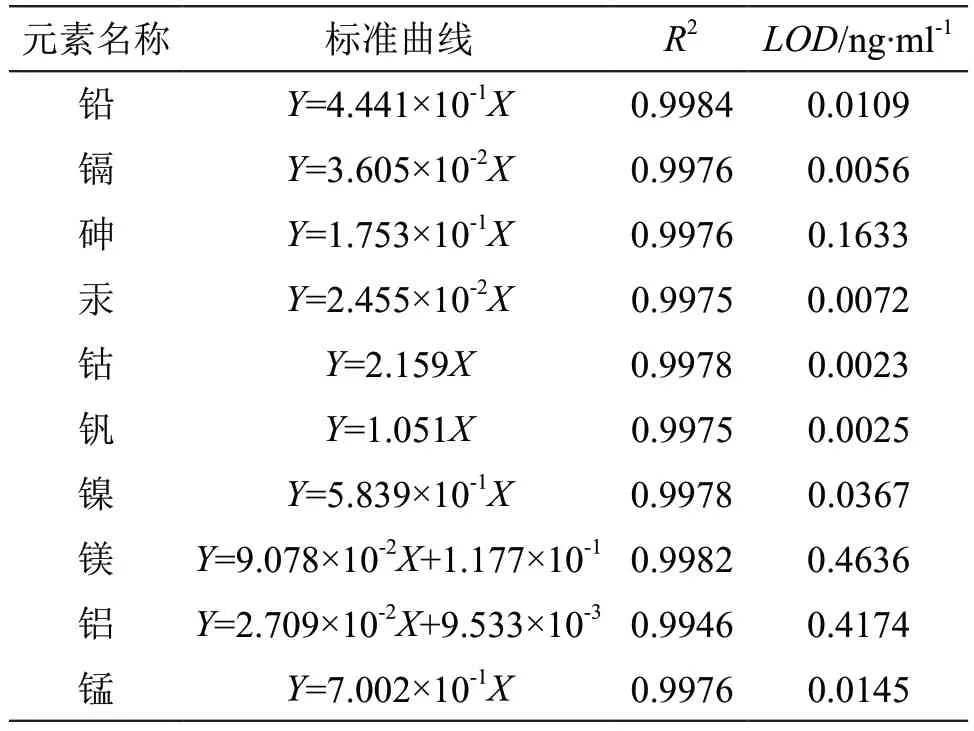
表2 线性实验与定量限结果
2.3.2 回收率 按2.2.1项对照品储备溶液配制对照品储备溶液,按2.2.2项对照品溶液配制对照品溶液。
供试品溶液1:精密称取样品0.5 g,共6份,分别加入对照品储备液1 ml,置入消解罐,加入浓硝酸5 ml,开始消解,再加5 %硝酸水溶液稀释至50 ml,即得。
供试品溶液2:精密称取样品0.5 g,共6份,分别加入对照品储备液10 ml,置入消解罐,加入浓硝酸5 ml,进行消解,再加5 %硝酸水溶液稀释至50 ml,即得。
供试品溶液3:精密称取样品0.5 g,共6份,分别加入对照品储备液20 ml,置消解罐中,加入浓硝酸5 ml,进行消解,再加5 %硝酸水溶液稀释至50 ml,即得。
每个浓度各制备6份,分别进样测定,计算各元素回收率。结果见表3。
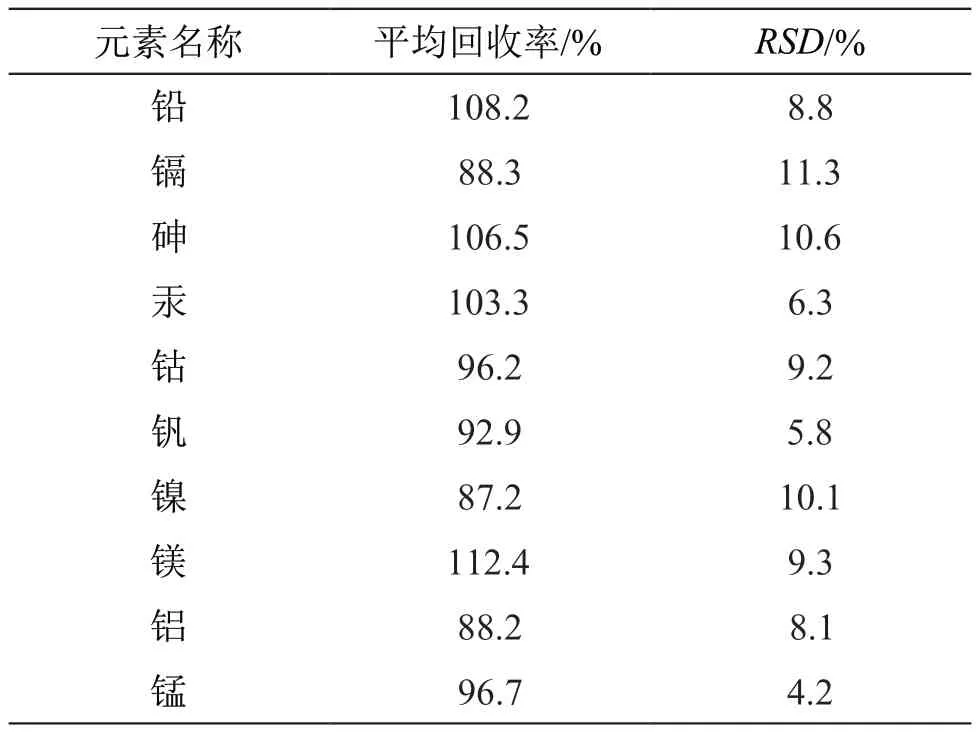
表3 回收率试验结果
2.3.3 精密度 取待测样品按2.2.3项下方法处理,连续进样6次,计算各元素的浓度。结果,各元素含量RSD为0~12.9 %。
2.3.4 重复性 取待测样品6份,按2.2.3项下方法处理,计算各元素的浓度。结果,各元素含量RSD为0~12.6 %。
2.3.5 中间精密度 不同日期,不同操作人员分别取待测样品6份,按2.2.3项下方法处理,计算各元素的浓度。结果,各元素含量RSD为0~12.1 %。
2.4 测定结果
取不同批次待测样,按2.2.3项下方法处理后,分别进样分析,计算样品中各元素的含量。结果见表4。
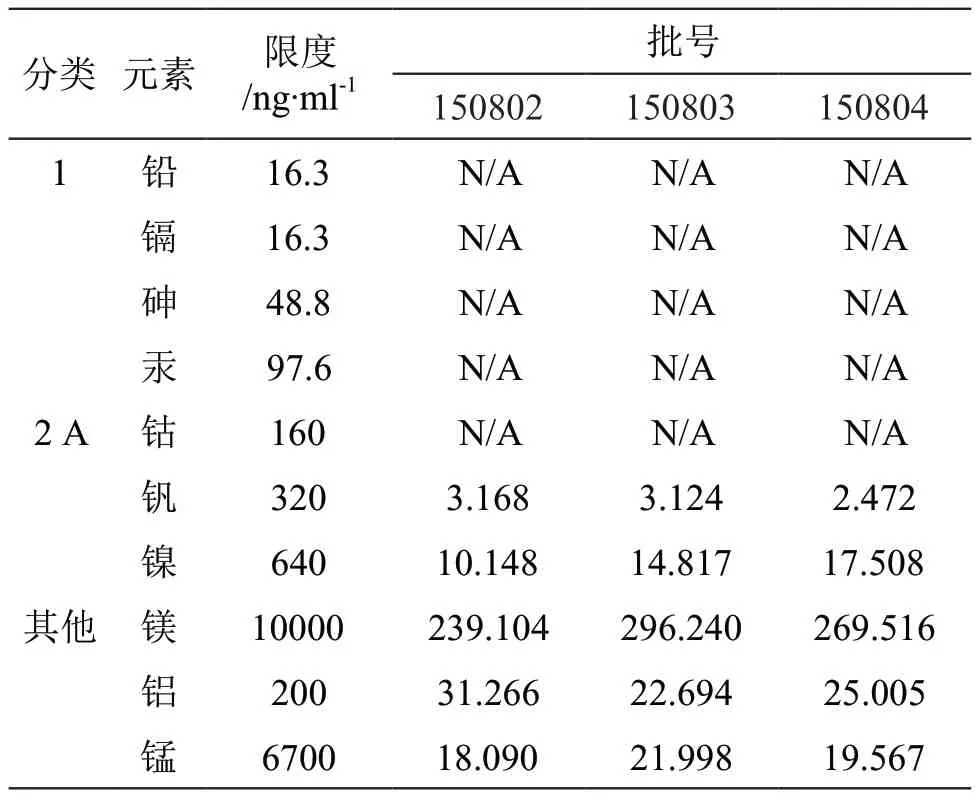
表4 待测品测定结果
3 分析与讨论
3.1 样品处理方法的选择
ICP-MS的进样方式有消解进样、直接或稀释进样及有机加氧进样等方式[12-13]。消解进样具有分解快速、完全,挥发性元素损失小等优点;而直接或稀释进样适合固态样品和有机成分少的样品。本品处方中葡萄糖含量大于60 %,选择直接或稀释进样会有干扰元素被检出,对待测元素产生干扰,所以进行消解,可保证测定结果可靠[14-15],因此选择微波消解法。
3.2 供试品消解量的确定
分别称取口服补液盐散(III)0.5,1.0,1.5 g,按2.1项方法对供试品进行消解,发现称取供试品1.0 g与1.5 g无法消解完全,因此确定取供试品0.5 g进行消解。
3.3 元素杂质的确定 和限度制定依据
按照ICH Q3D中对口服固体制剂的检测规定,需对1类、2A类元素杂质进行风险评估。口服补液盐散(III)由原料氯化钠与氯化钾引入铝、镁和锰,这3种杂质元素属于ICH Q3D中的其他元素分类,毒性较低;但上述元素杂质在含量较高条件下会引起肾毒性及肝毒性,因此同样需检测其含量。本文根据ICH Q3D关于金属催化剂或金属试剂残留限度指南规定,制定了口服补液盐散(III)中各个元素杂质的限度,并创建合理的控制上述元素杂质的方法[16]。

