超高效液相色谱-三重四极杆质谱法测定猕猴桃中氯吡脲含量的不确定度评定
李建新,朱丽君,张晓燕,王鲁霞*,李莹莹
(1. 菏泽市食品药品检验检测研究院,山东 菏泽 274000;2. 菏泽市行政审批踏勘评审中心,山东 菏泽 274000;3. 菏泽学院,山东 菏泽 274000)
氯吡脲,别名施特优、吡效隆,是一种常用于猕猴桃种植,具有提高坐果率、增加膨果产量等作用的新型、高效、低毒的植物生长调节剂[1-4]。但过量使用氯吡脲会影响猕猴桃风味、降低硬度、缩短贮存期、提高腐烂率[5-7];另一方面,过量摄入氯吡脲会对人体产生潜在危害,因此测定猕猴桃中氯吡脲的含量尤为重要。目前猕猴桃中氯吡脲含量的检测方法有拉曼光谱法、液相色谱法、液相色谱-质谱联用法等[8-10]。
测量不确定度表征了被测量值的分散性分布,可减少判错风险,是实验室质量控制和质量监督的重要组成部分[11-12]。一个完整有意义的结果表述同时包含被测量值及相关测量不确定度[13],为确保检验结果的准确度、可信性,需采取合适的检验方法,并对实验的测量不确定度进行合理评定。测量不确定度的评定方法之一是系统地评估所有可能的不确定性来源,明确指定被测量值与其参数之间关系的基础公式,并使用统计建模技术量化所有贡献的不确定性[14]。
本文使用QuEChERS方法(quick,easy,cheap,effective,rugged,safe)提取并净化猕猴桃样品中的待测成分氯吡脲,采用超高效液相色谱-三重四极杆串联质谱法测定含量。建立数学模型,对全过程中各不确定度分量进行评估,如实反映了测量的置信度和准确性,为检测结果的质量控制提供科学依据。
1 材料与仪器
1.1 仪器
超高效液相色谱串联质谱仪(型号:Xevo-TQ S,Waters公司),十万分之一电子分析天平(型号:AL204,梅特勒-托利多)。
1.2 试剂
氯吡脲(批号:84510070,ANPEL,浓度100 μg/ml);乙腈(色谱纯,ThermoFisher);超纯水(摩尔超纯水仪制备),盐包、QuEChERS净化管(深圳逗点)。
2 方法
2.1 仪器条件
2.1.1 液相色谱条件 色谱柱:Waters HSS T3(2.1 mm×100 mm,1.8 µm),流动相A:0.1 %甲酸水溶液,流动相B:乙腈,梯度洗脱程序(见表1),流速为0.3 ml/min。
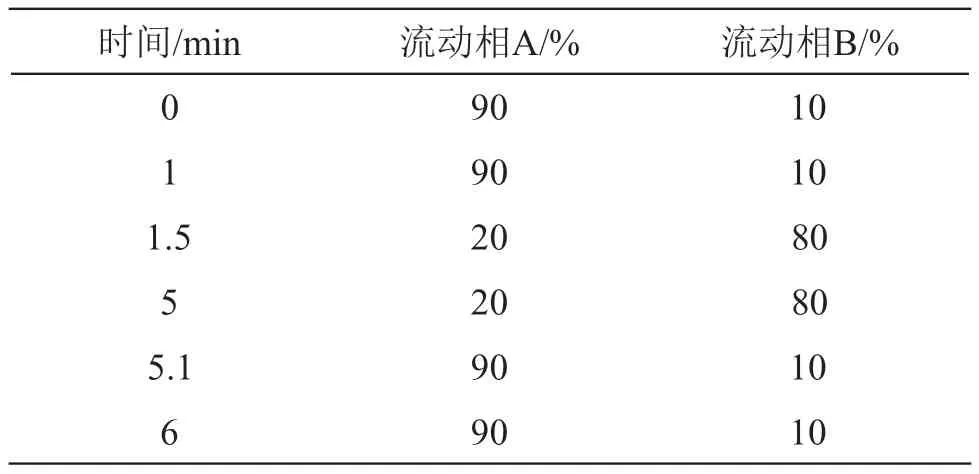
表1 梯度洗脱程序
2.1.2 质谱条件 电离模式:ESI+,监测模式:MRM,离子喷雾电压:3.0 kV,脱溶剂气流速:900 L/h,脱溶剂气温度:400 ℃,其他参数见表2。

表2 质谱参数
2.2 方法
2.2.1 待测样品溶液制备 称取10 g(精确至0.01 g)试样置入50 ml离心管,加入乙腈10 ml,涡旋振荡提取3 min;提取液中加入盐包,涡旋1 min;4000 r/min离心5 min,取6 ml上清置入QuEChERS净化管中,涡旋2 min,6000 r/min离心5 min,取上清过有机系滤膜, 供三重四级杆串联超高效液相色谱检测,标准曲线法定量。
2.2.2 空白基质溶液的制备 称取6份10 g(精确至0.01g)阴性样品置入50 ml离心管,其余步骤参照2.2.1项。
2.2.3 标准系列溶液制备 准确移取氯吡脲标准溶液0.50 ml置入10 ml量瓶,乙腈定容,配制成浓度为5 μg/ml氯吡脲标准储备A溶液,移取A 溶液1 ml置入50 ml量瓶,乙腈定容配制成浓度为100 ng/ml氯吡脲中间液B,分别准确移取0.025,0.05,0.1,0.25,0.5,1.0 ml中间液B置入5 ml量瓶,用空白基质溶液定容至刻度,配制浓度点为0.5,1.0,2.0,5.0,10.0,20.0 ng/ml系列标准工作溶液。
3 不确定度分析
3.1 数学模型与不确定度来源分析
根据猕猴桃中氯吡脲测定的实验过程,建立数学模型见式1。
式中:X为试样中氯吡脲残留量,μg/kg;x为从基质标曲得到的猕猴桃中氯吡脲的质量浓度,ng/ml;V为样液的定容体积,ml;m为样液代表的最终试样的质量,g;R为回收率。
由氯吡脲的信号强度(y)与浓度(x)成线性关系得标准曲线,并由标准曲线根据测定的氯吡脲溶液信号强度求得相应浓度。假定yi和yt分别是标准溶液和待测溶液的信号强度,xi和xt分别表示第i个标准溶液和待测溶液的浓度,i=1~n,n为标曲的标准溶液个数;利用线性方程yt=axt+b公式推出式2。
将a和b带入式2得到氯吡脲浓度C的计算式3。
根据猕猴桃中氯吡脲的测定过程和式1~3,分析全过程的不确定度来源见图1。
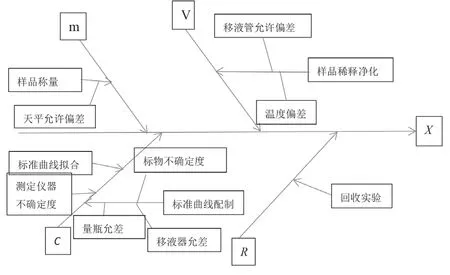
图1 不确定度来源分析
3.2 标准溶液制备引入的不确定度
3.2.1 采购的对照品溶液引入的不确定度 实验用氯吡脲对照品浓度为100 μg/ml,证书标示其扩展不确定度为3.0 μg/ml,假定为矩形分布,取则其相对不确定度:
3.2.2 标准溶液制备引入的不确定度 标准物质配制过程中量器引入的不确定度包括器具示差偏差的不确定度、实际使用温度及校准温度差异等方面的不确定度。根据 JJG 196-2006《常用玻璃量器检定规程》[15]和JJG 646-2006《移液器》[16]要求,各器具的容量允差ΔV、使用次数见表3,取三角分布,包含因子,量取或定容体积为V(ml),其相对不确定度为,实验室的温度波动为(20±4)℃,即ΔT=4,乙腈膨胀系数β=0.00137oC-1,取矩形分布,产生的不确定度为:,用特定量器移取相应体积的溶液,其合成不确定度为:
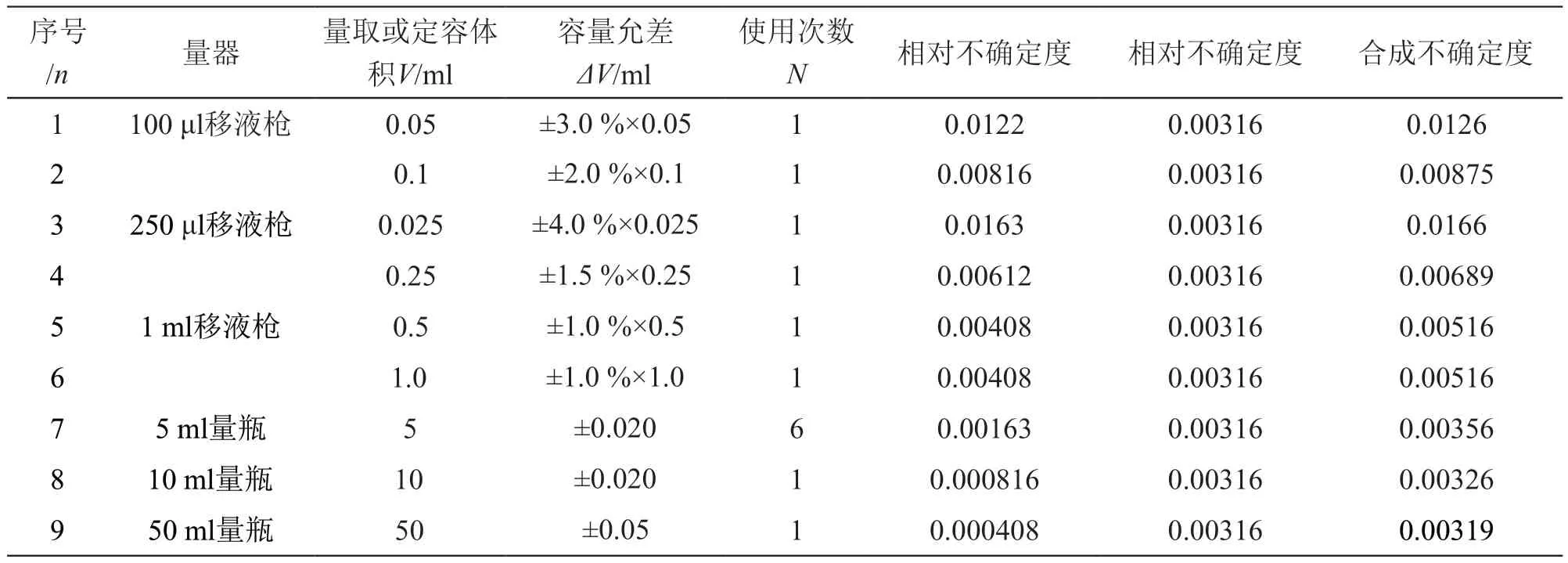
表3 标准溶液制备所引入的不确定度
结合3.2.1项、3.2.2项的计算结果,标准溶液制备引入的相对不确定度为:
3.3 样品前处理引入的不确定度
称样量m为10 g,实验用天平检定证书显示其最大允许误差为±0.001 g,按矩形分布,取,其相对不确定度为:
标示值V=10 ml A级移液管的最大容量允差为±0.015 ml,取三角分布,其相对不确定度为:
实验过程中的温度为(20±4)oC,即ΔT=4,取矩形分布,乙腈的膨胀系数β为0.00137/oC,其相对不确定度为:
则样品前处理过程引入的合成相对不确定为:
3.4 测定仪器引入的不确定度
测定所用仪器(超高效液相色谱-三重四极杆质谱仪)的校准证书显示其扩展不确定度为 15 %,k=2,故测定仪器引入的不确定度为:
3.5 回收实验引入的不确定度
取6份阴性样品,每份样品添加5 μg/kg的氯吡脲,制备猕猴桃阳性样品,按照步骤2.2.1项制备6份平行样品上机测定,计算回收率见表4。
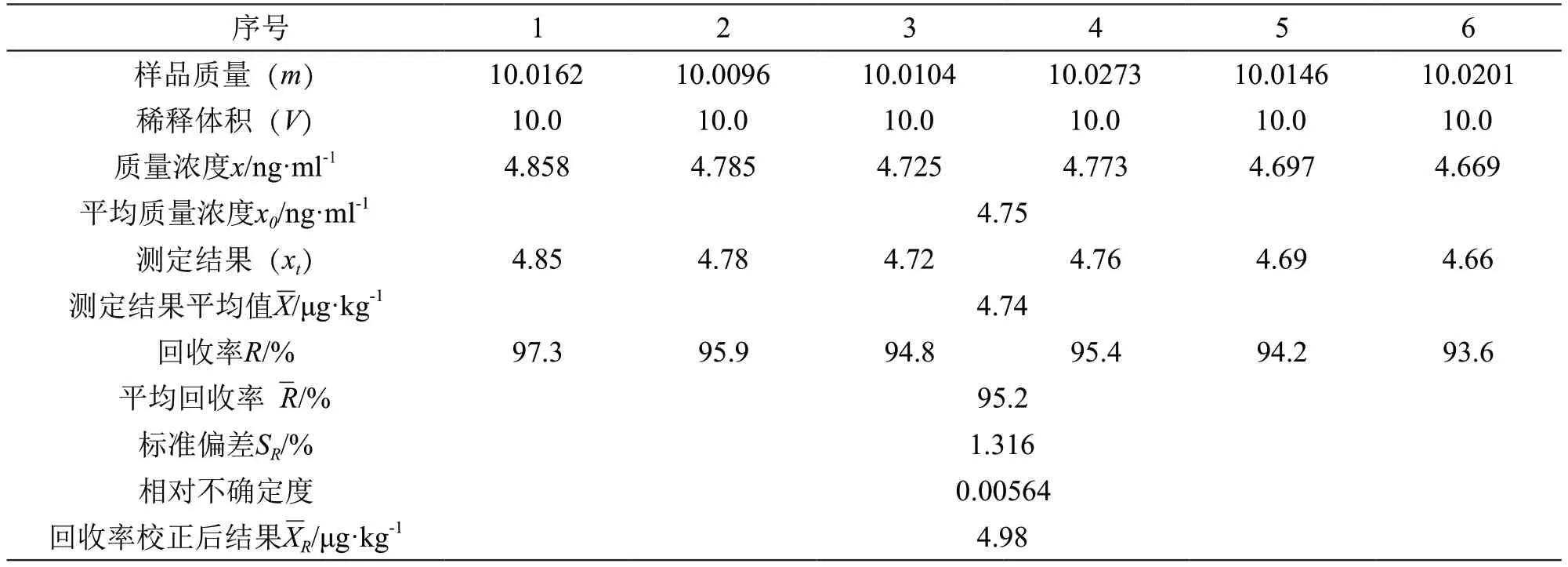
表4 回收率结果分析
相对不确定度为:
根据《化学分析中不确定度的评估指南》[17],通过t检验确定平均回收率与1.0是否有显著差异,本实验t值为:
t值大于2.57(t分布表取置信区95 %,自由度为5时查出),表明平均回收率¯与 1.0 有显著差异性,故需要用回收率校正结果[18]。
3.6 标准曲线拟合引入的不确定度
分别取2.2.2项标准系列溶液各进样1次,以各标准溶液的浓度xi对峰面积yi,线性最小二乘法拟合作标准曲线,得到回归方程y=ax+b及相关系数R2,结果见表5。
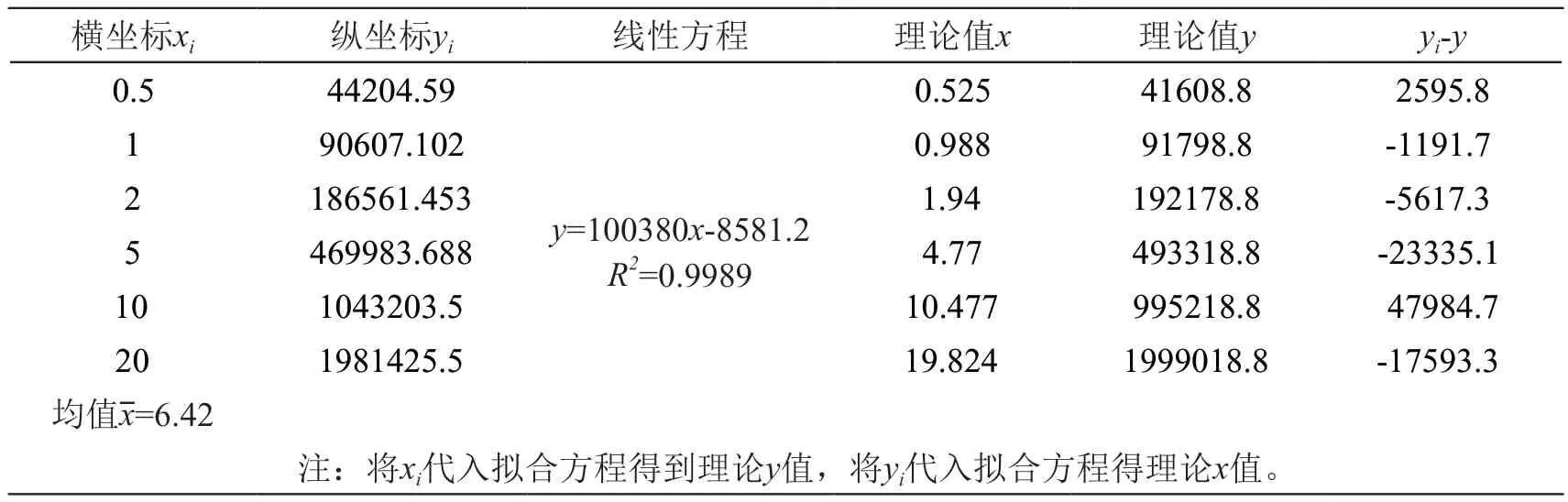
表5 标准曲线拟合数据
标准曲线拟合的标准偏差为:
由标准曲线拟合引入的相对不确定度[19]为:
其中:n=6,为标准曲线的点数;p=6,为样品平行测定的次数;yi为标准曲线对应的峰面积;x 0为样品测得的平均质量浓度,见表4,为4.75 ng/ml;为标准曲线的平均浓度,见表5,为6.42 ng/ml;a=100380,为标准曲线的斜率。
3.7 扩展不确定度与测量结果表示
由3.2项到3.6项分析,各分量不确定度的评定结果见表6。

表6 不确定度分量结果比对
计算的各分量的合成不确定度,计算合成不确定度为:
根据JJF 1135-2005《化学分析测量不确定度评定》[20],在95 %置信水平下,取包含因子k=2,计入回收率修正,则相对扩展不确定度
所测猕猴桃样液中氯吡脲含量的测定结果表述为4.98±0.88 μg/kg。
4 结论
对猕猴桃中氯吡脲含量测定过程中的可能的不确定度来源进行了分析、评定,包括测定仪器、标准曲线拟合、标准溶液的制备、样品前处理、回收实验等引入的不确定度。为提高实验结果的准确性,可以采取标准物质核查、准确控制实验室温湿度、定期开展仪器的校准和期间核查等措施。另外通过培训和定期考核以提高实验人员的操作规范性,以降低实验过程的偏差。

