转化生长因子β1和基质金属蛋白酶-2在大鼠急性胰腺炎胰腺组织修复重建中的作用及其机制
董文珠 李栋 赵琦 李珍 于海涛 王群英
解放军海军第971医院消化科,青岛 266071
细胞外基质(extracellular matrix,ECM)合成与沉积在重症急性胰腺炎和慢性胰腺炎中是持续性的,在轻症急性胰腺炎中是暂时的[1-2]。急性损伤之后,一旦早期的致病因素去除,胰腺组织即可出现再生和修复,其过程受ECM合成与降解平衡的调节。转化生长因子-β1(transforming growth factor-β1,TGF-β1)是ECM合成和成纤维细胞增生的关键调节因子,它与降解ECM的基质金属蛋白酶(matrix metalloproteinase,MMP)-2在炎症后胰腺组织修复重塑和ECM沉积中起着重要作用。TGF-β1短暂的大量表达可以防止胰腺纤维化,并有利于腺泡细胞的再生,而长时期大量表达将导致ECM过度产生而促进纤维化,且可上调MMP-2的表达[3-7]。Smads蛋白家族在TGF-β信号通路中起重要作用,其中Smad3是介导TGF-β信号的关键分子。本研究旨在观察TGF-β1、Smad3、MMP-2和Ⅲ型胶原在急性水肿型胰腺炎(acute edematous pancreatitis,AEP)和急性坏死型胰腺炎(acute necrotizing pancreatitis,ANP)大鼠模型炎症后修复阶段的表达变化及TGF-β1受体拮抗剂(SB431542)对上述表达的影响,以期为抗胰腺纤维化治疗提供新的思路。
材料和方法
一、实验动物及分组
114只清洁级健康雄性SD大鼠由海军军医大学动物实验中心提供,按数字表法随机分为正常对照组(对照组,6只)、AEP模型组(AEP组,36只)、ANP模型组(ANP组,36只)、ANP干预组(18只)、ANP对照组(18只)。
采用皮下注射雨蛙素20 μg/kg、共4次、每次间隔1 h的方法构建AEP模型,采用腹腔注射L-精氨酸(美国Sigma公司)2.5 g/kg、共2次、每次间隔1 h的方法构建ANP模型[8];以正常饮食饮水、无任何操作的大鼠作为对照组;ANP干预组于制模前30 min,制模后24、48 h分别腹腔注射TGF-β1抑制剂SB431542(溶于10% DMSO,美国TOCRIS公司)2.53 mg/kg;以ANP大鼠腹腔注射等容积DMSO作为ANP对照组。对照组、AEP组和ANP组分别在制模后1、2、2.5、3、5、7 d处死大鼠[10];ANP对照组、ANP干预组分别在制模后3、5、7 d处死大鼠,取胰腺组织,部分置液氮保存,部分置于10%甲醛溶液固定。
二、胰腺组织羟脯氨酸含量测定
取液氮保存的胰腺组织,解冻后制备成匀浆,运用羟脯胺酸试剂盒(南京建成生物工程研究所)检测羟脯氨酸含量,按试剂盒说明书操作。羟脯氨酸量(μg/mg蛋白)=(测定管吸光值-空白管吸光值)/(标准管吸光值-空白管吸光值)×标准管羟脯氨酸量(2 μg/mg蛋白)。羟脯胺酸是胶原蛋白中特有的氨基酸,其含量反映胰腺纤维化的程度。
三、胰腺组织TGF-β1、磷酸化Smad3(p-Smad3)、Ⅲ型胶原、MMP-2检测
取甲醛固定的胰腺组织,常规脱水、石蜡包埋、连续切片。采用Envision法检测胰腺组织TGF-β1、p-Smad3、Ⅲ型胶原、MMP-2表达。室温下用1% H2O220 min封闭内源性过氧化物酶,分别滴加美国Santa Cruz公司的抗MMP-2抗体(1∶100)、抗MMP-9抗体(1∶80)、抗TGF-β1抗体(1∶50)、抗Ⅲ型胶原抗体(1∶40),以及丹麦DAKO公司的抗p-Smad3抗体(1∶60),置37℃孵育2 h,再滴加Envision试剂(丹麦DAKO公司)室温孵育30 min,用新鲜配制的0.05% DAB和0.01% H2O2显色8 min。胰腺细胞胞质和间质内出现棕褐色颗粒为阳性。评分标准:无着色或辨认不清为0分,淡棕黄色为1分,棕黄色为2分,深棕黄色为3分。每张胰腺切片随机选择5个高倍视野,取均值。
四、胰腺组织MMP-2活性测定
取胰腺组织匀浆,采用BCA定量试剂盒(美国Pierce公司)测定匀浆的蛋白浓度。因MMP-9和MMP-2的实际分子量相符,故先采用乙二胺四乙酸抑制试验抑制MMP-9活性,再应用明胶聚丙酰胺电泳法测定匀浆的MMP-2活性[11]。电泳后的凝胶经Flours Mutimager图像分析仪Quantity One 4.6.2版图像分析软件成像,并以反转模式打印。酶活性表现为白色背景上的黑色条带,经图像分析系统读取相对定量值,即酶活性。酶活性=条带面积×(条带灰度-背景灰度)。图像扫描条带3次,取均值。
五、胰腺组织MMP-2和p-Smad3蛋白含量测定
取胰腺组织匀浆,采用BCA定量试剂盒(美国Pierce公司)测定蛋白浓度,常规行蛋白质免疫印迹法检测胰腺组织MMP-2和p-Smad3蛋白表达量,以β-action作为内参。抗MMP-2抗体、抗β-action抗体购自美国Santa Cruz Biotechnology公司;抗p-Smad3抗体购自美国Abcam公司;HRP标记羊抗小鼠IgG抗体、HRP标记羊抗兔IgG抗体购自美国Pierce公司。最后ECL发光,X片曝光、显影、定影,置Fluors Mutilmager图像分析仪,用Quantity One 4.6.2版图像分析软件进行分折,记录相应蛋白条带的平均吸光值(mean value intensity,MVI)表示MMP-2和p-Smad3的蛋白表达量。
六、统计学处理
结 果
一、各组胰腺组织羟脯氨酸含量比较
对照组胰腺组织羟脯氨酸含量为(61.71±8.56)μg/mg蛋白。AEP组制模后3 d胰腺组织羟脯氨酸含量达到峰值,为(116.72±8.53)μg/mg蛋白,以后逐渐下降;ANP组制模后5 d时达到峰值,为(174.93±11.75)μg/mg蛋白,以后逐渐下降。制模后3、5、7 d ANP组羟脯氨酸含量均显著高于AEP组(图1A),AEP组又显著高于对照组,差异均有统计学意义(P值均<0.01),提示ANP组ECM沉积明显。制模后3、5、7 d,ANP干预组羟脯氨酸含量分别为(108.07±10.48)、(137.14±8.66)、(112.35±13.16)μg/mg蛋白,显著低于ANP对照组3、5、7 d羟脯氨酸含量的(132.35±14.2)、(175.43±13.75)、(137.92±12.65)μg/mg蛋白,差异均有统计学意义(P值均<0.01),提示ANP干预后胰腺组织的ECM沉积明显下降。
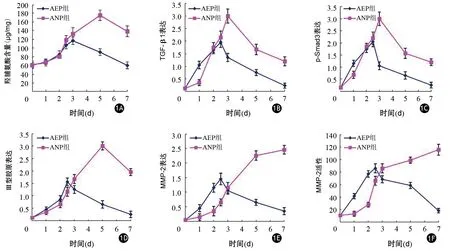
图1 AEP组和ANP组胰腺组织羟脯氨酸含量(1A)和TGF-β1(1B)、p-Smad3(1C)、Ⅲ型胶原(1D)、MMP-2(1E)的蛋白表达及MMP-2活性(1F)
二、各组胰腺组织TGF-β1、p-Smad3、Ⅲ型胶原、MMP-2表达水平比较
AEP组、ANP组胰腺组织TGF-β1、p-Smad3、Ⅲ型胶原、MMP-2均主要分布于损伤的腺泡细胞和间质的纤维组织(图2)。AEP组TGF-β1、p-Smad3、Ⅲ型胶原、MMP-2表达在制模后1 d开始明显升高,于2.5 d达到高峰,后逐渐降低。ANP组TGF-β1、p-Smad3表达在制模后2 d开始明显升高,3 d达到高峰,后逐渐降低;Ⅲ型胶原表达于制模后3 d明显增强,5 d达到高峰,7 d明显下降;MMP-2表达于制模后3 d明显增强,7 d达到高峰(图1B~1E)。对照组、AEP组、ANP组TGF-β1免疫组织化学峰值评分分别为(0.12±0.03)、(1.96±0.21)、(3.00±0.28)分,p-Smad3分别为(0.15±0.05)、(2.05±0.20)、(3.05±0.24)分,Ⅲ型胶原分别为(0.11±0.04)、(1.56±0.15)、(3.10±0.17)分,MMP-2分别为(0.05±0.03)、(1.45±0.20)、(2.45±0.15)分,ANP组显著高于AEP组,差异均有统计学意义(P值均<0.01)。ANP干预组和ANP对照组胰腺组织TGF-β1、p-Smad3、Ⅲ型胶原、MMP-2免疫组织化学峰值评分分别为(2.36±0.21)、(2.25±0.22)、(2.47±0.19)、(2.00±0.10)分和(3.02±0.21)、(3.01±0.19)、(3.05±0.24)、(2.43±0.11)分,ANP干预组显著低于ANP对照组,差异均有统计学意义(P值均<0.01)。
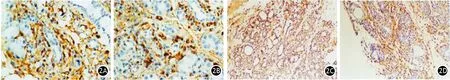
图2 ANP组胰腺组织TGF-β1(2A) 、p-Smad3(2B)、Ⅲ型胶原(2C)、MMP-2(2D)蛋白的表达(免疫组织化学染色 2A、2B×400;2C、2D ×200)
三、各组胰腺组织MMP-2 活性比较
对照组胰腺组织MMP-2活性低;AEP组造模后1 d MMP-2活性增强,2.5 d达到高峰,7 d逐渐恢复正常;ANP组造模后2 d MMP-2活性开始增强,7 d达到高峰(图1F)。对照组、AEP组、ANP组、ANP干预组、ANP对照组胰腺组织MMP-2活性峰值分别为10.85±1.73、90.01±8.92、117.82±9.52、85.78±7.16、115.43±8.7,ANP组显著高于AEP组,AEP组又显著高于对照组,ANP干预组显著低于ANP对照组,差异均有统计学意义(P值均<0.01)。
四、各组胰腺组织MMP-2、p-Smad3蛋白表达比较
ANP干预组制模后3、5 d胰腺组织MMP-2蛋白表达量分别为0.20±0.01、1.19±0.02,ANP对照组分别为0.52±0.01、1.54±0.05;ANP干预组制模后3、5 d胰腺组织p-Smad3蛋白表达量分别为0.30±0.04、0.66±0.11,ANP对照组分别为1.95±0.05、1.30±0.01。ANP干预组MMP-2及p-Smad3表达水平均显著低于ANP对照组;制模后5 d ANP干预组MMP-2、p-Smad3水平显著高于3 d,差异均有统计学意义(P值均<0.05,图3)。
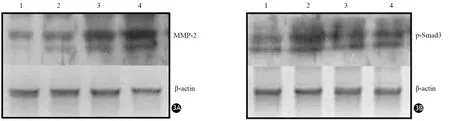
图3 ANP 干预组3 d(1)、ANP对照组3 d(2)、ANP干预组5 d(3)、ANP对照组5 d(4)胰腺组织MMP-2(3A)、p-Smad3(3B)蛋白表达(免疫印迹法)
讨 论
1992年Kloppel与Maillet[1]提出慢性胰腺炎的坏死-纤维化序列理论,急性胰腺炎炎症发生后启动器官的修复、再生机制。轻症急性胰腺炎在结构和功能方面可以完全恢复;重症急性胰腺常表现为实质细胞再生少而间质细胞过度增生,ECM大量沉积,最后可能演化为腺泡萎缩和间质纤维化。本研究结果证实了这一改变。
TGF-β是一类多功能的细胞因子,其释放和活化可调节多种ECM降解酶及其抑制因子的产生,有助于组织修复,但在慢性胰腺炎时,高表达的TGF-β可使组织纤维化,致使器官功能降低或丧失。Smads家族蛋白是TGF-β信号通路的关键传导分子,它们可以将TGF-β信号直接由细胞膜受体转导入细胞核内,为细胞信号跨膜后与核内基因转录之间开通了一条简便途径。国外相关研究表明[12-19],在雨蛙素诱导的胰腺炎修复阶段,TGF-β1在大鼠胰腺腺泡细胞和星状细胞表达增强,24~48 h后TGF-β1蛋白2倍增高,7 d后逐渐恢复正常,TGF-β1mRNA表达量在制模后2 d达到高峰(3倍于正常值);在L-精氨酸诱导的ANP修复阶段,TGF-β1mRNA和前胶原Ⅲ型及Ⅳ型mRNA在制模后2.5 d表达达到高峰,前胶原Ⅰ型mRNA在3 d达到高峰,7 d全部恢复正常。本研究结果显示,AEP组大鼠胰腺组织TGF-β1、p-Smad3、Ⅲ型胶原在炎症诱导后1 d开始升高,2.5~3 d达到高峰,以后逐渐恢复正常;ANP组大鼠胰腺组织TGF-β1、p-Smad3、Ⅲ型胶原在炎症诱导后2~3 d开始升高,3~5 d达到高峰。诱发AEP后,TGF-β1呈一过性高表达,可促进胰腺组织炎症后的组织修复再生;而诱发ANP后,TGF-β1呈持续高表达,则造成ECM大量沉积、实质细胞再生减少,导致组织修复迟缓和障碍。这些结果提示TGF-β1可能是ECM合成和成纤维细胞增生的关键调节因子,在胰腺炎坏死后再生过程中起重要作用。本研究结果还显示,p-Smad3的变化与TGF-β1的变化几乎同步,证实了Smads家族蛋白是TGF-β信号通路的关键传导分子[15-16]。
MMP是降解ECM的主要因子,被认为是组织损伤后重建的主要酶系,在再生过程中被表达和激活[20]。在雨蛙素诱导的胰腺炎大鼠模型[21]中,MMP-2 mRNA表达水平随着ECM和TGF-β1mRNA表达水平的增加而增加,并具有关联性;在L-精氨酸诱导的胰腺炎模型中,MMP-2 mRNA表达水平迟于雨蛙素诱导的胰腺炎模型。也有研究表明[22-23],TGF-β1下调MMP-2 mRNA表达,并降低MMP-2活性,使胶原的合成大于降解,导致胶原纤维的过度沉积,促进细胞的转化;TGF-β1 mRNA表达高峰早于ECM mRNA表达,而且增加的MMP-2 mRNA表达伴随于纤维连接蛋白消失。本研究结果显示,AEP组MMP-2在制模后1 d明显升高,2.5 d达到高峰,7 d接近对照组表达水平;ANP组MMP-2在2 d开始升高,7 d达到高峰;给予TGF-β1抑制剂干预后,MMP-2和p-Smad3的表达均下降。在精氨酸诱导的胰腺炎中,TGF-β1短暂的大量表达可能防止纤维化,并有利于腺泡细胞的再生,而长时期大量表达将导致ECM过度产生而促进纤维化。TGF-β1参与愈合过程,引导单核细胞和成纤维细胞的迁移,增加ECM的合成和分泌,抑制ECM的降解,它对损害组织的修复是通过对ECM的作用介导的,而ECM的适度合成有利于胰腺再生。MMP-2参与随后的愈合过程,可能在胰腺组织再生和防止大量ECM沉积中扮演重要角色。至于TGF-β1-Smad信号转导通路在胰腺急性炎症后组织修复重建中的作用及具体机制,还需进一步深入研究。
综上所述,TGF-β1可能是胰腺ECM重塑和胰腺纤维化的重要调节因子之一,如何对TGF-β1及MMP的表达进行干预调节,减少ECM过度持续沉积,改善胰腺组织的修复重建,随着TGF-β1及其抑制剂的深入研究,将可能成为阻止急性胰腺炎慢性纤维化的新途径
利益冲突所有作者声明无利益冲突
作者贡献声明董文珠:研究操作、论文撰写;李栋、赵琦:数据整理、统计学分析;李珍、于海涛、王群英、赵琦:研究酝酿、研究指导、工作支持;董文珠、李栋:研究设计、研究指导、论文修改、经费支持

