基于MRI影像组学特征的机器学习模型预测胰腺癌CD8+T细胞浸润及预后的研究
卢明智 刘芳 方旭 边云 邵成伟 陆建平 李晶
1海军军医大学第一附属医院放射治疗科,上海 200433;2海军军医大学第一附属医院放射诊断科,上海 200433
胰腺癌是一种对放化疗敏感性差、手术切除率低的致死性恶性肿瘤[1-2],亟需新的系统治疗手段出现。近年来,以免疫检查点抑制剂为代表的免疫治疗虽然在实体肿瘤中取得一定的进展[3-4],但在胰腺癌的应用中却令人失望[5-6],这可能与胰腺癌复杂的免疫抑制性微环境有关。肿瘤浸润性淋巴细胞(tumor infiltrating lymphocytes,TILs)是存在于肿瘤实质和间质内的异质性淋巴细胞群体,其不仅是体内免疫系统对肿瘤局部免疫应答的直接反应,也是肿瘤免疫微环境的主要组成部分[7]。其中CD8+T细胞的存在与对免疫检查点抑制剂疗法的强力应答相关。此外,有研究表明富含CD8+T细胞的患者对放化疗的应答效果更好[8]。已有研究证实在多种实体瘤(包括胰腺癌)中CD8+T细胞是重要的预后因素[9]。因此CD8+T细胞数量对患者预后以及治疗策略的制定均有一定的临床价值。目前术前检测CD8+T细胞数量的主要方法为采用穿刺活检,其局限性是获得的标本量极少,不能反映肿瘤的整体情况。而影像组学可从医学图像中提取高通量特征并分析肿瘤信息,能够对病变图像进行全面精准的评价,而且具有无创、经济和快捷等优势[10-13]。本研究旨在探讨基于MRI图像影像组学的机器学习模型评估胰腺癌CD8+T细胞浸润的可行性,期望有助于筛选可以从免疫治疗中获益的胰腺癌患者。
资料与方法
一、一般资料
回顾性收集2017年1月至2018年4月间海军军医大学第一附属医院156例经手术病理证实为胰腺癌患者的临床、影像、病理及随访资料。纳入标准:(1)患者接受手术切除,术后病理为胰腺导管腺癌;(2)术前7 d内行标准MRI增强检查。排除标准:(1)术前接受过放疗、化疗或放化疗的患者;(2)术后病理未进行免疫组织化学CD8染色;(3)存在MRI无法显示的胰腺病变以及图像质量不满足分析要求。依据国际预测模型建模共识,按照时间顺序将2017年1月至12月共116例患者纳入训练集,2018年1月至4月共40例纳入验证集。本研究获得医院伦理委员会批准(批号:CHEC-Y2020-011)。
二、MRI扫描方法
患者于MRI检查前6 h禁食禁水。MRI设备为美国GE公司Signa HDxt 3.0 T、美国GE公司Discovery 750 3.0 T扫描仪和8通道体部线圈。扫描序列:(1)横断面呼吸触发脂肪抑制快速自旋回波T2WI序列。重复时间(time of repetition, TR)6 316 ms,回波时间(time of echo,TE)85 ms,层数20,层厚5 mm,层间距1 mm,视野440 mm×440 mm,矩阵224×320。(2)肝脏快速容积成像(liver acquisition with volume acceleration,LAVA)T1WI序列。TR 2.58 ms,TE 1.18 ms,层厚5 mm,无层间距,视野440 mm×440 mm,矩阵224×320。增强扫描采用高压注射器以2.0 ml/s的流率经前臂静脉注入对比剂钆喷替酸葡甲胺(Gd-DTPA)0.2 ml/kg,注射结束后用20 ml生理盐水以同样流率冲洗。分别在注射对比剂后15、20、40 s行动脉期、门静脉期、延迟期扫描。
三、图像分析
由2名具有10年以上腹部影像诊断经验的放射科医师在临床和病理学诊断不知晓的情况下采用盲法阅片,意见不同时,协商达成一致。观察指标包括:肿瘤部位、肿瘤大小、肿瘤T1W及T2W图像的信号强度(与周围胰腺组织相比)、肿瘤和血管的关系、胰腺是否有炎症、是否伴有主胰管截断和扩张(直径>3 mm)及胆管截断和扩张(直径>10 mm)、胰腺实质有无萎缩、胰腺轮廓有无异常、胰腺是否有囊肿等。
四、影像组学分析和预测模型构建
影像组学分析的过程包括MRI图像分割、组学特征提取、组学特征降维。选取T1W、T2W以及3期动态增强原始横断面图像进行分析。
采用3D Slicer 4.8.1软件对胰腺肿瘤进行分割。为降低采集条件差异的影响,在提取特征前对图像进行归一化处理。为评价特征的稳定性,使用简单随机化法抽取50例患者的图像,由2名放射科医师分别对感兴趣区(region of interest,ROI)进行勾画、测量,计算观察者间组内相关系数(intraclass correlation coefficient,ICC);由1名放射科医师间隔1周再次勾画肿瘤,计算观察者内ICC。当观察者间与观察者内ICC均>0.75,认为一致性良好,所提取的影像组学特征可靠,数据可以用作后续分析。
组学特征提取采用Python 1.2.0软件。提取的组学特征包括原始特征和滤波器特征,其中滤波器特征包括拉普拉斯高斯滤波、小波分析、平方值、平方根、对数和指数特征6类。每一类特征值所包括的具体特征有一阶统计量、形状特征、三类纹理特征,合计1 409个。先分别剔除组间差异无统计学意义和无显著相关的组学特征,再通过最小绝对收缩和选择算子(least absolute shrinkage and selection operator,Lasso)进一步对高维的组学特征进行降维和选择,最后根据Lasso回归方程公式计算每位患者的组学分值(radscore),建立极端梯度提升(eXtreme gradient boosting,XGBoost)预测模型,模型包含的变量为MRI特征和组学分值。
五、病理学图像分析
使用免疫组织化学法评价肿瘤CD8+T细胞数量。将CD8染色切片通过扫描仪(NanoZoomer S60,Hamamatsu Healthcare,japan)转换为数字病理图像。由1名病理科医师对切片内的肿瘤区域进行标注,注意避开正常胰腺、胰周脂肪及十二指肠,使用数字显微镜分析平台(Visiopharm)对标注区进行细胞识别和计数,自动计算出CD8染色阳性的细胞密度。
根据病理学诊断报告,记录:(1)根据第8版美国癌症联合委员会TNM分期手册评估T和N分期;(2)分化程度;(3)十二指肠有无侵犯;(4)胆总管有无侵犯;(5)脉管内癌栓浸润;(6)胰周神经侵犯。
六、随访
以手术当天为随访开始时间,截止时间为2020年8月1日。任何原因引起的死亡定义为事件发生,该时间段为总生存时间,随访过程中的失访按截尾数据处理。
七、统计学处理
结 果
一、CD8+T细胞高、低组的临床、病理和影像学特征比较
根据X-Tile确定的CD8+T细胞水平截点值为19.09%(图1A、1B),将83例CD8>19.09%者归入高CD8+T细胞组,73例CD8≤19.09%者归入低CD8+T细胞组(图1C),两组CD8表达水平分别为(28.06±8.72)%和(14.48±2.93)%。随访至2020年8月1日,高CD8+T细胞组死亡人数43例,低CD8+T细胞组死亡人数31例,两组中位总生存时间分别为25.51和22.92个月,差异有统计学意义(P=0.007,图1D)。训练集中T分期(P=0.027)和验证集中MRI图像测量的肿瘤大小(P=0.041)与CD8+T细胞浸润程度有关,其余临床、病理、影像学特征差异均无统计学意义(P值均>0.05,表1)。
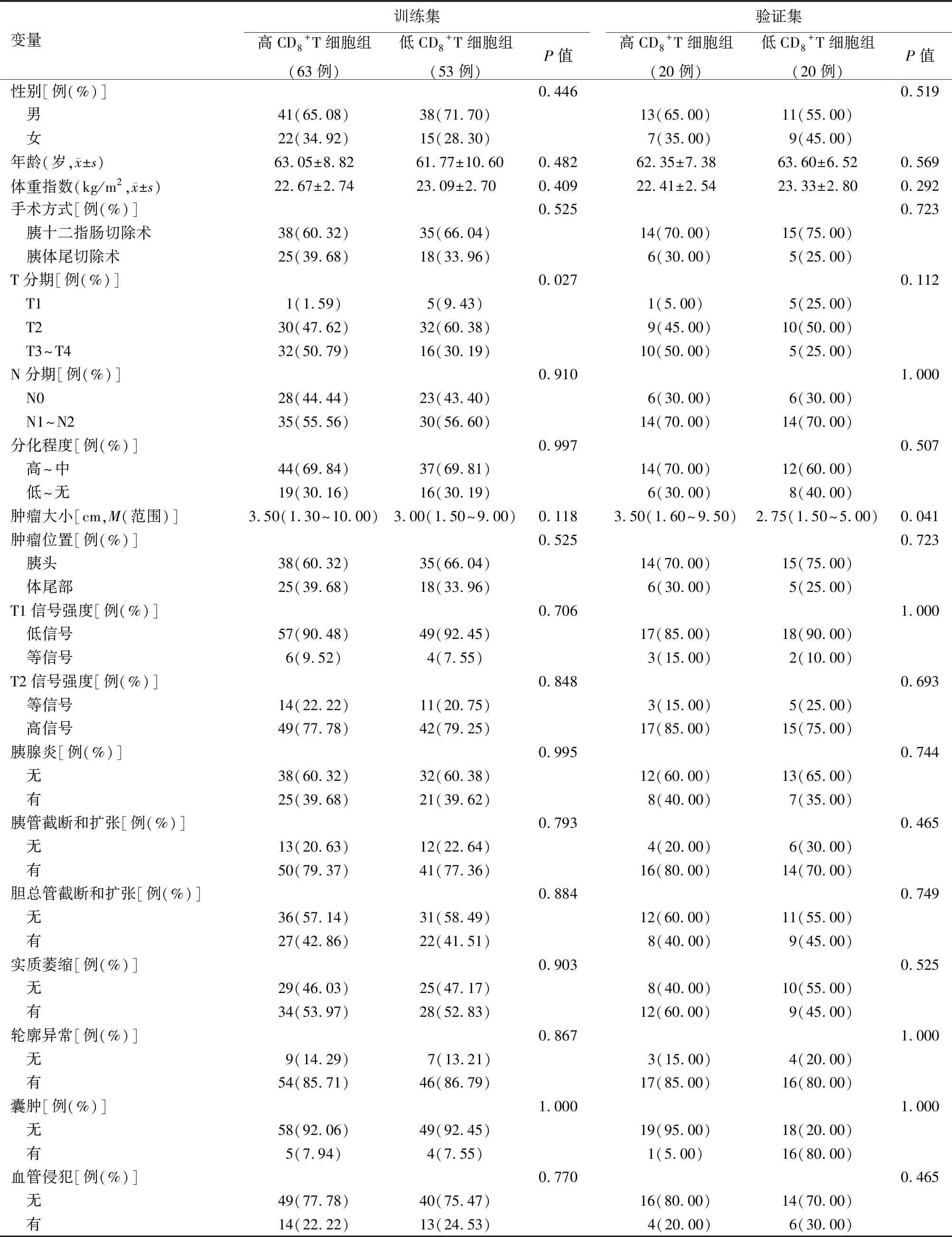
表1 胰腺癌患者的临床、病理及影像学特征基线资料
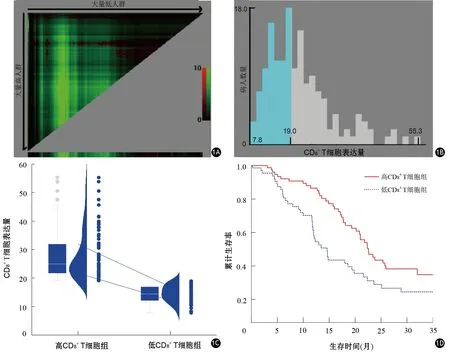
图1 胰腺癌患者生存数据的X-Tile分析。1A、1B 由X-Tile确定的CD8+ T细胞的最佳截断值为19.09%;1C 依据截断值19.09%,将患者分为高CD8+ T细胞组和低CD8+ T细胞组;1D CD8+ T细胞高、低组患者的Kaplan-Meier曲线
二、影像组学分析结果
50例患者间ICC为0.81~0.90,患者个体内ICC为0.83~0.91,表明一致性均良好。
从T1WI、T2WI、动脉、门静脉和延迟期图像中总计提取的1 409个影像组学特征经过组间方差分析、Person相关分析后,获得79个显著相关的组学特征,经Lasso回归降维至19个组学特征(图2A、2B)。通过Lasso回归公式获得组学分值(表2)。高CD8+T细胞组的组学分值为-0.43(范围:-1.55~0.65),低组的组学分值为0.22(范围-0.68~2.54),两组间差异有统计学意义(P<0.001,图2C)。

表2 Lasso回归筛选的影像组学特征与组学方程式
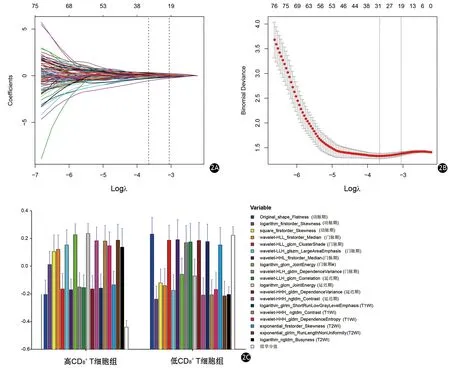
图2 Lasso回归特征降维。2A λ参数与变量的选择路径图;2B λ参数和模型误差;2C 经Lasso回归降维后的19个组学特征误差条形图
三、机器学习模型的构建和性能验证
将肿瘤大小和组学分值纳入XGBoost模型。在训练集中,XGBoost模型预测胰腺癌CD8+T细胞浸润程度的AUC值、灵敏度、特异度、准确度、阳性预测值和阴性预测值分别为0.90(95%CI0.85~0.95)、75.47%、90.48%、0.84、0.87和0.81。在验证集中,XGBoost模型预测胰腺癌CD8+T细胞浸润程度的AUC值、灵敏度、特异度、准确度、阳性预测值和阴性预测值分别为0.79(95%CI0.63~0.96)、90.00%、80.00%、0.85、0.82和0.89(图3A)。校准曲线显示训练集(P=0.767)和验证集(P=0.101)模型拟合度均较好(图3B)。图4为临床实际应用中的2个病例。利用预测模型可以准确区分胰腺癌CD8+T细胞高、低组患者。
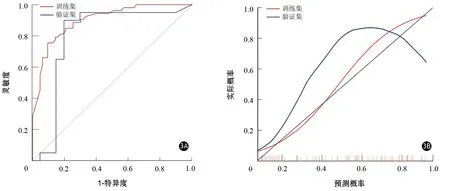
图3 基于XGBoost分类器的训练集和验证集的ROC曲线(3A)和校准曲线(3B)
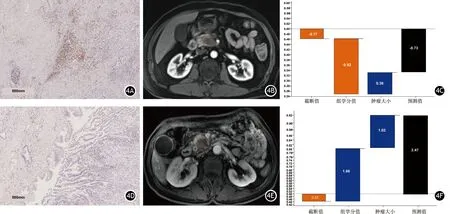
图4 男性,60岁,胰腺癌,高CD8+T细胞组患者。CD8免疫组织化学染色图像,红色为CD8染色阳性细胞(4A,×20);胰腺癌MRI图像感兴趣区勾画示意图(4B);XGBoost分类器预测该患者为低CD8+T细胞组的概率为32.50%(4C)。男性,50岁,胰腺癌,低CD8+T细胞组患者。CD8免疫组织化学染色图像,红色为CD8染色阳性细胞(4D,×20);胰腺癌MRI图像感兴趣区勾画示意图(4E);XGBoost分类器预测该患者为低CD8+T细胞组的概率为92.20%(4F)
讨 论
免疫治疗给恶性肿瘤的治疗带来曙光。对胰腺癌患者免疫状态的充分评估可以帮助临床医师筛选出免疫治疗获益患者,以延长生存,获得更好预后。本研究以病理学结果为金标准,基于肿瘤大小和影像组学特征建立的机器学习模型为指导临床治疗提供了重要的预测信息。
在目前的临床实践中,胰腺癌患者预后评估主要依靠TNM分期系统,但TNM分期不能反映患者之间的异质性[14],因此,即使相同疾病分期的患者,其预后也存在较大差异。尽管一些用于胰腺癌预后评价的生物化学和遗传生物标志物取得研究进展,但它们受限于高成本和操作复杂性等束缚,因此,在胰腺癌患者中开发一种新的个性化预测模型具有重要的临床应用价值。越来越多的证据支持肿瘤微环境中的CD8+T细胞与胰腺癌的预后密切相关[15-21],而活化的细胞毒性T淋巴细胞可通过识别肿瘤特异性抗原发挥免疫杀伤作用[22-23]。因此,定量CD8+T细胞可用来预测患者的预后。本研究结果显示,高CD8+T细胞组患者的总体生存期显著长于低CD8+T细胞组,也证实了这一相关性。
CD8+T细胞的定量分析依赖于病理学,但病理医师阅片主要根据其知识储备和临床经验,存在一定的主观性,不能精确地定量诊断,且术前活检组织样本量小并具有异质性;而常规术前影像图像对肿瘤评价均是基于解剖学和生物学评价,很难与病理微观成分建立联系。本研究通过对肿瘤进行三维勾画并提取影像组学特征,能够更直观、便捷且无创地观察肿瘤的总体特征,这一点对于无法切除的胰腺癌患者尤为重要。Sun等[9]构建了基于CT的影像组学模型评估15种实体肿瘤(但未包括胰腺癌)中CD8+T细胞浸润程度,并可预测免疫治疗的疗效。Liao等[12]基于CT图像筛选7个组学特征构建的组学分值可以预测原发性肝癌患者的生存结局、CD8+T细胞浸润程度、免疫表型和PD-1/PD-L1表达。在胰腺癌方面,Li等[24]发现基于CT的影像组学模型在评估肿瘤浸润CD8+T细胞的训练集和验证集的AUC值分别为0.75和0.67。本研究基于MRI的机器学习预测模型在训练集(AUC值为0.90)和验证集(AUC值为0.79)中均具有较高诊断效能。与CT相比,MRI成像具有软组织分辨率高、多序列多参数成像的优势。
本研究存在一些不足之处。第一,本研究为单中心回顾性研究,未来需纳入多中心数据做验证集;第二,只纳入了手术后患者,不可避免的存在偏倚;第三,由于胰腺癌呈浸润性生长,边缘较模糊,本研究仍采用手工勾画肿瘤感兴趣区,存在勾画者间的经验差异,导致可重复性差,且耗时费力,未来可借助人工智能算法实现肿瘤的全自动分割。
综上所述,基于MRI影像组学特征的机器学习模型在预测胰腺癌CD8+T细胞浸润上具有较高价值,有助于筛选可以从免疫治疗中获益的患者。但本研究仅探讨了CD8+T细胞,而胰腺癌的肿瘤微环境组成复杂,且各组分间存在交互作用,因此该指标在临床预后评估的价值仍有待进一步研究。
利益冲突所有作者声明无利益冲突
作者贡献声明卢明智:研究操作、论文撰写;刘芳、方旭:数据整理、统计学分析; 李晶、边云:研究酝酿、研究指导、工作支持;边云、邵成伟、李晶、陆建平:研究设计、研究指导、论文修改、经费支持

