胰腺淋巴管瘤7例临床及病理学特征分析
韩换 栗境铎 吴印 尹书怡 方旭 何妙侠
1海军军医大学第一附属医院病理科,上海 200433;2海军军医大学第一附属医院放射诊断科,上海 200433
【提要】 胰腺淋巴管瘤( PL)极为罕见,临床表现无特异性,影像学检查易与胰腺其他囊性病变混淆,术前诊断极具挑战性,最终确诊依赖术后病理诊断。本文总结7例PL的临床与病理学资料,对其发病特点、临床表现、病理学和影像学特征及诊断治疗进行分析报道。
胰腺淋巴管瘤(pancreatic lymphangioma,PL)非常罕见,占所有淋巴管瘤的不到1%,约占胰腺所有肿瘤的0.2%[1]。目前国内外报道的PL不超过100例,且大部分为个案报道。淋巴管瘤包括囊性淋巴管瘤、毛细淋巴管瘤和海绵状淋巴管瘤3种组织学类型[2],PL通常为囊性淋巴管瘤[3]。PL的临床表现和影像学特征缺乏特异性,术前诊断困难,常与胰腺其他囊性病变相混淆。为进一步提高临床及病理医师对PL的警惕和认识,本文总结7例PL的临床与病理学资料,对其发病特点、临床表现、病理学和影像学特征及诊断治疗进行分析报道。
一、资料与方法
1.临床资料:回顾性分析2013年1月至2021年12月间海军军医大学第一附属医院7例手术切除后病理学诊断为PL患者的临床资料。收集患者性别、年龄、临床症状、实验室检查及影像学资料、病理形态、免疫组织化学标志物等。电话及门诊随访患者术后生存情况。
2.病理学检查:肉眼观察肿瘤大体形态。所有标本均经10%甲醛固定,常规脱水、石蜡包埋,苏木精-伊红染色,光镜下观察组织形态学变化。免疫组织化学染色采用EnVision法,具体操作步骤严格按照试剂盒说明书进行。选用抗体包括CD34、CD31、ERG、D2-40、HMB45、SMA和Ki-67,所有抗体均购自美国Dako公司。
二、结果
1.临床特征:7例PL患者中男性2例,女性5例,男女之比为1∶2.5;年龄21~69岁,中位年龄51岁。7例患者均有不同程度的腹痛,2例伴有上消化道出血并出现贫血,其中1例胃镜提示十二指肠降段黏膜出血。实验室检查结果显示7例患者血白细胞及分类、血清CEA水平均正常,仅1例患者CA19-9略有升高,其余6例均正常。
2.影像学特征:肿瘤位于胰头2例,胰体尾5例,其中5例单发,2例多发,多发位于胰腺、胰周、脾脏、十二指肠及肠系膜。肿瘤最大径3~19 cm,中位最大径11 cm。
术前CT检查均为胰腺占位,表现为单房或多房囊性圆形或类圆形肿块,囊壁厚薄不均,囊内容物密度或信号均匀。病灶为多房者其内可见不规则纤维分隔,增强扫描可见囊壁及纤维分隔轻度强化或不明显(图1A)。邻近组织受压移位或被包绕,但无明显浸润。MRI显示T1WI呈低或等信号,T2WI呈高信号,内见分隔,增强后分隔有强化(图1B)。
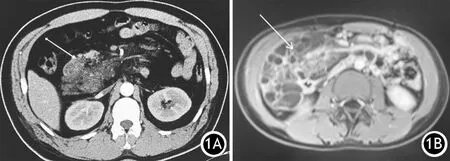
图1 CT显示胰头下方、十二指肠降段内侧大片不均匀软组织影,边界欠清,增强后无明显强化(1A);MRI显示胰腺及其周围见T1WI低、T2WI高信号影,内见分隔,增强后分隔有强化(1B)
3.病理学特征:7例患者均行手术切除,标本经病理学确诊,均为囊性淋巴管瘤。大体见肿瘤切面呈多房囊性,囊壁0.1~2 cm,厚薄不均;部分囊壁呈蜂窝状,周围胰腺萎缩,胰腺分叶状结构稀疏减少(图2);部分囊壁出血,呈灰红色,大体上与血管瘤相似。1例累及十二指肠,其黏膜面可见多个突起呈息肉样改变,引起消化道出血。
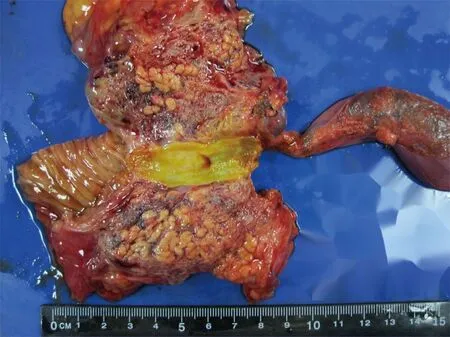
图2 大体见肿瘤切面呈蜂窝状,周围胰腺萎缩,胰腺分叶状结构稀疏减少
显微镜下见肿瘤位于胰腺实质内,周围胰腺组织萎缩,胰腺腺泡和胰岛数量减少(图3A);大的管腔周围可见致密淋巴组织聚集,并可见不完整平滑肌束及较多的脂肪组织(图3B)。
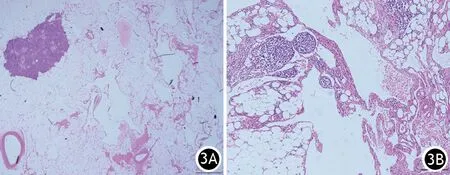
图3 显微镜下见肿瘤位于胰腺实质内,周围胰腺组织萎缩,胰腺腺泡和胰岛数量减少(3A 苏木精-伊红染色 ×20);大的管腔周围可见致密淋巴组织聚集,并可见不完整平滑肌束及较多的脂肪组织(3B 苏木精-伊红染色 ×100)
免疫组织化学显示淋巴管瘤内皮细胞D2-40阳性(图4),CD31部分阳性或弱阳性,CD34、ERG、HMB45、SMA均阴性。

图4 胰腺淋巴管瘤内皮细胞D2-40阳性表达(免疫组织化学 ×400)
4.治疗与随访情况:7例患者均经手术完整切除肿瘤。位于胰头2例患者接受了部分胃、胰头、十二指肠及胆囊切除术。位于胰体尾5例患者接受了远端胰体尾及脾脏切除术。肿瘤多发患者切除了相应的肠段及肠系膜。本组7例患者均获得随访,随访时间10~100个月,中位随访时间74个月。患者术后均无复发,其中1例术后出现血糖增高,采取药物控制。
讨论淋巴管瘤是由先天性淋巴管畸形或淋巴管扩张引起的良性肿瘤[4],创伤、炎症、手术或放射治疗等也可导致淋巴管瘤的发生[5]。淋巴管瘤发生在胰腺实质内或与胰腺附着在一起时即为PL。PL较为少见,由Koch于1913年首次报道,平均发病年龄为40岁[6],多见于女性[7],男女比例约为1∶2,可能与女性口服避孕药、高孕酮血症以及妊娠等有关[8]。PL通常位于胰腺体尾部,也可见于胰腺头部或颈部[9],肿瘤最大径平均为12.3 cm[10],有报道最大可达20 cm[11]。PL常无明显症状,患者临床表现与肿瘤的大小直接相关,当其体积增大时,可触及腹部肿块,出现腹痛、恶心、呕吐等症状[6,12]。由于囊内出血、感染、囊肿扭转破裂或肠梗阻,极少数可表现为急腹症[13]。若病情复杂,也可能会出现贫血、疼痛剧烈、肾积水等。PL累及胃肠道伴淋巴管扩张可引起不明原因的胃肠道出血。本组7例患者均有不同程度腹痛,2例患者伴有上消化道出血并出现贫血,其中1例胃镜提示十二指肠降段黏膜出血。PL通常为单发,少数可出现弥散性或多灶性,称为淋巴管瘤病。本组5例单发,2例多发,其中1例3个肿块,位于胰头、十二指肠及肠系膜,另1例3个肿块,位于胰尾部、脾脏及肠系膜,均为消化道出血者。
PL的CT特征为单房或多房囊性圆形或类圆形的肿块,囊壁厚薄不一,囊内容物密度或信号均匀,合并感染时囊壁增厚,出血时囊内可见“液-液”平面,瘤体可呈等密度或等信号。病灶为多房者其内可见不规则纤维分隔,增强扫描可见囊壁及纤维分隔轻度强化,邻近组织受压移位或被包绕,无明显浸润。根据囊内容物的不同,PL在MRI上表现为T1WI低或等信号,T2WI高信号[14],因淋巴管瘤中含有脂肪成分,所以脂肪抑制图上会有信号降低[15]。这些影像学特征与胰腺中更常见的囊腺瘤很相似,术前容易误诊。本组7例患者术前影像学诊断4例为囊性淋巴管瘤,1例为实性假乳头状肿瘤,1例考虑黏液性囊性肿瘤,1例考虑浆液性囊腺瘤。
PL需要通过组织病理学检查明确诊断。术前可以通过超声内镜引导下细针穿刺术(endoscopic ultrasonography fine-needle aspiration,EUS-FNA)获取囊液和组织标本进行病理学检查[16],囊液常呈淡黄色或乳白色,可为浆液性、血性或乳糜状。有报道称囊液三酰甘油含量高可提示淋巴管瘤[10],这一结论需进一步验证。细胞学检查可显示无定形蛋白质物质背景下分散的成熟淋巴细胞和组织细胞等[4]。部分学者提出EUS-FNA可能是诊断和治疗PL的一种安全、有效的方法[17],但另有学者提出不同意见[18]。病理学检查大体上肿瘤切面呈多房囊性,囊壁有薄有厚,囊内含淡黄色清亮液体。显微镜下见肿瘤由大小不等的腔隙组成,腔内壁衬以单层扁平上皮,腔内充满淋巴液,大的腔隙周围可见不完整的平滑肌及灶性淋巴细胞浸润,常可见组织细胞灶性分布。周围胰腺实质通常萎缩伴局灶性纤维化及脂肪组织转化。免疫组织化学显示淋巴管瘤内皮细胞D2-40阳性,CD31部分阳性或弱阳性,CD34、ERG阴性。
PL需与胰腺囊性病变进行鉴别诊断,尤其是与浆液性囊腺瘤(serous cystic neoplasm, SCN)的鉴别。SCN好发于50~70岁女性,囊肿呈明显的海绵状或蜂窝状外观,组织学检查可见单层立方上皮内衬,免疫组织化学显示细胞角蛋白阳性,而D2-40阴性。此外,PL内出血与血管瘤的出血相似,胰腺血管瘤比淋巴管瘤更为罕见,其发病年龄相似,可以通过形态学及免疫组织化学标志物如D2-40、CD31和CD34等进行鉴别。
PL虽然是良性的,但手术完整切除病灶包括受累器官是首选的治疗方法。根据病变部位和肿瘤大小选择手术方式,如Whipple手术或远端胰腺切除术[19]。同时应最大限度保留正常胰腺实质,维持胰腺的外分泌和内分泌功能。研究表明肿瘤完全切除后复发率为7%,不完全切除则复发率高达50%[20]。近年也有EUS引导下引流治疗PL的报道,虽可暂时缓解症状,但复发率高,因此疗效存在争议[21]。Carvalho等[22]认为淋巴管瘤是良性病变,如果EUS-FNA已经做出明确诊断,则可定期观察。但肿瘤继续生长、体积增大从而压迫邻近器官使淋巴液外漏,可能会引起感染、肿瘤破裂和出血等并发症,所以目前合理的治疗是完全的手术切除。有学者提出对于无症状的小PL,病变无局部侵袭性,可以进行影像学密切随访[23]。本组1例患者第1次发现时腹部隐痛,影像学检查肿瘤最大径4 cm,定期随访半年后腹痛加重,影像学检查肿瘤增大至10 cm。PL的复发率低,总体预后良好。本组7例患者,中位随访74个月,术后均无复发。
综上所述,PL是一种罕见的胰腺良性肿瘤,临床和影像学特征无特异性,术前诊断困难,需与胰腺囊性病变鉴别诊断。因PL具有局部侵袭性生长的特征,完全手术切除病灶及受累脏器是首选的治疗方法。早发现、早手术可降低肿瘤的复发率,患者预后良好。
利益冲突所有作者声明无利益冲突

