胰腺癌患者外周血循环肿瘤细胞ARK5表达与吉西他滨化疗疗效及预后的相关性
高赵峰 郭伟 杨晓丹 刘枭荣 胡凌煜 王晓光
嘉兴学院附属第二医院肝胆外科,嘉兴 314000
胰腺癌是一种侵袭力极强、恶性程度极高的消化系统肿瘤,至2030年或成为第二大癌症相关死亡的原因[1]。由于早期诊断率低、手术可切除率低,化疗在胰腺癌患者的综合治疗中扮演着不可或缺的角色。在众多胰腺癌化疗方案中,吉西他滨一直是胰腺癌临床化疗的一线用药,但由于固有耐药和获得性耐药的存在,制约着吉西他滨的药效发挥[2]。目前尚缺乏生物标志物或其他无创性监测手段来实现胰腺癌的精准化疗指导。ARK5(AMPK-related kinase5)是AMPK(AMP-activated protein kinase)的亚家族成员之一[3]。研究表明ARK5表达水平与肿瘤恶性程度呈正相关[4-6]。笔者团队前期研究结果[7]也证实胰腺癌组织ARK5呈高表达,且其表达水平与肿瘤对吉西他滨敏感性呈负相关,提示ARK5可能是胰腺癌化疗耐药的潜在预测指标。本研究通过无创性检测胰腺癌患者外周血循环肿瘤细胞(circulating tumor cells,CTCs)的ARK5的表达,随访比较ARK5表达阳性与阴性胰腺癌患者的吉西他滨化疗疗效及预后,探讨检测CTCs ARK5表达用于指导胰腺癌吉西他滨化疗的临床价值。
资料与方法
一、临床资料
收集2016年1月至2021年6月间嘉兴学院附属第二医院收治的175例胰腺癌患者外周血标本,并运用高效纳米微流控芯片技术富集CTCs。纳入标准:(1)所有患者均经超声内镜下细针穿刺取得活检组织,并经两位高年资病理科医师读片确诊胰腺癌;(2)均采用临床一线化疗方案(吉西他滨方案)治疗,既往均未接受过手术、免疫治疗、全身放化疗或其他特殊治疗方式;(3)均运用免疫荧光法检测CTCs ARK5的表达;(4)患者血常规、肝肾功能、心肺功能基本正常,心理健康良好。记录患者的年龄、性别、临床症状、肿瘤大小、肿瘤部位、TNM分期、血CA19-9及CEA水平以及转移灶情况等指标。本研究通过嘉兴市第二医院伦理委员会审批(jxey-20180012),所有患者或家属均签署知情同意书。
二、CTCs富集及其ARK5表达检测
1.纳米微流控芯片富集CTCs:采集患者4 ml新鲜外周血样本,移至抗凝离心管内。每支离心管加入红细胞裂解液(不含固定剂)14 ml,轻摇离心管,使细胞沉淀混匀,置于4℃ 15 min,再以1 000 r/min离心5 min(离心半径20 cm),弃上清。加入10 ml以PBS 500 ml+EDTA 0.375 g+BSA 2.5 g配置的缓冲液,悬匀沉淀的细胞,再加入5 μl能与CTCs结合的EpCAM抗体偶联的纳米捕获磁珠(浙江华宇生物科技有限公司)混均,然后将样本液缓慢移至纳米微流控分离系统(无锡纳奥生物医药有限公司),以2.0 ml/min的进样速度[8]通过Nextctc纳米微流控芯片,弃去外管内富集的白细胞,获取并收集内管和中管内CTCs富集液。
2.CTCs表面标志物DAPI、CK及ARK5表达检测:取每个样本的富集液3~4 ml,以1 000 r/min离心5 min(离心半径15 cm),制备CTCs载玻片。以新鲜配置的2%多聚甲醛固定10 min,再用2.5% Triton X-100的PBS透化处理细胞10 min,2% BSA封闭30 min。然后分别加荧光标记的CK-FITC抗体,避光孵育30 min;加荧光标记的DAPI抗体,避光孵育10 min;加荧光标记的ARK5-Alexa Fluor647抗体,避光孵育20 min,最后用20 μl封片剂封片,以不加抗体的CTCs作为对照。载玻片干燥后置荧光显微镜下观察。荧光标记抗体均购自美国Invitrogen公司。CTCs的荧光特征为:DAPI阳性表达呈蓝色荧光,CK阳性表达呈绿色荧光,ARK5阳性表达呈红色荧光。依据ARK表达情况分为阳性组和阴性组。
三、化疗方案与临床评价
吉西他滨化疗方案4周为1个疗程,每疗程第1、8、15天静脉滴注吉西他滨1 000 mg/m2,每4周重复[9]。治疗持续至患者出现病情进展或者出现不可耐受的不良反应时终止。疗效判断依据为WHO实体瘤疗效评价标准[10],分为完全缓解(complete response,CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)、疾病进展(progressive disease, PD),其中有效患者数量为CR+PR+SD例数,耐药患者数量为PD例数。出院后通过门诊或电话进行随访,记录患者的生存状况和死亡时间。总生存期(overall survival,OS)是指疾病确诊之日至末次随访或死亡日期,无进展生存期(progression-free survival,PFS)指患者确诊之日至第一次发生肿瘤进展或死亡时间[11]。
四、统计学处理
结 果
一、患者的临床资料
175例胰腺癌血标本运用高效纳米微流控芯片技术成功富集到CTCs标本98例,富集成功率为55.6%。98例患者中男性57例,女性41例,年龄55~76岁,平均66岁;有临床症状51例;肿瘤长径2~6 cm;肿瘤位于胰头部73例,体尾部25例;TNM分期Ⅲ期43例,Ⅳ期55例;血清CA19-9水平7~2 366 U/L,CEA水平3~124 U/L;肿瘤有肝脏转移53例。98例CTCs标本经免疫荧光检测后,ARK5阳性表达70例,ARK5阳性表达率为71.4%,阴性表达28例(图1)。ARK阳性组和阴性组患者的临床资料比较见表1,两组的临床基线差异均无统计学意义,具有可比性。
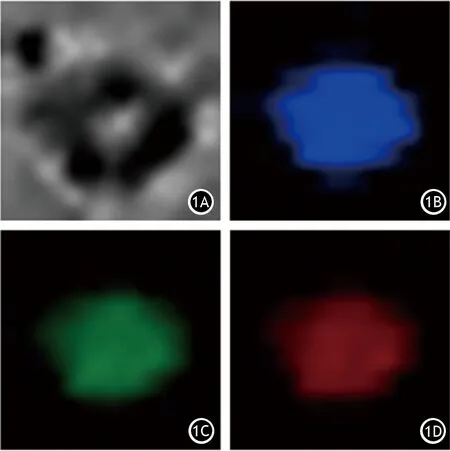
图1 循环肿瘤细胞明视野(1A)及DAPI阳性(1B)、CK阳性(1C)、ARK5阳性(1D)表达(免疫荧光法)
二、CTCs ARK5阳性表达与吉西他滨化疗疗效的相关性
70例CTCs ARK5阳性组患者中64例(91.4%)对吉西他滨化疗产生了耐药性,28例ARK5阴性组患者中12例(42.8%)对吉西他滨化疗产生了耐药性,ARK5阳性组患者吉西他滨耐药发生率显著高于ARK5阴性组,差异有统计学意义(χ2=27.102,P<0.001),提示ARK5阳性表达与胰腺癌吉西他滨化疗疗效呈负相关。
三、ARK5表达与患者平均生存期的关系
98例患者均接受吉西他滨2~12个疗程化疗,平均3.84个疗程。化疗后行2~20个月的跟踪随访,平均随访时间为15个月,无失访。随访结果显示,ARK5阳性组患者的中位生存期为11.5个月,ARK5阴性组为14个月(图2A);ARK5阳性组患者无进展生存期为6个月,阴性组为8个月(图2B),ARK5阳性组患者中位生存期和无进展生存期均显著低于阴性组,差异有统计学意义(P值分别为0.440、0.043)。
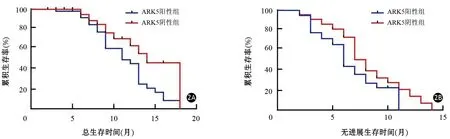
图2 循环肿瘤细胞ARK阳性和阴性胰腺癌患者的总生存期(2A)和无进展生存期(2B)曲线
讨 论
ARK5又称为NUAK1,位于Akt下游,可由Akt进行信号调控,在复杂的肿瘤网络中起着关键作用[11]。ARK5具有介导人类胰腺癌细胞迁移的能力,对胰腺癌的进展具有显著影响[12]。在本课题组前期研究中,发现下调ARK5可提高胰腺癌细胞对化疗药物吉西他滨的敏感性,同时通过调控EMT通路,抑制肿瘤进展[7]。因此笔者推测ARK5有希望成为一种潜在的胰腺癌化疗预后的精准检测手段,有助于指导临床及时改进方案及剂量,实现精准化个性化治疗。
既往的研究中,检测ARK5通常需要获取胰腺癌组织,但由于胰腺癌发病隐匿,确诊时仅有10%~20%的患者有手术机会[13],因此通过在切除样本组织中检测ARK5的应用范围较为局限。CTCs是一种细胞成分,可以储存在原发性、转移性、甚至是播散性肿瘤中,脱落后通过血流扩散,引起肿瘤的转移和复发。近年研究显示,外周血CTCs的遗传学特征与原发灶的肿瘤细胞极为相似[14],这为笔者在开发检测CTCs ARK5表达新方法方面提供了新思路。本研究采用纳米微流控芯片技术在175例中晚期胰腺癌患者检测和富集到98例的CTCs,富集成功率高达55.6%,远高于目前常应用的技术[15],为检测CTCs ARK5表达打下基础。研究结果显示,胰腺癌CTCs ARK5表达阳性患者的吉西他滨化疗耐药发生率明显高于ARK5表达阴性患者,中位生存期和无进展生存期均显著低于ARK5阴性患者,差异均有统计学意义,提示对CTCs ARK5表达阳性患者单独应用吉西他滨化疗的疗效有限,这一结果有助于指导临床医师对胰腺癌化疗药物的选择及对中晚期胰腺癌患者的精准治疗。未来有待纳入更多患者并通过多中心研究进一步验证。
利益冲突所有作者声明无利益冲突
作者贡献声明高赵峰:研究操作、论文撰写、数据整理、统计学分析;郭伟:研究操作、数据整理、统计学分析,论文修改;杨晓丹、刘枭荣:病例数据收集、临床诊疗、工作支持;胡凌煜:研究操作、数据整理、统计学分析、论文修改;王晓光:研究设计、研究指导、论文修改、经费支持

