腹腔镜胰十二指肠切除术156例临床分析
厉学民 俞世安 周海华 吴晓康 李仓 任超
浙江大学医学院附属金华医院肝胆胰外科,金华 321000
【提要】 回顾性分析浙江大学医学院附属金华医院肝胆胰外科行腹腔镜胰十二指肠切除术(LPD)的156例患者的临床资料,探讨在地市级医院常规开展LPD的可行性和安全性。156例胰十二指肠切除术均在完全腹腔镜下完成,手术时间(351±42)min,术中出血量(280±212)ml,术后住院天数(16±8)d;7例联合血管切除重建,其中血管楔形切除5例,肠系膜上静脉节段切除、端端吻合1例,肠系膜上静脉节段切除、人工血管重建1例。术后32例(20.5%)发生并发症,8例患者发生了两种并发症,再手术7例。无围手术期死亡。结果表明掌握娴熟的腹腔镜操作技能,术中精细操作,重视围手术期处理,在地市级医院常规开展LPD是安全可行的。
腹腔镜胰十二指肠切除术(laparoscopic pancreatico-duodenectomy,LPD)操作复杂,术后并发症发生率较高,是腹部外科腹腔镜下最复杂和最困难的手术之一。随着腹腔镜技术不断进步和器械设备的发展,LPD已成为国内多家医疗中心的常规手术[1]。浙江大学医学院附属金华医院开展胰十二指肠切除术已40余年[2],是国内较早开展联合静脉切除重建治疗胰头癌的单位之一。笔者团队在地市级医院中率先开展LPD[3],积累了一定经验。现回顾性分析156例行LPD的患者临床资料,总结地市级医院开展LPD的围术期经验,探讨LPD在地市级医院常规开展的可行性和安全性。
一、资料与方法
1.一般资料:收集2013年3月至2022年12月浙江大学医学院附属金华医院肝胆胰外科156例行LPD患者的临床资料。其中男性72例,女性84例;年龄27~84(61±11)岁,体重指数(22.7±2.4)kg/m2;术前血总胆红素(98.32±89.67)μmol/L,白蛋白(38.25±4.16)g/L。纳入标准:(1)术前经CT、MRI、EUS或PET-CT等影像学检查,肿瘤位于胰头、十二指肠及壶腹周围;(2)肿瘤未侵犯肠系膜上动脉,无门静脉及肠系膜上静脉癌栓;(3)无远处转移;(4)无合并其他器官严重的器质性病变;(5)临床资料完整。术前采用经皮肝穿刺胆道引流(percutaneous transhepatic cholangio drainage, PTCD)、经皮经肝胆囊穿刺引流(percutaneous transhepatic gallbladder drainage, PTGD)或经内镜鼻胆管引流(endoscopic nasobiliary drainage, ENBD)12例(7.6%)。
2.手术方法:患者气管插管全身麻醉,仰卧头抬高10°~30°,分腿位,扶镜手站于患者两腿之间,主刀医师与助手分别位于患者左侧与右侧。采用5孔法,脐下缘弧形切开1.0 cm置入腹腔镜作为观察孔,另外4个穿刺孔与观察孔呈“V”型分布。进镜后全面探查腹腔,明确无肿瘤转移后,打开Kocher切口,探查肠系膜上动脉以判断肿瘤的可切除性,进一步游离肠系膜上静脉,检查病变与肠系膜上静脉、门静脉的关系,分离肠系膜上静脉与胰腺后方的间隙,建立胰后隧道。放置绕胰提拉带。彻底清扫胃左动脉、肝总动脉、腹腔干周围的淋巴结与肝十二指肠韧带的淋巴结,使上述血管脉络化(图1、2)。直线切割闭合器(Endo-GIA)离断胃体,切除远端胃50%,肠系膜上静脉左侧横断胰腺,胆囊管上方横断肝总管,Treitz韧带下方10 cm离断空肠,肠系膜上动脉右侧完整切除胰腺钩突。
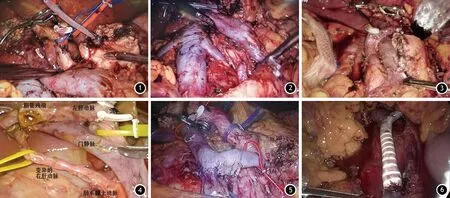
图1 淋巴结清扫后,胃左动脉、肝总动脉、腹腔动脉干等血管脉络化;图2 显露的腹主动脉、下腔静脉、左右肾静脉;图3 变异的肝总动脉发自肠系膜上动脉;图4 变异的右肝动脉发自肠系膜上动脉;图5 肠系膜上静脉节段切除端端吻合;图6 肠系膜上静脉节段切除人工血管重建
消化道重建采用Child方式。在胰颈断面彻底止血后找到胰管,置入粗细合适的硅胶管,用3-0可吸收缝线固定硅胶管,确保在胰肠吻合口愈合前不脱落。胰肠吻合方式采用导管对黏膜式与双荷包桥接式。胆肠吻合采用3-0普迪思缝线连续缝合或间断缝合。胃肠吻合采用Endo-GIA。常规在胰肠吻合口前放置1根腹腔引流管、胰肠吻合口后与胆肠吻合口旁放置1根引流管。切除标本从扩大的脐下缘戳孔取出或上腹正中另切开4~5 cm切口取出。
二、结果
1.手术情况:156例胰十二指肠切除术均在完全腹腔镜下完成,无中转开腹病例。手术时间(351±42)min,术中出血量(280±212)ml,术后住院天数(16±8)d。术中发现肝动脉变异10例(图3、4)。对7例胰头癌侵犯血管的患者联合血管切除重建,其中肠系膜上静脉、门静脉楔形切除5例,肠系膜上静脉节段性切除、端端吻合1例,肠系膜上静脉节段切除、人工血管重建1例(图5、6)。术中清扫淋巴结10~23枚,平均清扫淋巴结15枚。术后病理显示胰头癌49例、十二指肠腺癌16例、壶腹部癌41例、胆管癌28例、胰头肿块型慢性胰腺炎3例、胰腺导管内乳头状黏液瘤8例、神经内分泌肿瘤11例。所有患者手术切除标本切缘均为阴性。
2.围术期处理:所有患者术后早期均禁食、禁水,常规全胃肠外营养支持,予以生长抑素抑制胰液分泌、制酸、抗感染等处理。运用加速康复外科理念[4],尽早拔除胃管与导尿管,敦促患者早期下床活动。尽早使用肠内营养。对联合血管切除重建的患者予以低分子肝素治疗。
3.术后并发症发生情况:术后32例(20.5%)发生并发症,8例患者发生了两种并发症。其中B级胰瘘15例、C级胰瘘1例、腹腔出血6例、消化道出血2例、胆瘘5例、胃排空障碍8例、肺部感染3例。再手术7例,腹腔出血的6例患者中有4例再次行腹腔镜下或开腹止血,另2例DSA下动脉栓塞止血成功;消化道出血的2例患者,1例开腹胰肠吻合口加缝止血,另1例保守治疗后好转;胆瘘5例中2例因胆瘘量大、腹腔感染重再次行腹腔冲洗引流、胆肠吻合口旁加置引流管处理。所有再手术患者均好转出院,无围术期死亡病例。
讨论LPD是腹部外科最为复杂、风险最高的手术之一,围术期死亡率可达5%,并发症发生率甚至高达50%[5-6],因此国内LPD专家共识不推荐该术式在所有医院常规开展和推广,美国迈阿密会议共识也建议LPD仅在高流量大型肝胆胰中心由经验丰富的专科医师开展[7]。浙江大学医学院附属金华医院开展胰十二指肠切除术已40余年,随着腹腔镜胃癌根治切除术及腹腔镜保脾胰体尾切除术等微创手术的广泛开展,笔者团队掌握了娴熟的腹腔镜操作技能,并成功开展LPD,近10年已完成LPD 156例,无围术期死亡。
LPD的顺利实施需要围术期规范化与精细化的管理,其相关措施的实施是保证LPD患者手术顺利和术后恢复的关键。肿瘤的精准定位与定性是手术顺利进行的基本。术前常规CT与CT血管造影是判断肿瘤能否切除的客观依据,全腹部CT血管造影重建能发现各种血管变异,有助于减少术中血管的副损伤,同时,对术后肝功能的保护及因肝动脉副损伤引起胆肠吻合口漏、肝脓肿的预防也有帮助。术前与影像科医师共同阅片及术中精准解剖可有效预防LPD术中变异肝动脉的损伤。与开腹胰十二指肠切除术不同,LPD常规需要悬吊左肝以暴露视野,同时可解放助手的左手,有利于协助主刀医师更好地完成淋巴结清扫及胰肠、胆肠的吻合。在悬吊左肝的过程中,应当注意行走于肝胃韧带内的变异左肝动脉或副左肝动脉[8]。
胰十二指肠手术联合血管切除对外科医师而言仍然充满无限挑战[9]。本组肠系膜上静脉节段切除、端端吻合患者恢复顺利,无任何并发症,术后14 d出院。而肠系膜上静脉节段切除、人工血管重建患者,并发胰瘘、胃瘫,经过各种治疗胃排空障碍的方法,术后3月余仍未恢复,最后经过静脉全身化疗,最终好转出院。因此,作为技术要求更高的联合血管切除重建的LPD仍需谨慎而为。
胰瘘是LPD术后最常见及严重的并发症之一,简单易行的吻合方式及精湛的腹腔镜下操作技术是胰肠吻合的关键[10]。本组发生B级胰瘘15例、C级胰瘘1例,均经非手术治愈。笔者团队对LPD术中双荷包桥接式与导管对黏膜式两种胰肠吻合方式进行了对比研究,结果发现与导管对黏膜吻合相比,双荷包桥接式胰肠吻合在LPD术中的操作简单、胰肠吻合时间短,尤其适用于胰管不扩张的患者[11]。胰瘘是导致腹腔感染及序贯腐蚀大血管引起腹腔内大出血的主要因素,因此胰液得到彻底引流、防止积聚是关键。笔者团队LPD术中常规放置2根腹腔引流管,1根放置在胰肠吻合口前,另1根放置在胰肠吻合口后方,经温氏孔从右肝下引出,同时兼顾到胆肠吻合口与腹膜后创面的引流。术后出血是LPD患者另一个常见的并发症,也是再手术的一个重要原因[12]。笔者认为,与介入手术相比,外科手术在止血的同时,可以进行胰肠吻合口的加缝及腹腔彻底冲洗引流。为预防胃十二指肠动脉(gastroduodenal arteria,GDA)的出血,笔者团队用7号丝线结扎,再予以Hemolock夹双重夹闭GDA,丝线结扎处应距GDA根部0.5 cm处,这样一旦发生GDA出血,可为介入动脉栓塞治疗留有余地,否则只能靠栓塞肝动脉来止血,有导致肝脓肿、肝功能不全,甚至肝功能衰竭之虑。
综上所述,掌握娴熟的腹腔镜操作技能,术中精细操作,重视围术期处理,LPD在地市级医院常规开展是安全可行的。
利益冲突所有作者声明无利益冲突

