miR-22-3p靶向调控PLAGL2保护OGD/R诱导的心肌细胞损伤机制研究
陈玥璇 汪潞 柳华锋
心肌缺血再灌注(ischemia-reperfusion,I/R)损伤是指急性冠状动脉闭塞后,再灌注导致更严重的心肌损伤,是影响心肌梗死患者预后的重要因素[1]。铁死亡是一种新型的调节性细胞死亡,其特征是铁依赖的脂质过氧化物累积,在心肌缺血等多种疾病中发挥重要作用[2]。微小RNA(micro RNAs,miRNAs)在转录后水平调控基因表达,参与调控细胞增殖、分化、凋亡和自噬等过程。有研究表明miR-22-3p 可作为诊断冠心病的特异性生物标志物[3],然而miR-22-3p 在I/R 损伤期间对于心肌细胞损伤的保护机制尚不清楚。因此,本次研究探讨了I/R 过程中miR-22-3p 对心肌细胞保护的分子机制。
1 材料与方法
1.1 研究对象 本次研究起止时间为2022 年8 月至2023年4 月,采用购自武汉普诺赛生命科技有限公司的大鼠心肌细胞系H9c2 作为研究对象。所有实验操作均在杭州市中医院实验室进行。
1.2 细胞培养和转染 H9c2细胞在含10%胎牛血清、100 U/ml 青霉素和100 g/ml 链霉素的DMEM 培养液中,置于37 ℃含5%CO2的恒温细胞培养箱中培养。转染方法参考LipofectamineTM2 000转染说明书,转染48 h后收集细胞用于后续实验。
1.3 氧糖剥夺/复氧(oxygen and glucose deprivation/reoxygenation,OGD/R)体外细胞模型构建 H9c2细胞根据是否缺氧分为常氧组、OGD/R 组,根据是否转染miR-22-3p mimic 分为OGD/R 组+miR-NC组,OGD/R+miR-22-3p 组,根据是否共转染miR-22-3p mimic 和Fer-1 分为OGD/R+Fer-1 组和OGD/R-Fer-1+miR-22-3p 组,根据是否共转染miR-22-3p mimic 和PLAGL2 过表达质粒分为OGD/R+miR-22-3p 组和OGD/R+miR-22-3p+PLAGL2 组。OGD/R处理方法如下:H9c2细胞在血清和无糖DMEM中培养,含有1%O2、5%CO2和94% N2,37 ℃下培养6 h。缺氧后,细胞在正常生长条件下(5%CO2和95%空气)的完全培养基中再培养12 h。常氧组细胞在正常生长条件下,用完全DMEM培养液培养。本次实验为验证miR-22-3p 对铁死亡的调控,H9c2 细胞用60 nmol/L 铁死亡抑制剂Fer-1 进行预处理24 h,然后用OGD(6 h)/R(12 h)处理。
1.4 CCK-8检测细胞活力 将H9c2细胞以1×104细胞/孔的密度接种到96 孔板中。OGD/R 处理18 h后,根据说明书要求,使用CCK-8 试剂盒检测分别在24 h、48 h、72 h 和96 h 的细胞活力。每孔加入10 μl CCK-8溶液,在37 ℃孵育3 h后,用酶标仪测定450 nm处的吸光度。
1.5 实时定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)用Nanodrop 检测从H9c2细胞中分离的RNA浓度和纯度。逆转录体系为1 μl oligo(dT)Primer,用ddH2O 补充至10 μl,逆转录程序为37 ℃,15 min,85 ℃,5 s。qRT-PCR反应体系,12.5 μl SYBR Premix Ex Taq Ⅱ,1 μl cDNA 和上下游引物各0.5 μl,ddH2O 补充至25 μl。采用2-ΔΔCt公式计算miR-22-3p 相对表达量,U6 作为内参。引物如下所示:miR-22-3p:5' -AAGCUGCCGUUGAAGAACUGU-3'(正向),5'-GTGCAGGGTCCGAGGT-3'(反向);U6:5'-AACCTTATATCGGGCGGGA-3'(正向),5'-TTACGGCGATGCATAAT-3'(反向)。
1.6 铁死亡水平测定 取细胞悬液,用磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤细胞1~2 次。通过反复冻融,使细胞破坏并放出细胞内成份。4 ℃,2 500 r/min 离心20 min,弃沉淀、取上清。根据试剂盒说明书,测定细胞内活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)、Fe2+水平。
1.7 双荧光素酶报告基因实验 借助TargetScan7.1(http://www.targetscan.org/vert_71/)网 站用于预测miR-22-3p与PLAGL2的靶向结合位点。含有预测miR-22-3p 结合位点的报告载体pmiRGLO-PLAGL2 野生型质粒(PLAGL2-WT)或miRGLO-PLAGL2突变型质粒(PLAGL2-MUT)。使用Lipofectamine 2 000 进 行miR-22-3p mimic 与PLAGL2质粒共转染,并分为PLAGL2-WT+mirR-22-3p组和PLAGL2-MUT-mirR-22-3p 组。48 h 后,用双萤光素酶报告基因检测系统测定荧光素酶活性。
1.8 Western blot 检测Gpx4 蛋白 使用BCA 试剂盒测定蛋白浓度,再用10% SDA-PAGE 进行电泳,转移至PVDF膜上。室温下使用5%脱脂牛奶封闭2 h后,PVDF 膜与一抗PLAGL2(1∶1000)、Gpx4(1∶1000)或β-actin(1∶10000)4 ℃过夜孵育。TBST 洗膜,使用兔二抗(1∶5000)孵育1 h。TBST洗膜,使用ECL试剂检测蛋白信号。
1.9 统计学方法 采用SPSS 19.0统计学软件进行数据分析。计量资料以均数±标准差()表示。组间计量资料比较采用t检验;计数资料比较采用χ2检验。设P<0.05为差异有统计学意义。
2 结果
2.1 OGD/R诱导H9c2细胞后不同时间的吸光度值比较见表1
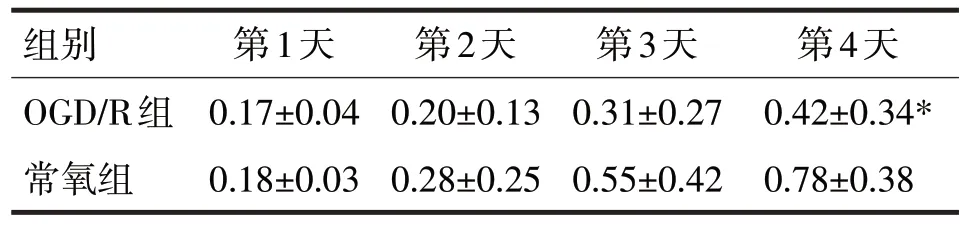
表1 OGD/R诱导H9c2细胞后不同时间的吸光度值比较
由表1 可见,OGD/R 组H9c2 细胞在第1 天、第2 天和第3 天的吸光度值与常氧组比较,差异均无统计学意义(t分别=0.21、0.86、0.25,P均>0.05),OGD/R 组H9c2 细胞在第4 天的吸光度值低于常氧组,差异有统计学意义(t=3.78,P<0.05)。
2.2 OGD/R 诱导H9c2 细胞后ROS、MDA、Fe2+及miR-22-3p水平比较见表2

表2 OGD/R诱导H9c2细胞后ROS、MDA、Fe2+及miR-22-3p水平比较
由表2 可见,OGD/R 组H9c2 细胞ROS 及MDA水平、Fe2+的积累明显高于常氧组,miR-22-3p 水平明显低于常氧组,差异均有统计学意义(t分别=4.24、2.54、4.47、3.53,P均<0.05)。
2.3 Western blot 检测OGD/R 诱导H9c2 细胞后Gpx4蛋白水平见图1

图1 Western blot检测OGD/R诱导H9c2细胞后Gpx4蛋白水平
由图1 可见,Western blot 实验进一步证实,Gpx4蛋白表达在OGD/R组明显降低。
2.4 H9c2细胞中miR-22-3p mimic转染效率 miR-22-3p 组的miR-22-3p 表达水平(3.56±0.43),明显高于OGD/R+miR-NC组(0.23±0.14),差异有统计学意义(t=3.25,P<0.05)。
2.5 H9c2 细胞OGD/R 处理及转染miR-22-3p mimic后吸光度值比较见表3

表3 H9c2细胞OGD/R处理及转染miR-22-3p mimic后吸光度值比较
由表3 可见,各组在第1 天和第2 天间吸光度值比较,差异均无统计学意义(F分别=0.88、0.22,P均>0.05),第3 天和第4 天,OGD/R 组吸光度值高于常氧组,OGD/R+miR-22-3p 组吸光度值高于OGD/R+miR-NC 组,差异均有统计学意义(t分别=2.98、1.97、2.57、2.46,P均<0.05)。
2.6 H9c2 细胞中转染miR-22-3p mimic 后ROS、MDA、Fe2+水平比较见表4
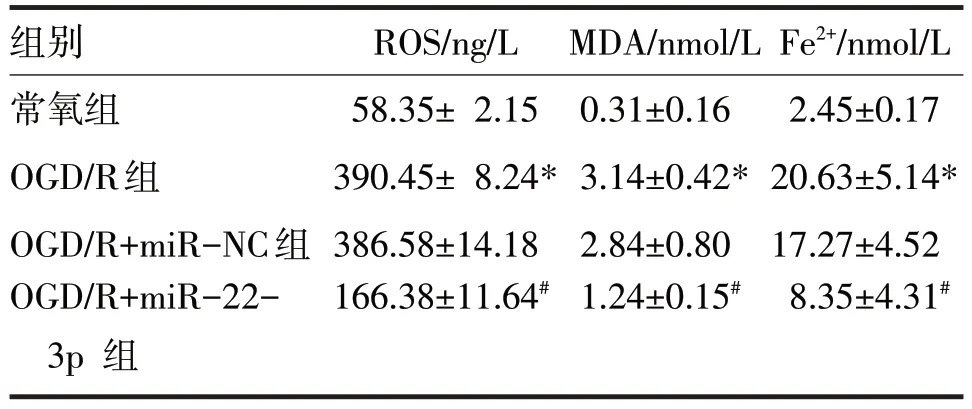
表4 H9c2细胞中转染miR-22-3p mimic后ROS、MDA、Fe2+水平比较
由表4 可见,OGD/R 组H9c2 细胞中MDA、ROS水平、Fe2+的积累明显高于常氧组,差异均有统计学意义(t分别=3.33、2.47、2.03,P均<0.05),而OGD/R+miR-22-3p 组MDA、ROS水平、Fe2+的积累明显低于OGD/R+miR-NC 组,差异均有统计学意义(t分别=2.62、5.35、4.11,P均<0.05)。
2.7 H9c2 细胞中转染miR-22-3p mimic 后Gpx4 表达水平比较见图2
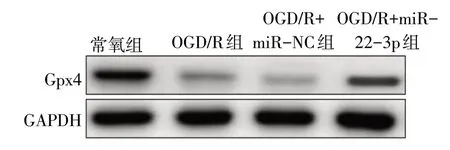
图2 Western blot检测H9c2细胞中Gpx4蛋白表达
由图2 可见,OGD/R 组Gpx4 表达水平下调,而OGD/R+miR-22-3p组Gpx4表达水平显著上调。
2.8 OGD/R 后细胞转染miR-22-3p mimic 和Fer-1处理后吸光度值比较见表5
由表5可见,第1 天和第2 天,各组间吸光度值比较,差异均无统计学意义(F分别=0.04、0.32,P均>0.05)。第3 天和第4 天,OGD/R组吸光度值低于常氧组(t分别=4.66、3.21,P均<0.05),OGD/R+Fer-1 组吸光度值明显高于OGD/R组(t分别=3.12、3.36,P均<0.05)。而OGD/R+Fer-1+miR-22-3p 组吸光度值与OGD/R+Fer-1 组比较,差异均无统计学意义(t分别=0.31、1.06,P均>0.05)。
2.9 OGD/R 后细胞转染miR-22-3p mimic 和Fer-1处理后ROS、MDA、Fe2+水平比较见表6
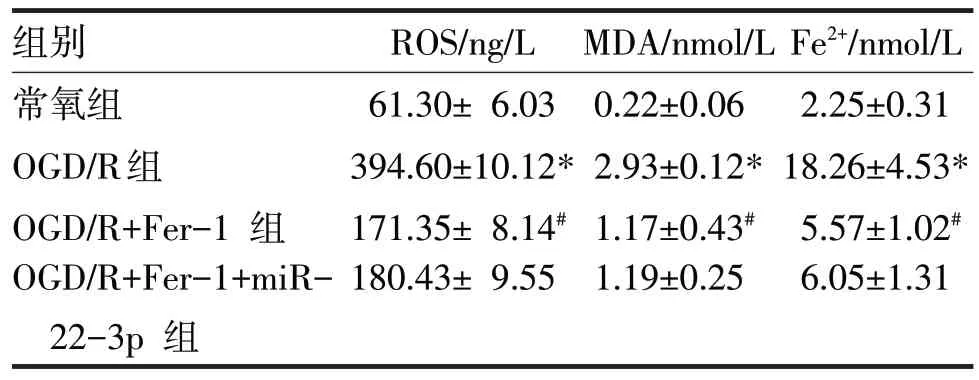
表6 OGD/R后细胞转染miR-22-3p mimic和Fer-1处理后ROS、MDA、Fe2+水平检测
由表6 可见,OGD/R 组H9c2 细胞MDA 及ROS水平、Fe2+的积累明显高于常氧组,差异均有统计学意义(t分别=4.52、3.49、3.39,P均<0.05),GD/R+Fer-1 组逆转下调MDA、ROS 和Fe2+水平(t分别=3.03、5.33、2.48,P均<0.05)。OGD/R+Fer-1+miR-22-3p 组H9c2细胞MDA及ROS水平、Fe2+的积累与OGD/R+Fer-1 组比较,差异均无统计学意义(t分别=0.21、1.18、0.63,P均>0.05)。
2.10 miR-22-3p 对PLAGL2 的表达调控检测见图3

图3 miR-22-3p对PLAGL2的表达调控检测
由图3A 可见,通过Targetscan 靶向关系预测网站发现miR-22-3p 和PLAGL2 存在特异性结合位点。由图3B 可见,H9c2 细胞转染miR-22-3p 组的PLAGL2蛋白表达明显低于miR-NC组。
2.11 miR-22-3p 靶向调控PLAGL2 表达的检测PLAGL2-WT+miR-22-3p 组的荧光素酶活性为(0.95±0.15),明显低于PLAGL2-MUT+miR-22-3p组(0.24±0.05),差异有统计学意义(t=2.69,P<0.05)。
2.12 过表达PLAGL2对Gpx4的表达调控见图4
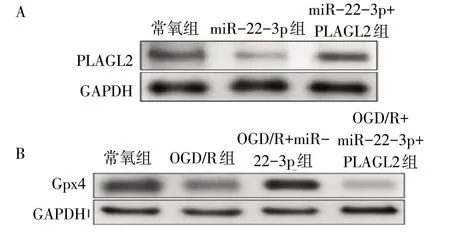
图4 Western blot检测H9c2细胞PLAGL2和Gpx4蛋白表达水平
由图4A、4B 可见,共转染miR-22-3p mimic 和PLAGL2 过表达质粒组细胞中PLAGL2 表达显著高于miR-22-3p转染组,Gpx4表达显著低于miR-22-3p转染组。
2.13 OGD/R 后细胞共转染miR-22-3p mimic 和PLAGL2过表达质粒后吸光度值见表7
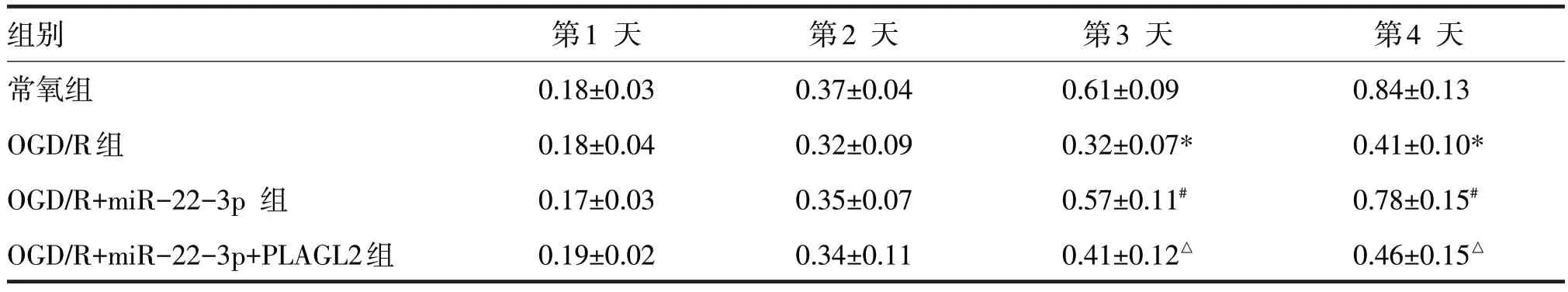
表7 OGD/R后细胞共转染miR-22-3p mimic和PLAGL2过表达质粒后吸光度值
由表7 可见,第1、2 天,各组细胞吸光度值比较,差异均无统计学意义(F分别=0.21、0.12,P均>0.05)。第3、4 天,OGD/R组吸光度值明显高于常氧组,差异均有统计学意义(t分别=6.33、7.18,P均<0.05)。OGD/R+miR-22-3p 组吸光度值明显高于OGD/R 组(t分别=3.11、4.22,P均<0.05),OGD/R+miR-22-3p+PLAGL2 组的吸光度值明显低于OGD/R+miR-22-3p 组,差异均有统计学意义(t分别=3.91、3.12,P均<0.05)。
2.14 OGD/R 后细胞共转染miR-22-3p mimic 和PLAGL2 过表达质粒后ROS、MDA、Fe2+水平比较见表8

表8 OGD/R后细胞共转染miR-22-3p mimic和PLAGL2过表达质粒后ROS、MDA、Fe2+水平
由表8可见,OGD/R组ROS、MDA、Fe2+水平明显高于常氧组(t分别=4.52、3.54、4.01,P均<0.05),OGD/R+miR-22-3p 组MDA 及Fe2+、ROS 水平明显低于OGD/R组(t分别=4.71、4.35、3.05,P均<0.05)。OGD/R+miR-22-3p+PLAGL2组的MDA及Fe2+、ROS水平高于OGD/R+miR-22-3p(t分别=3.74、3.87、3.05,P均<0.05)。
3 讨论
最近的研究表明,I/R 损伤会导致miRNAs 的表达改变,影响心肌细胞的存活和恢复。此外,仍有其它研究指出miR-22-3p 在冠状动脉疾病过程中起作用,可作为诊断冠状动脉疾病的特异性标志物[3]。本次研究揭示miR-22-3p 在体外心肌细胞OGD/R损伤过程起到保护作用,其机制为通过靶向PLAGL2蛋白表达抑制铁死亡。
既往研究已证实铁死亡在心肌病、心肌梗死、缺血再灌注损伤等疾病中发挥重要作用[4]。miRNAs如miR-7-5p、miR-150-5p 和miR-706 等通过调控心肌细胞铁死亡,参与心脏发育、心肌重塑和心力衰竭等生物过程。本次研究发现OGD/R 诱导心肌细胞损伤过程中伴随铁死亡指标MDA 及Fe2+、ROS水平上调,miR-22-3p表达水平降低。Gpx4在阻断铁死亡过程中起主要作用,本次研究发现OGD/R可诱导心肌细胞中Gpx4 表达下调。进一步的研究结果发现,过表达miR-22-3p下调了OGD/R诱导的心肌细胞MDA 及Fe2+、ROS 水平,提高心肌细胞活力,上调Gpx4 表达,而铁死亡抑制剂Fer-1 对过表达miR-22-3p后H9c2细胞活力及铁死亡无明显影响,提示miR-22-3p 对心肌细胞OGD/R 损伤的保护功效被Fer-1 阻断,miR-22-3p 对心肌细胞OGD/R 损伤的保护机制依赖于降低铁死亡。Cao 等[5]发现miR-22在OGD/R 诱导的大鼠神经干细胞中表达降低,而过表达miR-22 可减轻OGD/R 诱导的神经干细胞损伤。Yuan等[6]揭示心肌梗死患者心肌细胞中过表达miR-22-3p 能够抑制肿瘤细胞铁死亡。这些研究可一定程度上也支持本次研究结论,证实了miR-22-3p 通过抑制铁死亡保护心肌细胞I/R 损伤的作用。
PLAGL2 是一类源自于PLAG 基因家族的锌脂蛋白,也是一种细胞核转录因子,可参与调控多种基因表达,已被报道在多种肿瘤进展中发挥重要作用[7],然而在I/R 损伤中鲜有研究。本次研究通过Targetscan 预测发现PLAGL2 和miR-22-3p 存在特异性结合位点,且过表达miR-22-3p显著降低H9c2细胞中PLAGL2蛋白水平。双荧光素酶报告实验显示过表达miR-22-3p显著降低PLAGL2-WT的荧光素酶活性,而对PLAGL2-MUT的荧光素酶活性无明显影响,证实miR-22-3p 与PLAGL2 可直接结合。这些结果提示miR-22-3p通过靶向结合PLAGL2负调控其表达。此外,本次研究结果还显示,PLAGL2过表达可明显逆转miR-22-3p 过表达诱导的H9c2细胞活力增加,MDA 及Fe2+、ROS 水平抑制和Gpx4表达上调,提示PLAGL2参与心肌I/R损伤后细胞活力和铁死亡的调控,miR-22-3p 对心肌细胞损伤保护功效可能是通过靶向负调控PLAGL2蛋白表达来完成。Fan等[8]研究显示,miR-22-3p可通过靶向调控PLAGL2表达抑制乳腺癌细胞迁移和侵袭。在心肌I/R损伤过程中,miR-22-3p与PLAGL2存在调控关系,即miR-22-3p 可通过靶向调控PLAGL2 表达进而抑制铁死亡保护心肌I/R损伤。
综上所述,本次研究结果证实了miR-22-3p 靶向调控PLAGL2 蛋白表达抑制铁死亡,从而保护OGD/R诱导的心肌细胞损伤,为开发新的临床治疗提供研究方向。本次研究缺乏体内实验,因此需要后续开展动物研究进一步确证miR-22-3p 对心肌缺血保护的分子机制。然而,本次研究只在体外细胞模型中探究miR-22-3p 对心肌细胞的保护作用,不能完全模拟人体心肌I/R 损伤。因此需要继续开展动物或原代心肌细胞实验,以进一步确证miR-22-3p对心肌缺血保护的功效及分子机制。

