海岛妇女早期复发性流产HO-1、MCP-1、NF-κB 的表达及意义
孙琼瑛 邬贤凤 罗慧琴
早期复发性流产(early recurrent spontaneous abortion,ERSA)病因非常复杂,目前的主流研究认为自身免疫失衡导致母体对胎盘产生排斥反应是关键因素,因此母胎界面的某些免疫因子与ERSA的关系引发关注[1,2]。血红素加氧酶-1(heme oxygenase,HO-1)属微粒体酶,其产生是机体对非正常状态刺激的一种反应[3]。研究发现从胚胎植入到分娩整个妊娠过程中单核细胞趋化因子-1(monocyte chemotactic protein-1,MCP-1)均发挥重要作用,而核转录因子(nuclear factor-kappa B,NF-κB)则是TLR 下游信号通路里的一种核转录因子,参与胚胎早期发育及着床过程[4,5]。本次研究对HO-1、MCP-1和NF-κB 在ERSA 患者中的表达进行分析,探讨它们在ERSA发生过程中的作用。现报道如下。
1 资料与方法
1.1 一般资料 选取2019年5 月至2021年5 月浙江省舟山医院收治的30 例ERSA 患者纳入ERSA组,30 例正常妊娠期因非计划妊娠要求终止而就诊的患者纳入对照组。ERSA 组患者需满足ERSA 诊断标准,即既往有两次或以上无诱因自然流产史,就诊时B 超确诊胚胎停育[6];同时子宫解剖结构正常,抗心磷脂抗体阴性,无TORCH 感染和生殖道感染,甲状腺功能、凝血功能无异常,近期生活中未发生重大事件[7]。对照组需要满足子宫及附件的检查正常,入组前已有一次或以上正常妊娠史,且既往无病理学流产史。所有患者均签署知情同意书,本次研究已获得医院伦理委员会批准,ERSA组和对照组年龄、体重指数、流产孕周、孕次、产次、收缩压和舒张压等一般资料见表1。两组比较,差异均无统计学意义(P均>0.05)。
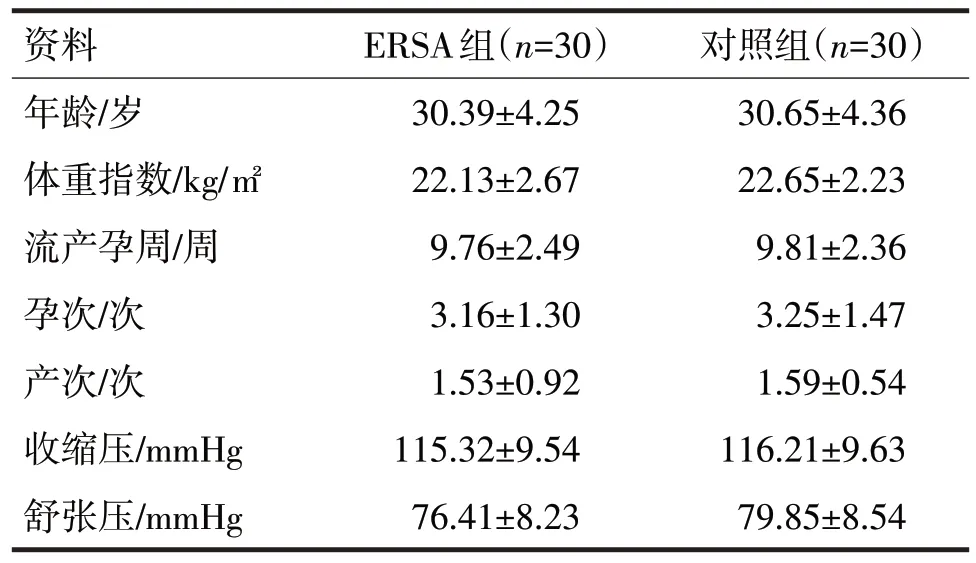
表1 两组一般资料比较
1.2 方法 人工流产术后,分离孕囊的绒毛和蜕膜组织,生理盐水清洗后浸泡在10%福尔马林中。石蜡包埋,切片备用。
1.2.1 绒毛蜕膜组织中HO-1、MCP-1、NF-κB mRNA的表达 采用qPCR法检测,从组织中抽提总RNA,取适量组织样本加入1 ml Trizol(由Takara 生产),分离核酸蛋白复合物,加入250 μl 氯仿,剧烈震荡EP 管,静置3~5 min 后离心(12 000 r/min,15 min),将上层RNA 移至新的EP 管沉淀RNA,再次离心10 min。收集RNA沉淀,去除上清,用5%乙醇洗涤两次,离心5 min风干,加入适量DEPC水,溶解沉淀,将RNA 反转录为cDNA。设计RT-qPCR 引物(见表2)。调配合适的引物退火温度和模板量进行预实验。使用2×SYBR Green Mix 配制qPCR Mix,按照实际检测的样品数和重复量,调配适当的qPCR Mix。分装至AXYGEN qPCR8 连管,微型离心机瞬时离心混匀qPCR 体系。将上述样品放入IQ5 荧光定量qPCR 仪,SYBR Green 法荧光定量qPCR以分析各基因的表达。采用2-△△Ct法进行各基因表达的相对定量。
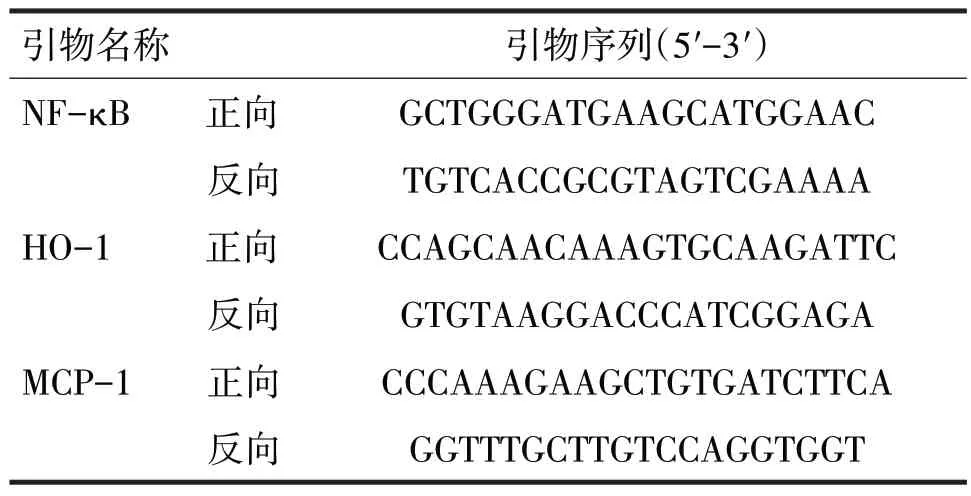
表2 RT-qPCR检测引物信息
1.2.2 绒毛蜕膜组织中HO-1、MCP-1、NF-κB 蛋白的表达 采用Western blot 检测:将组织称重后粉碎,加入RIPA缓冲液和PMSF,4 ℃下1 500 r/min匀浆,加入PMSF,冰上孵育,离心。取上清液保存,进行Bradford 比色法进行蛋白质定量检测。SDSPAGE 电泳,将蛋白凝胶中的蛋白通过电流作用转移到转印膜上。转膜结束后,先用笔标记marker,再将NC膜置于立春红染色液中,室温5~10 min即可见红色条带,用洗涤缓冲液洗数次后洗掉红色条带,拍照,根据marker 剪膜。封闭杂交膜,首先孵育一抗,4 ℃孵育过夜或(22 ℃~25 ℃)摇动孵育2 h。用1×PBST/TBST 液洗膜3 次×10 min,孵育二抗,4 ℃孵育2 h 或室温(22 ℃~25 ℃)摇动孵育1 h。显影,以目的蛋白与β-actin的积分吸光度比值检测结果。
1.3 统计学方法 采用SPSS 18.0统计学软件进行数据分析。计量资料以均数±标准差()表示。组间计量资料比较采用t检验;计数资料比较采用χ2检验。诊断效能以受试者工作特征(receiver operating characteristic,ROC)曲线研究。设P<0.05 为差异有统计学意义。
2 结果
2.1 两组绒毛蜕膜组织中HO-1、MCP-1、NF-κB mRNA水平见表3

表3 两组绒毛蜕膜组织中HO-1、MCP-1、NF-κB mRNA比较
由表3 可见,ERSA 组绒毛蜕膜组织中HO-1 mRNA、MCP-1mRNA、NF-κB mRNA 水平均高于对照组,差异均有统计学意义(t分别=43.22、43.43、8.28,P均<0.05)。
2.2 两组绒毛蜕膜组织中HO-1、MCP-1、NF-κB蛋白表达比较见表4
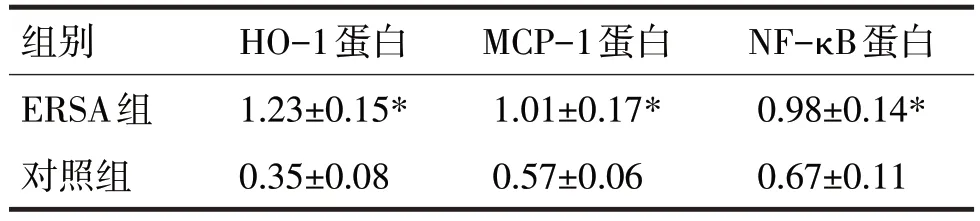
表4 两组绒毛蜕膜组织中HO-1、MCP-1、NF-κB 蛋白表达比较
由表4 可见,ERSA 组绒毛蜕膜组织中HO-1、MCP-1、NF-κB 蛋白的表达均高于对照组,差异均有统计学意义(t分别=28.35、13.37、9.54,P均<0.05)。
2.3 绒毛蜕膜组织中HO-1、MCP-1、NF-κB mRNA水平预测ERSA的价值分析见表5
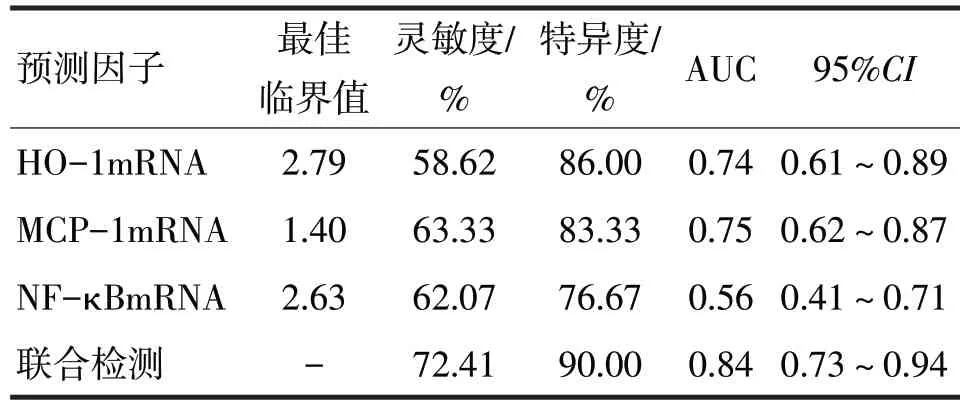
表5 绒毛蜕膜组织中HO-1、MCP-1、NF-κB mRNA水平预测ERSA的价值分析
由表5 可见,绒毛蜕膜组织中HO-1mRNA、MCP-1mRNA、NF-κB mRNA 水平联合检测ERSA的灵敏度和特异度最高,分别为72.41%和90.00%,AUC为0.84。
2.4 绒毛蜕膜组织中HO-1、MCP-1、NF-κB蛋白表达情况预测ERSA的价值分析见表6

表6 绒毛蜕膜组织中HO-1、MCP-1、NF-κB蛋白表达情况预测ERSA的价值分析
由表6可见,绒毛蜕膜组织中HO-1蛋白、MCP-1蛋白、NF-κB 蛋白水平联合检测ERSA 的灵敏度和特异度最高,分别为86.67%和86.66%,AUC为0.85。
3 讨论
在妊娠进程中,胎儿的生长发育依赖母体与胎盘间的血液循环[8,9]。因此血管的形成是胚胎着床与妊娠成功的基础,而研究认为胎盘血管发育不良和内皮功能障碍也是诱导ERSA发生的重要原因[10,11]。
本次研究结果显示,ERSA组HO-1 mRNA和蛋白水平均高于对照组(P均<0.05),表明HO-1 与ERSA 的发病间存在显著相关性。HO-1 基因表达的调控主要发生在转录水平,而HO-1 蛋白主要存在于胎盘滋养细胞与绒毛间质[12]。HO-1 参与胎盘血管化,并能通过调节平滑肌细胞的收缩调节血管张力,维持母体与胎盘、胎儿间的循环[13]。同时其可阻止游离血红素参与氧化反应,具有抗氧化功能。而机体在多种因素刺激下均可诱导HO-1 的表达,包括热休克、缺血、缺氧、氧化应激过氧亚硝基和细胞运转障碍等等。多项体内外研究证实,HO-1 表达下调或缺失可加速脂质在血管壁的沉积,导致更多的泡沫细胞形成,造成内皮功能障碍[14]。
本次研究结果显示,ERSA 组MCP-1mRNA 和蛋白表达均高于对照组(P均<0.05),表明MCP-1与ERSA 的发病间存在显著相关性。与陈慧等[15]研究结果基本一致。在妊娠期中,母体血进入绒毛间隙后绒毛组织由低灌注低氧环境向高灌注高氧环境转变,导致细胞内会形成大量活性氧。若氧化自由基剧增,即可诱发严重氧化应激反应,导致ERSA。MCP-1 正是与氧化应激和炎症反应相关的因子[16,17]。人MCP-1基因定位于17号染色体,在子宫内膜、蜕膜、绒毛膜和胎盘中均有表达,一般情况下,将在母体激素分泌调控下与其受体相结合,促进胚胎植入子宫内膜。而过高的MCP-1 水平有极大可能激活单核巨噬细胞,使之分泌前列腺素E2,引起宫缩增加,导致流产。
正常情况下,NF-κB 存在于胞浆内,由p65 和p50 组成,与抑制因子IκB-a 和IκB-b 相互结合,对相关的靶基因进行调控。当细胞受到氧化反应等刺激,IκB 磷酸化,NF-κB 激活并进入细胞核,与靶基因结合后产生大量的炎症介质,引起炎症反应爆发[18]。并且基因的产物也会刺激大量NF-κB 生成,加重病变部位炎症反应。本次研究结果显示,ERSA组NF-κB mRNA 和蛋白表达均高于对照组(P均<0.05),表明NF-κB与ERSA的发病间存在显著相关性。冯晓玲等[19]研究也证实了NF-κB 在抗心磷脂抗体阳性复发性流产患者的蜕膜、血清中表达比正常孕妇显著升高,认为其可能参与了血栓、炎性进程,并与流产发生相关。
既往鲜有研究分析HO-1、MCP-1、NF-κB 表达变化在ERSA中的临床意义,在验证ERSA患者绒毛蜕膜组织中的HO-1、MCP-1、NF-κB 表达异常后,本次研究进一步利用ROC 曲线分析了三者的临床意义。结果显示,三种指标联合检测灵敏度、特异度和AUC最高,表明联合检测三种指标能够提高诊断效能。
综上所述,ERSA患者绒毛蜕膜组织中的HO-1、MCP-1、NF-κB 表达与正常妊娠妇女存在明显差异,其可作为预测ERSA发生的重要因子,且三者联合检测诊断效能更高。

