红豆杉根际益生菌的筛选及其抗病促生作用研究
郑文格,黄立明,刘婉煜,陈 莹,张 华,赵春芳,2,余龙江,2,付春华,2*
(1.华中科技大学 生命科学与技术学院/资源生物学与生物技术研究所,湖北 武汉 430074;2.华中科技大学 分子生物物理教育部重点实验室,湖北 武汉 430074)
紫杉醇是世界公认的高效低毒类治疗肿瘤的有效药物,在临床上广泛应用于乳腺癌、卵巢癌等恶性肿瘤的治疗[1],但目前紫杉醇原料药的产量远远不能满足癌症患者的需求,市场上供不应求[2]。目前,紫杉醇主要从红豆杉属(Taxus)植物的针叶中直接提取,或者从针叶中提取前体物质后进行化学半合成获得。为了缓解紫杉醇原料药的短缺问题及保护野生红豆杉资源,国内多地已经建立了红豆杉人工种植基地。在红豆杉人工种植过程中,炭疽病是其幼苗普遍发生的病害之一,主要由胶孢炭疽菌(Colletotrichumgloeosporioides)引起,在拱棚或者大棚里发病更严重,发病率为15%~30%,导致扦插苗干枯坏死,给农户和企业造成严重经济损失[3-4]。
目前,化学杀菌剂仍然是防治炭疽病的主要策略[5],但化学杀菌剂中一些化学物质对人类的健康构成潜在风险[6],同时滥用农药会减少土壤中有益菌的数量,造成土壤养分流失[7-8],除此之外,由于农药的不规范使用,部分病原菌呈现出抗药性[9]。以上问题使得部分化学农药逐渐退出市场,促使人们寻找更为安全可靠的病害防治方法。
生物防治是一种很有前景的病害防治策略,它是指利用一种生物防治另一种生物的方法。例如利用拮抗微生物对植物病原菌进行抑制,使其数量减少或者破坏性降低[10],既能达到抑制病原菌的效果,又不会破坏生物多样性,以及造成环境污染。自然界中有很多微生物对病原菌有显著抑制作用,被用于作物病害的生物防治,如芽孢杆菌、假单胞菌、链霉菌等[11-14]。目前已有多种生物防治剂上市[15-16],但有关红豆杉炭疽病的生物防治研究未见报道。
在多种具有开发为生物防治剂潜力的微生物中,根际益生菌由于兼具防病与促生的双重作用被人们普遍关注,如Bashan等[17]发现根际益生菌能够防治番茄叶面细菌性斑点病,并改善植物的生长;Tortora等[18]发现根际益生菌能够通过提高寄主的抗性从而减轻草莓炭疽病的发病症状;而红豆杉幼苗容易感染炭疽病的原因之一就是抵抗力较低,因此,通过根际益生菌对红豆杉炭疽病进行防治是一种可行且具可持续发展优势的策略。
磷是植物正常生长所需的一种重要营养元素之一,土壤中的磷大部分是以不溶的形式存在,不能被植物有效吸收利用[19],一些促生菌能够通过释放有机酸或分泌胞外磷酸酶等途径释放土壤中的不溶性磷,从而使植物更加有效地利用土壤中的磷元素,促进自身生长。IAA(吲哚-3-乙酸)是天然存在于植物中最具生理活性的生长素之一,适宜浓度的IAA能够诱导植物侧根和不定根的形成,提高根毛数量,从而使植物更有效地吸收土壤中的水分和养分[20-21]。铁是一种微量营养元素,它对植物的一些生理活动至关重要,缺铁会导致植物黄化、代谢活性和生物量降低;嗜铁素是微生物在低铁条件分泌的一类高度专一的铁螯合因子,与环境中的Fe3+结合形成稳定的铁载体-铁复合物,此复合物通过与细胞膜上相应的特异受体结合将铁运输到胞内,从而满足生物体对铁的需求[22]。而根际益生菌一般都兼具一种或多种促生能力(包括溶磷、产IAA和分泌嗜铁素等)。
本研究以红豆杉炭疽病菌为靶标菌,从健康红豆杉根际土壤中分离筛选拮抗微生物,并通过平板对峙试验以及盆栽防病试验评估其拮抗能力,同时通过溶磷、产IAA和分泌嗜铁素等试验以及红豆杉枝条扦插生根试验探究其对红豆杉的促生作用,以期为红豆杉炭疽病的生物防治提供试验依据和优良的益生菌株。
1 材料和方法
1.1 试验材料
健康曼地亚红豆杉根际土壤、5月龄红豆杉盆栽苗,均取自湖北省孝感市湖北邓家河庄园股份有限公司红豆杉种植基地。
靶标菌:胶孢炭疽菌(Colletotrichumgloeosporioides)由发病的曼地亚红豆杉叶片中分离获得。
1.2 红豆杉根际微生物的分离纯化
参照崔晓双[23]的方法稍作改动:制备健康曼地亚红豆杉根际土壤悬浮液,用无菌生理盐水进行梯度稀释,分别吸取200 μL稀释梯度为10-5、10-6、10-7的悬液涂布于LB培养基上,28 ℃恒温培养箱培养1~2 d,挑取培养基中生长旺盛、形态不同的菌落进行划线纯化。
1.3 炭疽病原菌拮抗菌的筛选
1.3.1炭疽病原菌拮抗菌初筛
参照吕婷[24]的方法稍作改动:用打孔器取直径为6 mm的病原菌菌饼置于PDA平板中央,将细菌悬浮液点接在距平板中央3 cm处的4个点上,28 ℃恒温培养5 d,选择能够抑制病原菌生长的菌株作为复筛对象。
1.3.2炭疽病原菌拮抗菌复筛
参照Niu等[25]的方法稍作改动:用打孔器取直径为6 mm的菌饼放置在距PDA平板边缘2 cm处,取10 μL活化菌液于平板中间划线,大肠杆菌DH5α作为对照。生长7 d后,记录病原菌菌落半径,并计算抑菌率。试验重复3次。

1.4 拮抗菌16S rDNA序列系统发育分析
利用天根细菌基因组DNA提取试剂盒提取菌株基因组DNA。以提取的总DNA为模板,使用通用引物27F、1492R对菌株的16S rDNA基因进行PCR扩增(表1)。将扩增序列连接到T载体后转入大肠杆菌DH5α,利用通用引物M13F(-47)和M13R(-48)(表1)扩增验证,阳性单克隆送武汉奥科有限公司测序。
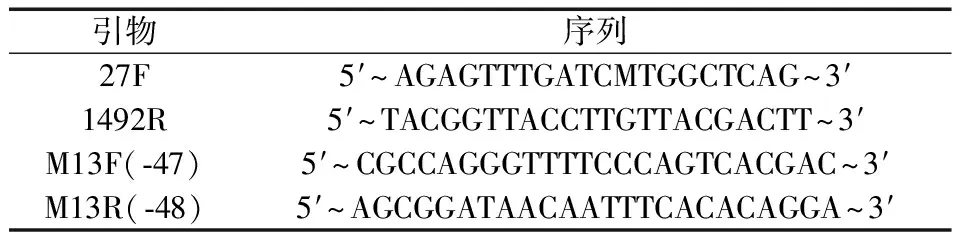
表1 通用引物序列
将16S rDNA序列上传至Ezbiocloud数据库(www.ezbiocloud.net)进行比对分析[26],下载亲缘关系较近的模式菌株的16S rDNA基因序列,通过MEGA7.0将待鉴定菌株与模式菌株的16S rDNA基因序列校正对齐后用邻近连接法(Neighbour-joining,NJ)构建系统发育进化树。
1.5 拮抗菌对红豆杉炭疽病的防效评价
使用5月龄红豆杉盆栽扦插苗,采用喷雾法进行防效评价[27]:按1%的接种量将活化好的拮抗菌接种于50 mL LB液体培养基,28 ℃、180 r/min振荡培养12 h。将菌液稀释至浓度为1×1010个/mL,制成拮抗菌悬浮液。挑取病原菌的菌丝接种于50 mL PDA液体培养基,28 ℃、180 r/min振荡培养2 d,制备病原菌悬浮液,分生孢子浓度为1×106个/mL。其中分生孢子数采用血球计数板计数,拮抗菌浓度利用分光光度计来测定。
设置LB液体培养基组、拮抗菌悬浮液组、40%苯醚甲环唑悬浮剂4000倍液组等3组,每株5 mL,分别喷雾接种于红豆杉苗地上部分。24 h后将病原菌悬浮液喷施于上述3组不同处理的植株上。每组处理30株扦插苗。人工培养室条件设定为光周期12 h/12 h(白天/夜晚),空气相对湿度85%,温度27~30 ℃。培养15 d后调查发病情况。参照炭疽病病害分级(表2)计算病情指数和防治效果[28],计算公式如下:

表2 炭疽病病情的分级标准


1.6 拮抗菌促生能力的测定
溶磷能力采用钼锑抗比色法[29]进行测定;IAA(吲哚乙酸)分泌能力采用Salkowski Reagent比色法[30]进行测定;产嗜铁素能力采用CAS平板法[31-32]进行测定。
1.7 拮抗菌对红豆杉枝条扦插生根的促生作用
将拮抗菌菌液OD600值调为0.5备用。选取生长健壮、无病虫害的红豆杉枝条,剪取10 cm左右1~2 a生半木质化(绿色或黄绿色)插条,直径3 mm左右;去掉枝条下端大约1/3的叶片,分为5组(每组10根枝条),分别将枝条基部浸泡到清水、生根粉溶液(200 mg/L)、MK18菌液、MK128菌液,以及MK18和MK128混合菌液中,浸泡2 h,菌液浓度均为1×1010个/mL;浸泡后将枝条插入清水中,深度3~4 cm;初期用小喷壶叶面喷水,温室内平均气温23~26 ℃,平均相对湿度50%。6个月后统计生根数量和根长。
1.8 数据处理
使用Excel 2019对数据进行处理,利用Origin 2021进行绘图。
2 结果与分析
2.1 根际微生物的分离纯化与拮抗菌的筛选
从健康红豆杉根际土壤中共分离得到100余株可培养菌株,通过平板对峙试验筛选拮抗菌(图1)。结果表明,不同拮抗菌的菌落大小有明显差异,菌落比较大的菌株看起来像是减小了病原菌的半径,但随着培养时间延长,病原菌的菌丝就会越过菌落继续生长,因此,该种拮抗菌并未真正抑制病原菌。而菌落比较小的菌株如17号菌株不接触病原菌即能抑制菌丝的生长,可能是因为菌株分泌了抗菌物质,抗菌物质通过培养基扩散从而持续抑制病原菌的生长。共有5株菌能够显著抑制病原菌的生长,编号分别为17、44、30、128、18。
注:图中数字表示菌株编号。
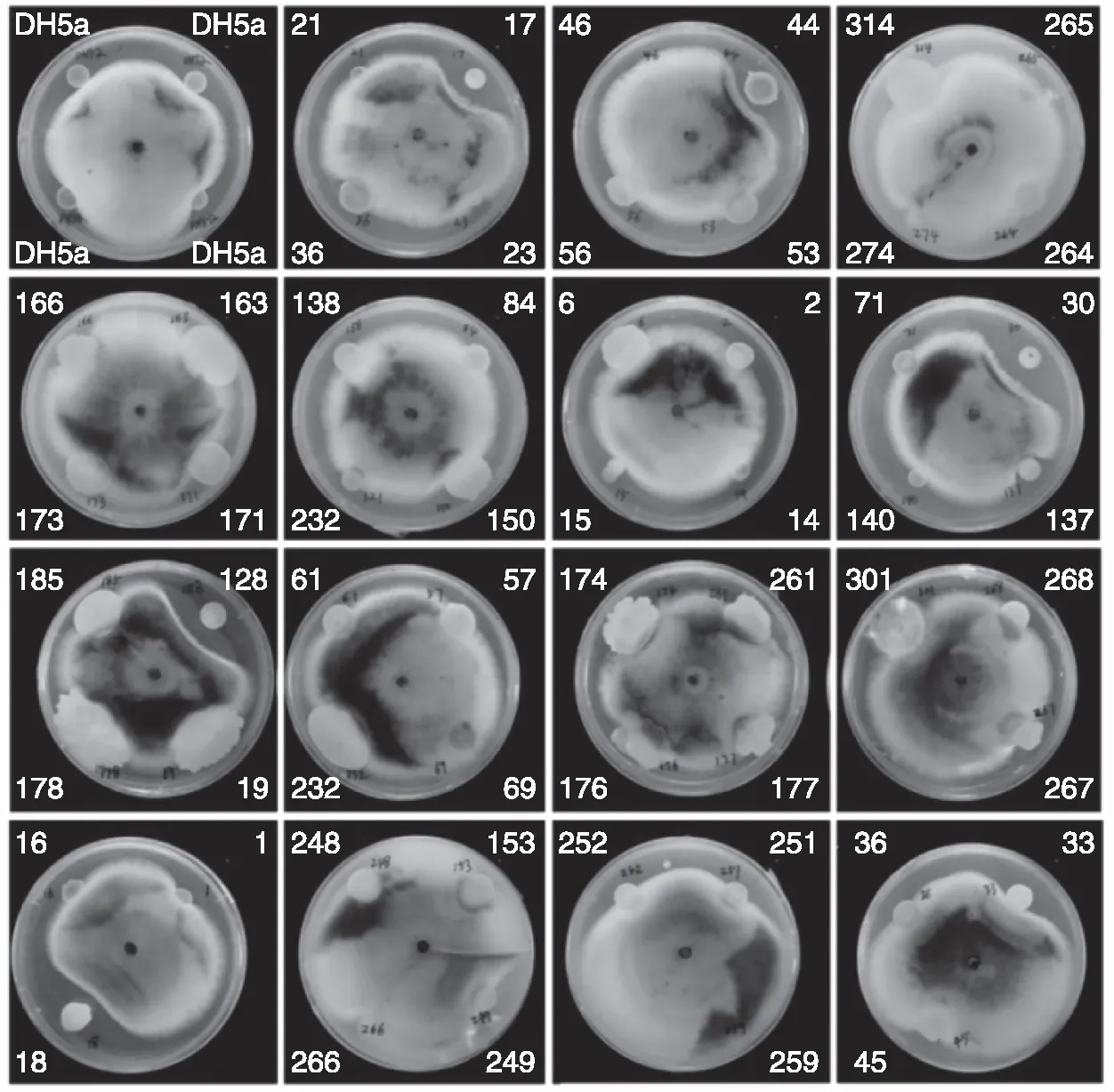
为了消除菌株通过“物理屏障”作用短暂阻挡病原菌生长的可能,本试验用DH5α作为对照,对上述5株菌的拮抗作用进一步复筛验证。结果表明,菌株18、17、30、128能够显著抑制病原菌的生长(图2-a),抑菌率分别为39.22%、47.06%、56.86%、56.86%(图2-b),将上述4株菌分别命名为MK18、MK17、MK30、MK128。
注:*表示显著差异(P<0.05);**表示极显著差异(P<0.01);ns表示无显著差异(P>0.05)。
2.2 拮抗菌16S rDNA基因系统发育分析
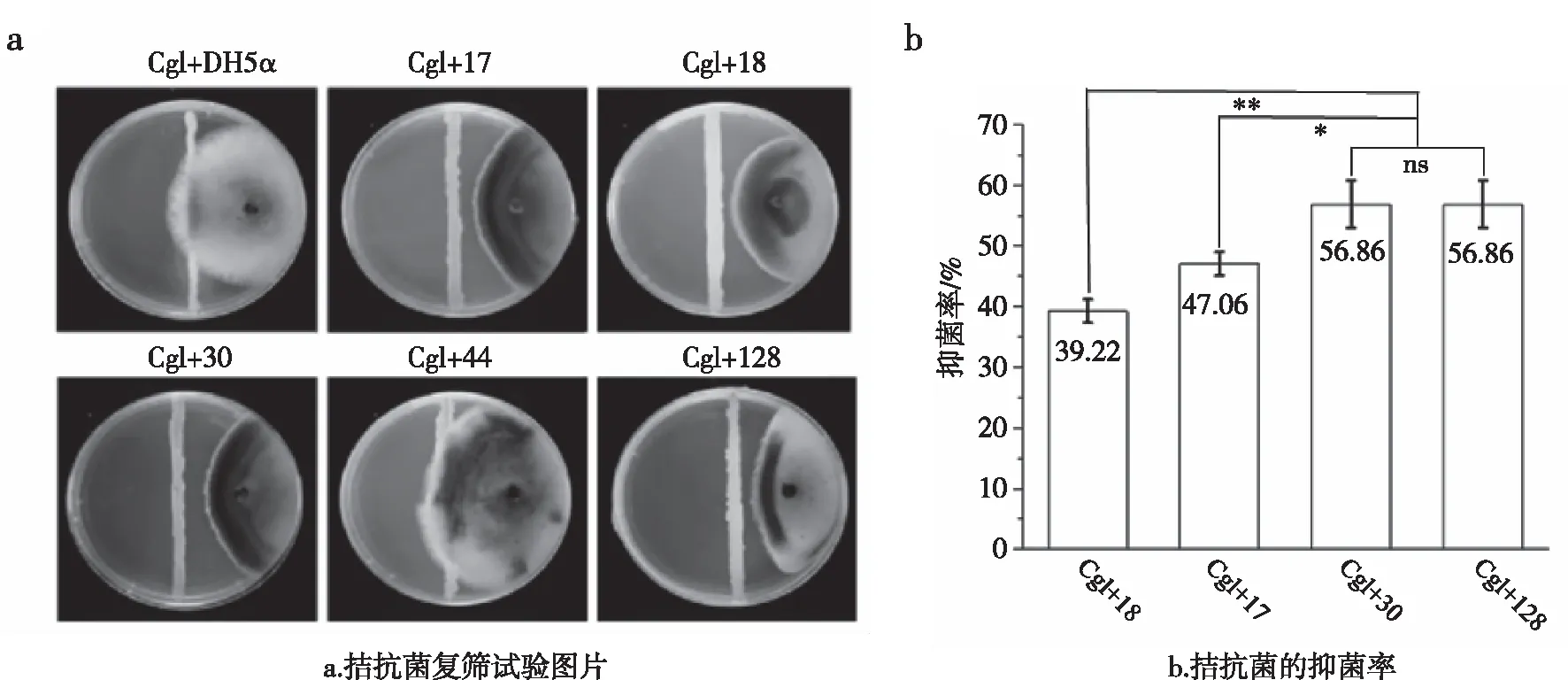
利用4株菌的16S rDNA基因序列进行NJ系统发育树构建,发现MK17与Burkholderiastabilis聚为一支,鉴定MK17为稳定伯克霍尔德菌(Burkholderiastabilis);MK30和MK128与Burkholderiapyrrocinia聚为一支,鉴定MK30与MK128为吡咯伯克霍尔德氏菌(Burkholderiapyrrocinia)(图3);MK18与Paraburkholderiacaffeinilytica聚为一支,鉴定MK18为耐咖啡因副伯克霍尔德氏菌(Paraburkholderiacaffeinilytica)(图4)。

图3 菌株MK30、MK17、M128与近缘种16S rDNA基因序列构建NJ系统发育树
图4 菌株MK18与近缘种16S rDNA基因序列构建NJ系统发育树
2.3 拮抗菌对红豆杉炭疽病的防效评价
分别考察了拮抗菌单独或者联合不同添加剂对红豆杉炭疽病的防治效果。与只喷施病原菌悬浮液相比,喷施MK18、MK30、MK128、MK17以及化学杀菌剂苯醚甲环唑均能显著降低炭疽病的病情指数(图5-a,5-b),防治率分别为29.42%、30.89%、30.89%、36.77%和64.71%(图5-c)。并且,MK128菌液中分别加入阿拉伯胶(GA)、吐温-20(T20)、抗坏血酸(VC)以及三者混合加入后,红豆杉炭疽病的病情指数进一步降低(图5-d),防治率依次达到了54.41%、55.88%、55.88%和63.24%,3种添加剂同时使用时,其防治效果与苯醚甲环唑相当(图5-e)。
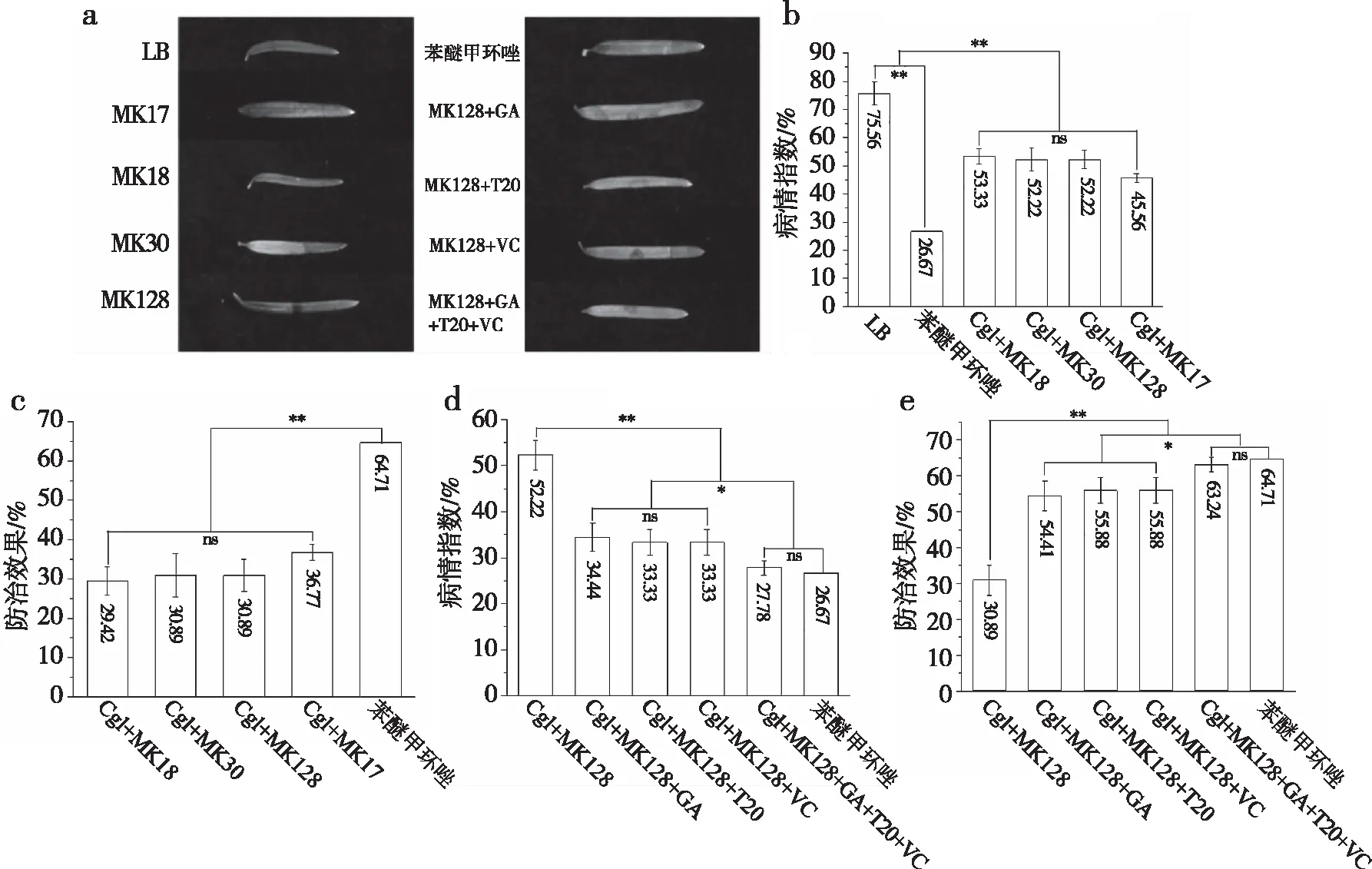
注:a.拮抗菌对炭疽病的防效表现;b.不同拮抗菌处理后炭疽病病情指数;c.不同拮抗菌处理炭疽病防治效果;d.MK128菌液中加入不同添加剂处理后炭疽病病情指数;e.MK128菌液中加入不同添加剂对炭疽病防治效果;GA为阿拉伯胶;VC为抗坏血酸;T20为吐温-20;*表示显著差异(P<0.05);**表示极显著差异(P<0.01);ns表示无显著差异(P>0.05)。
2.4 拮抗菌促生潜能评价
采用钼锑抗比色法检测菌株发酵液中有效磷含量,菌株溶磷能力越强,发酵液中有效磷含量越高。溶磷活性测定试验结果表明,4株拮抗菌株均具有良好的溶磷能力(表3),其中菌株MK128溶磷能力最强,溶磷量为6.16±0.09 mg/L。在产IAA试验中,4株拮抗菌株在与比色液结合后有2株呈现出不同深度的红色,表明这2株菌株具有分泌IAA的能力,红色越深表示分泌IAA的能力越强;其中菌株MK18分泌IAA的量可达21.03±0.20 mg/L(表3)。CAS平板培养试验结果表明,菌株MK128分泌嗜铁素的能力最强,D/d值为2.45±0.03(表3)。

表3 拮抗菌促生能力评价
2.5 拮抗菌MK18和MK128对红豆杉枝条扦插生根的促生评价
分别考察了4株拮抗菌单独处理红豆杉插条后的促生效果,结果表明,相对生根粉处理,MK18和MK128单独及联合处理均能显著促进红豆杉插条生根(图6),且双菌联合处理促生效果最优,平均根长达到了5.75 cm,而MK128在促进根的生长方面有一定优势(表4)。因此,本研究获得了2株对红豆杉生长有促进作用的益生菌。

图6 M18和MK128对红豆杉枝条的促生根效果
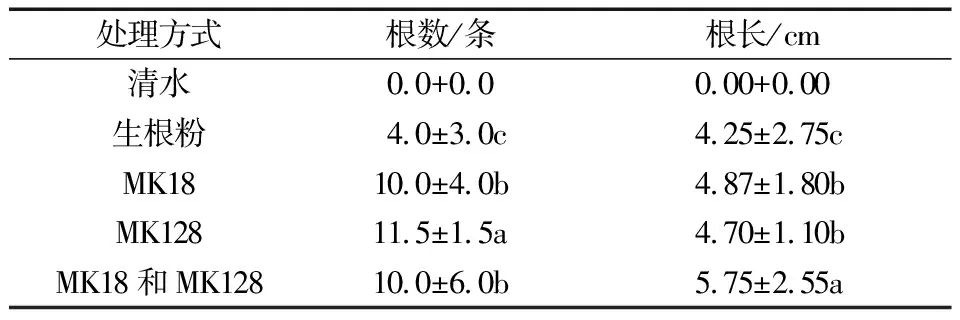
表4 M18和MK128对红豆杉枝条的促生根效果评价
3 结论与讨论
本文以胶孢炭疽菌(Colletotrichumgloeosporioides)为靶标菌,通过平板对峙从健康曼地亚红豆杉根际土壤中筛选出4株拮抗效果明显的菌株(MK17、MK18、MK30和MK128),抑菌率均在39%以上,其中MK30和MK128抑菌率最高,达到了56.86%。在室内盆栽防效试验中,4株拮抗菌对红豆杉炭疽病均具有一定的防治作用。有研究[33-34]发现,粘合剂阿拉伯树胶在溶液中可起到增稠、稳定、保水等作用,可提高菌株的定殖率;抗坏血酸能清除自由基,可防止菌株及菌液中物质的过氧化;乳化剂吐温-20能够提高溶液的湿润度,可保持乳液的均匀悬浮和稳定性。因此,本研究在MK128中加入阿拉伯胶、吐温-20和抗坏血酸,防治效果得到了大幅提升,达到了63.24%,防治效果与苯醚甲环唑相当。同时,在溶磷、产IAA、分泌嗜铁素等试验中,4株拮抗菌均表现出一种及以上的促生活性,其中MK128同时具有溶磷和分泌嗜铁素能力,且均最强,MK18分泌IAA能力最强。在红豆杉插条水培生根试验中,MK18和MK128分别处理以及联合处理均能显著促进红豆杉插条生根,平均生根数以及平均根长分别是生根粉处理的2.64~3.14倍以及1.19~1.42倍。以上研究结果表明,菌株MK18和MK128均具有拮抗与促生双重作用,可作为红豆杉炭疽病生物防治潜在的益生菌株。
MK17、MK30和MK128均为伯克霍尔德菌属(Burkholderia)成员,伯克霍尔德菌具有多种促进植物生长的作用机制,如固氮、解磷,产IAA、分泌嗜铁素等;此外,该属有多个种被报道对植物病原菌有抑制作用,不仅可以通过拮抗作用降低病原体的活性,还可以诱导植物进行自我防御[35]。MK18为副伯克霍尔德菌属(Paraburkholderia)成员之一,该属也有多种菌被证实为植物有益菌,如Hane等[36]报道吩嗪副伯克霍尔德菌(Paraburkholderiaphenazinium)能够促进硬叶葱草幼苗的生长,并且发现结构类似于IAA的主要代谢产物吩嗪-1-羧酸可能发挥着主要作用。伯克霍尔德菌属与副伯克霍尔德菌属均属于变形菌门(Proteobacteria)、β变形菌纲(Betaproteobacteria)、伯克氏菌目(Burkholderiales)、伯克氏菌科(Burkholderiaceae)的成员,Wang等[37]对伯克霍尔德菌属和副伯克霍尔德菌属进行了基因组分析,在这两个属的促生菌成员中都发现了与固氮、生长素合成相关的基因。副伯克霍尔德菌属除了具有促进植物生长的能力外,也能诱导植物抵抗生物和非生物胁迫[38]。红豆杉幼苗易感染炭疽病的原因之一就是抵抗力不足,而本试验筛选的菌株MK18和MK128不仅能直接抑制病原菌的生长,还具有分泌IAA或溶磷和分泌嗜铁素的能力,具有潜在诱导植物防御、促进植物生长的能力,因此,菌株MK18和MK128具有很强的防治炭疽病的潜力,有望进一步开发为红豆杉炭疽病的生防制剂。本研究为红豆杉炭疽病的生物防治提供了试验依据和优良的益生菌株。

