2种肠道菌群检测技术在小儿抗生素相关性腹泻中的应用比较
潘淑娟 毛安亮 胡文娟
【摘要】 目的 对比分析抗生素相关性腹泻患儿应用传统粪便菌群培养法检测与荧光定量聚合酶链反应(polymerase chain reaction,PCR)技术检测的临床价值。方法 将2021年2月—2022年2月上饶市立医院收治的50例1~3岁抗生素相关性腹泻患儿作为观察对象,分别采用传统粪便菌群培养和荧光定量PCR技术检测肠道菌群,观察对比2种方法的粪便细菌含量检测结果。结果 与粪便菌群培养检测比较,荧光定量PCR检测患儿粪便细菌含量水平更高,差异有统计学意义(P<0.05)。结论 荧光定量PCR技术检测抗生素相关性腹泻患儿肠道菌群的效果更佳,可为临床治疗提供更准确的依据。
【关键词】 抗生素相关性腹泻;小儿;肠道菌群;荧光定量PCR技术;粪便菌群培养法
Comparison of two detection techniques for intestinal flora in children with antibiotic-associated diarrhea
Pan Shujuan1, Mao Anliang1, Hu Wenjuan2. 1 The Shangrao Municipal Hospital,Shangrao,Jiangxi 334000; 2 The Traditional Chinese Medicine Hospital of Shangrao city,Shangrao,Jiangxi 334000
【Abstract】 Objective To compare and analyze the clinical value of traditional fecal flora culture and fluorescence quantitative PCR detection in children with antibiotic-associated diarrhea. Methods From February 2021 to February 2022,50 children with antibiotic related diarrhea aged 1-3 years received in our hospital were observed. The intestinal flora was detected by traditional fecal flora culture and fluorescent quantitative PCR,and the fecal bacterial content detection results of the two methods were observed and compared. Results Compared with fecal flora culture,the level of fecal bacteria detected by fluorescence quantitative PCR was higher,and the difference was statistically significant(P<0.05). Conclusion Fluorescence quantitative PCR is more effective in detecting intestinal flora in children with antibiotic associated diarrhea,which can provide a more accurate basis for clinical treatment.
【Key Words】 Antibiotic related diarrhea; Children; Intestinal flora; Fluorescence quantitative PCR; Fecal bacterial culture method
中圖分类号:R372 文献标识码:A 文章编号:1672-1721(2023)22-0094-03
DOI:10.19435/j.1672-1721.2023.22.031
抗生素相关性腹泻是现代临床应用抗生素治疗过程中最常见的一种并发症,是无法用其他原因解释且伴随抗生素使用而发生的一类腹泻[1]。腹泻的发生与肠道菌群变化有关[2],而人体肠道内有数百种不同类型的细菌,厌氧菌位居首位,还有乳酸杆菌、双歧杆菌等有益细菌以及大肠埃希菌、梭状芽孢杆菌、绿脓杆菌、葡萄球菌等有害细菌[3]。按照是否有致病菌参与,抗生素相关性腹泻有感染性、非感染性之分,其中感染性抗生素相关性腹泻相对少见,与抗生素大量滥用有关,以致于人体肠道内菌群失调,条件致病菌大量增殖,破坏正常菌群,最终引起腹泻;感染性抗生素相关性腹泻临床症状相对严重,主要病原菌多为艰难梭菌,如果不及时干预,有可能会引起伪膜性肠炎[4]。临床更常见的非感染性抗生素相关性腹泻,又被称之为功能性抗生素相关性腹泻。相对于感染性抗生素相关性腹泻而言,非感染性抗生素相关性腹泻症状较轻[5]。为了在临床进行针对性治疗,有必要进行肠道菌群检测,以提高抗生素相关性腹泻患儿粪便细菌检出率,确保治疗的高效性、可靠性。常规粪便检测特异性不足,临床应用受限。荧光定量PCR技术较为新颖,常被用于腹泻患儿的肠胃菌群检测中,能够辅助临床早诊断、早治疗[6]。本研究纳入50例抗生素相关性腹泻患儿作为观察对象,对比分析了传统粪便菌群培养法检测与荧光定量PCR技术检测的临床价值。
1 资料与方法
1.1 一般资料 将2021年2月—2022年2月上饶市立医院收治的50例抗生素相关性腹泻患儿作为观察对象,男性28例、女性22例;年龄1~3岁,平均年龄(2.2±0.8)岁;体质量7~21 kg,平均(13.7±2.2)kg。纳入标准:满足小儿抗生素相关性腹泻的诊断,入院时无腹泻;入院前1周未使用任何微生态制剂;无肝肾功能不全;无先天性心脏病、胃肠道畸形、免疫缺陷病等。排除标准:先天性智力障碍或有精神病史者;合并其他重要器官疾病者;主要观察资料缺失者。分别采用传统粪便菌群培养法和荧光定量PCR技术检测患儿肠道菌群。
1.2 方法 粪便菌群培养法检测。采集患儿新鲜粪便约0.5 g作为检测标本,置于无菌杯内立即送检,以0.9%氯化钠注射液作为稀释液,对检测标本进行稀释,然后使用革兰球菌、革兰杆菌接种、培养,进一步涂片操作,详细观察、记录细菌数量;剩余标本用无菌干燥管储存,-80 ℃冰箱保存备用。
荧光定量PCR技术检测。(1)提取肠道细菌DNA。将保存于-20 ℃环境下的粪便样本取出复融之后,每1 g样本中加入pH值为7.4、0.05 mL/L的磷酸盐缓冲液(PBS)1 mL,持续颠倒摇晃10 min左右,充分混合均匀,然后离心处理10 min,转速为2 000 r/min,提取上清液,以上操作反复进行3次。接着再离心处理3 min,转速为13 000 r/min,获得沉渣。使用PBS溶液对沉淀物进行4次清洗、1次水洗,结束后加入蒸馏水50 mL,悬浮沉淀物。取1%破碎菌体(TritonX-100)50 mL,在100 ℃高温下煮沸5 min,之后置于冷冻环境中进行冷却。(2)选择PCR引物。主要包括乳酸杆菌、双歧杆菌、肠球菌、大肠杆菌4种细菌,引物序列选择时,在BLAST数据库中,需与上述不同类别的细菌16SrDNA全序列进行验证对比,进一步确定不同细菌上下游引物。(3)荧光定量PCR反应体系。以4×dNTP(0.25 mmol/L)2 mL、10×Buffer 2.5 mL、MgCL2(25 mmol/L)2.5 mL等25 mL反应体系为主,细菌上游引物0.2~0.3 mL,细菌下游引物0.2~0.3 mL,DNA模板2 ~3 mL,TAQ酶0.7~0.8 mL,sybrgreen荧光染料2~3 mL,双蒸水10~12 mL。运用荧光定量PCR仪(SLAN-96P型)进行分析、扩增。(4)PCR反应条件。在95℃环境下持续5 min变性反应;在95 ℃环境下持续反应15 s,在60 ℃环境下持续反应60 s,在72 ℃环境下持续反应45 s,在87 ℃环境下持续反应5 s,总共40个循环。在72 ℃环境下延续10 min,然后结束操作。
1.3 观察指标 对比2种检测方法对患儿粪便细菌含量的检测结果,主要包括乳酸杆菌、双歧杆菌、肠球菌、大肠杆菌等。
1.4 统计学方法 使用SPSS 22.0统计学软件进行数据分析,计量资料以x±s表示,行t检验,P<0.05为差异有统计学意义。
2 结果
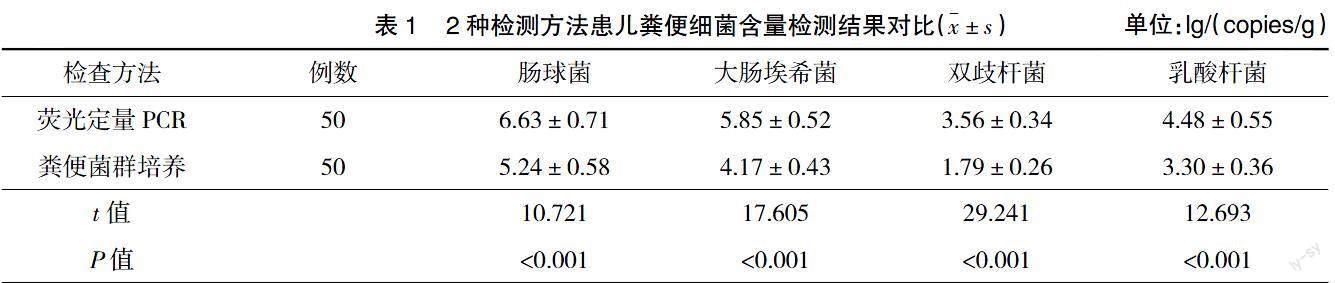
与粪便菌群培养法检测比较,荧光定量PCR检测患儿粪便细菌含量水平更高,差异有统计学意义(P<0.05),见表1。
3 讨论
近年来,我国小儿抗生素相关性腹泻的发生率显著增加,不同类别的抗生素应用及多种抗生素的联合应用都会在一定程度上引起抗生素相关性腹泻,尤其是β-内酰胺类抗生素,需引起临床医务人员高度重视 [7]。小儿抗生素相关性腹泻多发生于应用抗生素初期、停止使用抗生素后2~6周,感染性抗生素相关性腹泻症状表现通常比较严重,尤其是真菌感染引起的腹泻,有可能会导致患儿伴发伪膜性结肠炎,引起全身严重感染,主要症状包括腹泻、腹胀、腹部疼痛不适、高热不退、呕吐等,甚至引发休克、多器官功能障碍综合征、低钾血症、结肠穿孔、肾功能衰竭,危及患儿生命安全[8]。既往临床通常采用血生化检查,有助于临床医师准确判断患儿有无严重感染;粪便涂片检测有助于临床医师了解患儿肠道菌群变化,为指导临床合理使用抗生素、细菌的培养鉴定以及尽早提供准确的鉴定结果至关重要。
随着现代临床医学发展以及相关研究深入,越来越多的研究者认为抗生素相关性腹泻的发生与肠道菌群变化有关。长时间大量应用广谱抗生素或者是联合应用抗生素,虽然具有一定的杀灭细菌作用,但同时也会对正常细菌产生不良影响,以致于人体肠道之中的正常菌群被杀灭、破坏[9]。传统的常规粪便菌群培养检测是临床常用实验室检测方法之一,在特定的环境中,用培养基持续培养7 d左右,便可以在显微镜下观察菌群数量、菌群类型,分离出肠道中引起腹泻的细菌,有助于临床医师判断患儿体内肠道菌群数量的变化,还可以直接观察到有无真菌,为杆菌与球菌比例、革兰阴性与阳性杆菌之间的比例评价提供依据,从而进一步明确患儿肠道菌群破坏的严重程度,为临床完善相关治疗方案提供参考。虽然此种方法的定性程度较高,但是对抗生素相關性腹泻患儿而言,特异性不足,如果培养基上微生物分布不均,会导致低估细菌量的情况,尤其是轻微腹泻的患儿,常规粪便检查并不会发现任何异常;对于腹泻症状较严重的患儿
来说,常规粪便检测也只能检出红细胞、白细胞;定量有待于提高且操作耗时较长[10];受限于操作方法及肠道菌群中各类细菌生长条件及速率差异,传统的常规粪便菌群培养鉴定结果准确性不佳。此外,临床还有多种方法用于粪便菌群检测,如肠道细菌定量培养主要通过不同的培养基以及培养方法计算肠道菌群数量,以此来评价肠道菌群比例失调情况,虽然此种方法具有较高的应用价值,但是实际操作过程中比较烦琐、耗时长,加之菌群培养受限,难以在抗生素相关性腹泻患儿肠道菌群检测过程中得到广泛应用;细胞毒性中和试验(CCTA)特异性强,敏感度高(最低可检测出10 pg毒素),但需要细胞培养及显微镜观察的相应设备和技术,操作烦琐,耗时长(48~72 h),判定结果需要一定经验的技术人员,不适宜临床常规检测;核苷酸扩增检测(NAAT)是一种以RNA为模板扩增出RNA产物,用RNA探针实时检测的恒温扩增技术,具有灵敏度高、检测时间短、产物不易发生污染等优点,但易出现假阳性结果。临床实践中迫切需要一种兼顾效率和准确性的检测方法。
本次研究发现,与粪便菌群培养检测比较,荧光定量PCR检测患儿粪便细菌含量水平更高,差异有统计学意义(P<0.05),说明荧光定量PCR检测的临床应用价值更高。实时荧光定量PCR是指将荧光基团加入PCR反应体系,使整个进程始终处于荧光信号实时监测中,通过标准曲线对未知模板进行定量分析,避免了常规PCR(琼脂糖凝胶电泳、荧光素标记PCR产物、三明治探针杂交、毛细管电泳激光诱导荧光)分析时间长、可能会导致污染、对样本通量的限制较大、易受扩增效率及样品基质和反应物变化的影响以致准确性较低等弊端,以全封闭反应、速度快、重复性好、灵敏度及特异度高、定量准确等优势,实时荧光定量PCR在生命科学研究的各个领域得到广泛应用[11]。随着临床检测的技术不断发展,16S rDNA荧光定量PCR检测技术的提出,为现代临床有效检测小儿肠道菌群提供了新方法。16S rDNA为与细菌染色体编码核糖体RNA(rRNA)相对应的DNA序列,于所有细菌中存在而非原核生物体(病毒、真菌等)不具备,基因编码由通用的保守区和具有种属特异性的可变区组成,多拷贝使得其具备较高的分子生物学检测灵敏度,基因编码长度适中(1 500 bp,含约50个左右的功能域),利于测序,目前几乎所有细菌的16S rDNA基因测序都已完成,成为临床最常用的PCR目标扩增序列[12]。16S rDNA基因检测原理为从细菌样本中的16S rDNA基因片段中获取其序列信息,再于数据库中确定在进化树中的具体位置,从而鉴别细菌种类。针对16S rDNA基因兼具保守性和特异性的特点,可通过不同的引物设计实现对标本中的靶细菌进行准确鉴定。贺锐等[13]采用16S rDNA荧光定量PCR技术检测新生儿出生后第1天、第
3天、第7天粪便中双歧杆菌、乳酸杆菌、大肠埃希菌和肠球菌4种细菌的含量,结果发现上百个细菌的曲线生长特征明显,说明引物16S rDNA荧光定量PCR检测不同类型的细菌的敏感性较高。
综上所诉,相对于传统粪便菌群培养法检测技术而言,荧光定量PCR技术检测抗生素相关性腹泻患儿肠道菌群含量效果更佳,可为临床治疗提供更准确的依据。
参考文献
[1] 钟蕊,林亚莹,朱毅,等.基于16S rDNA高通量测序研究针灸对克罗恩病大鼠肠道菌群的调节作用[J].世界中医药,2022,17(3):311-316,322.
[2] 梅其杰,徐文飞,延伟伟,等.兔膝骨性关节炎模型肠道菌群的16S rRNA检测分析[J].中国矫形外科杂志,2022,15(4):1-5.
[3] LI L J,YAN Q Q,MAN,et al.Analysis of intestinal flora and inflammatory cytokine levels in children with non-infectious diarrhea[J].Transl Pediatri,2021,10(5):1340-1345.
[4] 王广宇,陈潇潇,侯显良.基于16S rDNA测序检测原发性胆汁性胆管炎患者肠道菌群的变化[J].中国现代医生,2021,59(19):139-143,193.
[5] ZHAO W,YU M L,TAO X L,et al.Analysis of the intestinal microbial community altered during rotavirus infection in suckling mice[J].Virol J,2021,18(1):254-263.
[6] 郭苗苗,张佳慧.抗生素相关性腹泻患儿肠道菌群变化与血清细胞因子的关系[J].中国微生态学杂志,2020,32(9):1056-1059,1064.
[7] 王硕,张志华.抗生素相关性腹泻病原菌的检测方法[J].临床荟萃,2020,35(4):369-372.
[8] 冯爱民,杨惠侠.不同益生菌对抗生素相关性腹泻肺炎新生儿肠道菌群及促炎因子的影响[J].中国微生态学杂志,2019,31(7):808-811,815.
[9] 王帆,王娟,翁明瑶,等.功能性便秘幼儿肠道菌群的16S rDNA和REP-PCR檢测分析及效果评价[J].中国现代医生,2019,57(18):1-4,8,169.
[10] 张莉,窠文博,张颖,等.婴幼儿抗生素相关性腹泻的影响因素及其防治[J].中国微生态学杂志,2019,31(3):320-322,328.
[11] 杜金龙,冯燕,李恒涛.实时荧光定量PCR结合探针检测MP的临床价值及MP耐药情况分析[J].检验医学,2020,35(6):535-539.
[12] 臧晓明,景彩,肖宁,等.基于16S rDNA基因测序技术分析不同身体质量指数人群的肠道菌群结构差异[J].中华中医药杂志,2021,36(1):451-455.
[13] 贺锐,张丽秀,叶萍,等.用16S rRNA荧光定量PCR技术分析低出生体重儿肠道菌群变化及影响因素[J].中国微生态学杂志,2017,29(7):776-781.
(收稿日期:2023-05-11)

