大鼠肠道菌群对芍药苷体外代谢转化的研究
柯仲成+杨楠+侯雪峰+王爱东+封亮+贾晓斌

[摘要]为研究肠道菌群对芍药苷在体内吸收和代谢的影响,该课题在离体培养的大鼠肠道菌群中,加入芍药苷进行厌氧孵育,分析芍药苷在48 h内的变化过程,探讨体外大鼠肠道菌群对芍药苷的代谢转化。采用UPLC监测芍药苷在不同孵育时间点的变化,色谱条件为:WelchromTM C18色谱柱(4.6 mm×100 mm,5 μm),流动相0.1%甲酸(A)-乙腈(B),梯度洗脱,流速0.4 mL·min-1,柱温30 ℃;同时运用UPLC-Q-TOF-MS/MS对转化产物进行分析鉴定(ESI离子源,正离子模式检测),结合化合物精确相对分子质量和MS裂解碎片信息,并辅以保留时间及文献数据对代谢产物进行结构解析,分析芍药苷肠道代谢规律。结果发现孵育24 h后,芍药苷已经完全被代谢转化,得到的代谢产物包括芍药内酯苷、芍药内酯苷元、脱酰基-芍药内酯苷、脱酰基-芍药内酯苷元和芍药内酯B等。通过代谢途径分析发现,离体的大鼠肠道菌群先将芍药苷转化成芍药内酯苷,然后通过脱葡萄糖、脱苯甲酰基和四元环裂解重排等多个途径被进一步代谢,将芍药苷逐步转化生成相对分子质量更小、疏水性更强的代谢产物,从而更好被肠道吸收。
[关键词]芍药苷; 肠道菌群; 生物转化
[Abstract]In order to clarify the effect of intestinal flora on the absorption and metabolism of paeoniflorin in vivo, the metabolism of paeoniflorin by rat intestinal flora was studied under the in vitro anaerobic condition. Paeoniflorin was incubated with rat anaerobic intestinal flora for 48 h, and UPLC was used to detect the changes of paeoniflorin at different incubation time points under the following chromatographic conditions:WelchromTM C18 chromatographic column (4.6 mm×100 mm, 5 μm), with 0.1% formic acid(A)-acetonitrile(B) as the mobile phase for gradient elution. The flow rate was 0.4 mL·min-1, and column temperature was 30 ℃. UPLC-Q-TOF-MS with positive ion mode(ESI ion source) was applied to investigate the structural characterization of metabolic products. The structures of the metabolites were identified by accurate molecular weight, TOF-MS/MS fragmentation information, combined with retention time and literature data review, and the intestinal metabolic rules were then analyzed. After incubation for 24 h, the paeoniflorin was metabolized completely, and the resulting metabolites(albiflorin, albiflorinaglycone, deacylate albiflorin, deacylate albiflorin aglycone and paeonilactone-B) were detected in rat intestinal flora. The metabolic pathway analysis showed that the isolated rat intestinal flora first transformed peoniflorin into albiflorin, and then further metabolized by glucose removal, phenyl group removal, or four-membered ring pyrolysis and rearrangement. Paeoniflorin was gradually transformed into more hydrophobic metabolites with smaller molecular mass, which were better absorbed by the intestinal tract.
[Key words]paeoniflorin; intestinal bacteria; metabolism
doi:10.4268/cjcmm20162021
赤芍为毛茛科植物芍药Paeonia lactiflora Pall.或川赤芍P. veitchii Lynch.的干燥根,性苦,微寒,具有清热凉血、散瘀止痛、清泻肝火之功,可用于温毒发斑,血热吐衄,肝郁胁痛,经闭痛经,目赤肿痛,痈肿疮疡[1]。赤芍总苷是其主要活性部位,而芍药苷则为代表性成分,研究表明其对心血管系统、神经系统均有显著保护作用,还有抗肿瘤、保肝、抗炎、抗氧化等药理活性[2]。从结构上来说,芍药苷是一个糖苷类化合物,肠道吸收较差,口服生物利用度偏低,可能是通过葡萄糖苷酶代谢成苷元而发挥疗效[3-4];而其结构母核——蒎烷型单萜的四元环张力较大,容易断裂,引起生物转化。芍药苷在肠道中发生降解或生物转化的性质,可能类似“前体药物”。本试验采用离体代谢研究的方法[5-6],用富含大鼠肠道菌群的培养液与药物在厌氧条件下共同孵育,考察肠道菌对芍药苷的分解代谢作用,探讨其在肠道中生物转化的一般规律,为芍药苷的肠道转化吸收提供科学依据,为赤芍的临床应用及开发提供参考。
1 材料
螺口厌氧试管(亨盖特,16 mm×125 mm);C-31-CX密封培养罐(日本三菱,2.5 L);Pyramid 2200气密隔离保护罩(法国Erlab);Triple Q-TOF 5600质谱仪(AB Sciex公司),配有电喷雾离子源ESI系统;LC-20AD型高效液相色谱(日本岛津公司);数据采集和处理分别采用 Analyst TF 1.6和Markerview1.2软件。
芍药苷(阿拉丁,纯度>98.0%,批号1523046),乙腈为色谱纯(美国Fisher),甲酸(德国CNW),MGC厌氧培养产气袋(日本三菱),水为纯化水,其余试剂均为分析纯。
2 方法与结果
2.1 离体大鼠肠道菌对芍药苷的代谢
2.1.1 TSB 培养液的配制 胰蛋白胨1.5%,大豆蛋白胨0.5%,NaCl 0.5%,用纯化水配制而成,调节 pH为7.2,经121 ℃压力下,蒸气灭菌4 min后使用。
2.1.2 厌氧条件的建立 将所用的试剂、螺口厌氧试管、密封培养罐、厌氧产气袋等置于气密隔离保护罩,向保护罩内充入氮气,厌氧操作均在隔离罩内进行。
2.1.3 肠道菌液的制备 取6只大鼠的新鲜粪便溶于20%甘油和1.8%的氯化钠混合溶液中(1∶5),加入玻璃珠涡旋 5 min,混匀后-80 ℃保存待用。试验前,取适量菌液,加入TSB培养液(1∶8)混匀,置于37 ℃恒温摇床中,厌氧环境下温孵12 h。
2.1.4 体外温孵试验 取芍药苷适量,分别用肠道菌液或双蒸馏水为溶剂,配制得到芍药苷质量浓度为0.25 g·L-1的肠道菌温孵组和药物对照组;并将不含芍药苷的肠道菌液设为菌液空白组。分别在厌氧下将各组样品置于37 ℃的恒温震荡摇床中(100 r·min-1),分别孵育0,2,4,8,12,24,48 h。取温孵的样品500 μL,立即加入甲醇3 mL终止反应,涡旋5 min,12 000 r·min-1离心10 min,取上清液,氮气吹干[7],进样前加入500 μL流动相复溶,12 000 r·min-1离心5 min,取10 μL上清用UPLC-MS/MS检测。
2.2 HPLC-MS 色谱条件
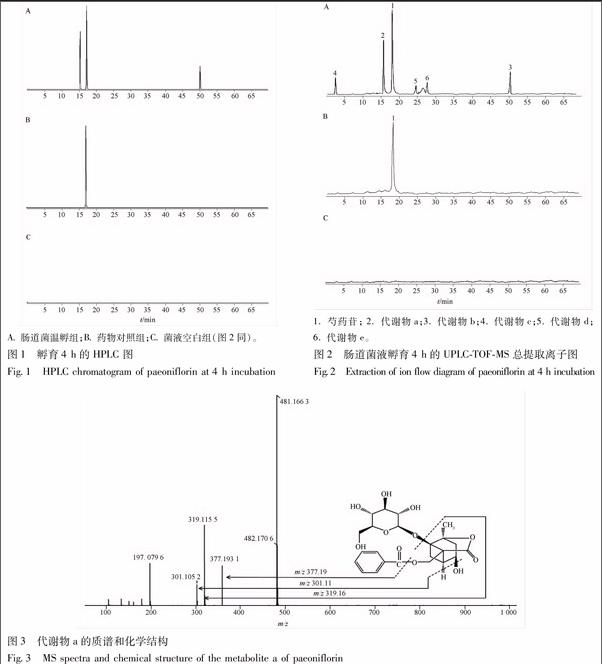
色谱条件:WelchromTM C18色谱柱(4.6 mm×100 mm,5 μm);流动相0.1%甲酸(A)-乙腈(B),梯度洗脱,0~5 min,2%~8% A;5~30 min,8%~20% A;30~45 min,20%~35% A;45~60 min,35%~60% A;60~65 min,60%~100% A,流速0.4 mL·min-1,柱温 30 ℃。色谱图见图1,药物对照组并没有新的色谱峰出现,而当与肠道菌液孵育4 h后,芍药苷(tR17.18 min)浓度逐渐降低,并同时在tR15.32,50.32 min左右出现明显吸收峰;当温孵24 h后,只剩下50.32 min处吸收峰。
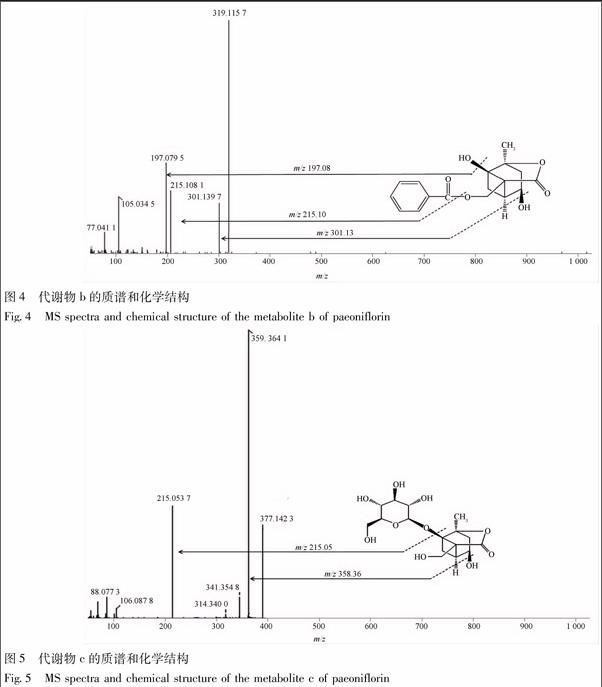
质谱条件:正离子检测;离子喷射电压 5.0 kV;毛细管温度 350 ℃;毛细管电压3 kV;鞘气(N2)流速0.414 MPa;辅助气流速0.035 MPa。总提取离子流图见图2,药物对照组并没有新的质谱峰出现,而肠道菌孵育4 h后出现若干个峰,tR15.32 min峰的m/z为481,tR24.91,27.88 min峰的m/z215,tR5.03 min峰的m/z319,当温孵24 h后,tR17.18 min吸收峰消失。
2.3 代谢物的结构鉴定
代谢物a正离子模式的质谱图见图3,在m/z代谢物c正离子模式的质谱图见图5,在m/z377处发现准分子离子峰,为[M+H]+, 且在m/z359,341,215发现碎片离子峰,分别为 [M+H- H2O]+,[M+H-2H2O]+,[M+H-Glc]+,推测其为脱苯甲酰基芍药内酯苷。
代谢物d正离子模式的质谱图见图6,发现在tR24.91 min处有m/z215的准分子离子峰,为[M+H]+,且在m/z197,185,179,167发现碎片离子峰,分别为[M-H2O]+,[M-CH2O]+,[M-2H2O]+,[M-CH2O-H2O]+,推测d可能是脱苯甲酰基芍药内酯苷元。
代谢物e正离子模式的质谱图见图7,在tR27.88 min处有m/z215,197的准分子离子峰,为[M+H+H2O]+,[M+H]+, 且在m/z179,167,153发现碎片离子峰,分别为[M-H2O]+,[M-CH2O]+,[M+H-CO2]+,结合文献[9-10]及芍药内酯苷元的类型,推测e可能为芍药内酯B。
2.4 芍药苷肠道菌群代谢途径分析
对转化产物进行分析,结合化合物精确相对分子质量和MS裂解碎片信息进行化合物结构解析,分析肠道代谢规律。从芍药苷自身的质谱裂解规律,分析大鼠肠道代谢产物,得到芍药内酯苷、芍药内酯苷元、脱酰基芍药内酯苷、脱酰基芍药内酯苷元、芍药内酯B等。经UPLC-Q-TOF-MS/MS分析,结合化合物精确相对分子质量和MS裂解碎片信息[11],鉴定了芍药内酯苷、芍药内酯苷元、苯甲酰基芍药内酯苷、脱苯甲酰基芍药内酯苷元和芍药内酯B,代谢产物分析见表1,代谢途径见图8。
3 讨论
本试验中,大鼠肠道菌对芍药苷的代谢产物经UPLC-MS检测分析,发现2 h时就有芍药内酯苷转化生成,随着时间延长,芍药内酯苷元、脱酰基芍药内酯苷、脱酰基芍药内酯苷元逐渐增加,24 h后检测不到芍药苷、芍药内酯苷和芍药内酯苷元,48 h后则以脱苯甲酰基芍药内酯苷元和芍药内酯B为主,说明芍药内酯苷元被肠道菌群的代谢,转化为极性较小的代谢产物, 有利于其在肠道内的跨膜转运, 并能加快吸收入血而发挥药效,水解是芍药苷代谢的主要途径,包括半缩醛酸、酯键和糖苷键水解;另外,蒎烷型双环单萜四元环的开环裂解和迁移重排是肠道菌群代谢的另一途径。
对于糖苷类成分而言,苷元是肠道菌群代谢的主要产物[12]。但在前期实验中,大鼠口服芍药苷或赤芍提取物后,在血浆中发现芍药苷,但并未发现芍药苷元或芍药内酯苷元。可能是由于酯键以及蒎烷型单萜的特殊四元环结构的不稳定性,导致苷元在动物体内的快速生物转化,受肠道菌群影响的同时,还可能被肝脏微粒体快速代谢[13],有待进一步深入研究。
随着萜类化合物生物活性的深入认识,其血中移行成分及药物代谢等方面的研究越来越受人们重视。刘鑫鑫等[14]通过体外实验研究表明,芍药苷和芍药内酯苷在大鼠肠内菌群的作用下可以发生互相转化,也通过体内实验,说明芍药苷的代谢途径有水解和氧化等,但并未深入分析和阐述肠道菌对芍药苷的代谢途径。另也有文献报道,在体外肠道菌孵育,芍药苷能被转化为paeonimetabolin I[15-16],但本实验并未检出,但推测有paeonimetabolin I的羟基化产物的存在,说明肠道菌群对药物代谢易受诸多因素影响,如动物种类及孵育方式等[17-18]。综上所述,芍药苷易被肠道菌群代谢,掌握口服后其在体内的代谢转化规律,可为深入理解蒎烷型单萜类成分的药理作用机制提供帮助。
[参考文献]
[1]张建军,李伟,王丽丽,等. 赤芍和白芍品种、功效及临床应用述评[J].中国中药杂志,2013,38(10):3595.
[2]陆小华,马骁,王建,等. 赤芍的化学成分和药理作用研究进展[J].中草药,2015,46(4):595.
[3]张圣洁,郭锦瑞,康安,等. 肠道菌群对中药糖苷类成分脱糖基代谢的研究进展[J].中国中药杂志,2013,38(10):1459.
[4]房卉,李孟璇,李海波,等. 大鼠肠道菌群对短小蛇根草苷体外代谢转化研究[J].中国中药杂志, 2016, 41(10):1921.
[5]张文秀,杨彪,胡玉梅,等. 离体大鼠肠道菌群对类叶升麻苷代谢的研究[J].中国中药杂志, 2016,41(8):1541.
[6]宋瑞,田媛,张尊建.大黄4种饮片水提液体外肠道菌群转化比较研究[J].中国中药杂志, 2012, 37(12):1755.
[7]曹伟宇,王鹏远,冯斌,等.离体培养人肠道菌群对九节龙皂苷Ⅰ生物转化的研究[J]. 天然产物研究与开发, 2015, 27(8):1357.
[8]刘鑫鑫, 马骁驰, 霍长虹,等. 芍药苷和芍药内酯苷的微生物转化[J]. 中国中药杂志, 2010, 35(7):872.
[9]Kadota S, Terashima S, Basnet P, et al. Palbinone, a novel terpenoid from Paeonia albiflora; potent inhibitory activity on 3 alpha-hydroxysteroid dehydrogenase[J]. Chem Pharm Bull (Tokyo), 1993, 41(3):487.
[10]Kim S H, Lee M K, Lee K Y, et al. Chemical constituents isolated from Paeonia lactiflora roots and their neuroprotective activity against oxidative stress in vitro[J]. J Enzyme Inhib Med Chem, 2009,24(5):1138.
[11]李坤平, 高崇凯, 李卫民.牡荆苷和异鼠李素-3-O-β-D-芸香糖苷的电喷雾飞行时间质谱研究[J]. 中国中药杂志,2011,36(2):180.
[12]张蔚, 江曙, 钱大玮,等. 肠道细菌对柚皮苷的代谢研究[J]. 药学学报, 2013, 48 (12):1817.
[13]谭妍, 庄笑梅, 沈国林,等. 川芎嗪的肝微粒体代谢动力学及代谢表型研究[J]. 药学学报,2014, 49(3):374.
[14]刘鑫鑫. 芍药苷和芍药内酯苷的代谢研究[D]. 石家庄:河北医科大学, 2009.
[15]He J X, Akao T, Tani T. Influence of co-administered antibiotics on the pharmacokinetic fate in rats of paeoniflorin and its active metabolite paeonimetabolin-I from Shaoyao-Gancao-tang[J]. J Pharm Pharmacol, 2003, 55(3):313.
[16]Heikal O A, Akao T, Takeda S, et al. Pharmacokinetic study of paeonimetabolin I, a major metabolite of paeoniflorin from paeony roots[J]. Biol Pharm Bull, 1997, 20(5):517.
[17]常佩亮.肠道菌群对芹菜素的代谢及影响因素的研究[D].哈尔滨:哈尔滨医科大学,2009.
[18]宋瑞,田媛,张尊建.大黄4种饮片水提液体外肠道菌群转化比较研究[J].中国中药杂志,2012, 37(12):1755.
[责任编辑 曹阳阳]

