沙库巴曲缬沙坦抑制阿霉素诱导大鼠心肌纤维化的作用机制
宋昕雨,李家富,程晓洪,陈俞瑾
心血管疾病和恶性肿瘤是威胁人类生命健康的两个最重要的疾病,新型化疗和免疫疗法的出现明显改善了癌症病人的预后。然而随着老年癌症病人数量的增加和抗肿瘤治疗周期的延长,心血管并发症的处理和治疗引起的心脏毒性成为一个重要的问题[1]。蒽醌类药物是临床上容易导致心脏毒性的药物,阿霉素(doxorubicin,DOX)作为有效的蒽醌类抗肿瘤药物,常与其他药物联合治疗各种类型的癌症,这些联合治疗在增强杀灭恶性细胞的同时也有可能损害包括心肌细胞在内的正常细胞结构和功能[2-3]。已有研究证实,阿霉素主要通过刺激心脏成纤维细胞产生胶原蛋白,从而促使心脏纤维化的发生[4],最严重可导致伴有充血性心力衰竭的扩张型心肌病,而氧化应激与阿霉素诱导的心肌纤维化和心肌病的机制密切相关[5]。氧化应激是诱导心肌损伤和心肌重塑的主要机制之一,其意味着过量产生活性氧(reactive oxygen species,ROS)对组织细胞造成损伤。
沙库巴曲缬沙坦(LCZ696)是一种血管紧张素受体脑啡肽酶抑制剂(angiotensin receptor neprilysin inhibitors,ARNI),是由脑啡肽酶抑制剂(neprilysin inhibition)AHU377和血管紧张素受Ⅱ阻滞剂(ARB)缬沙坦以1∶1比例合成的钠超复合物,通过阻断肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)激活和对利钠肽系统正性效应,而起到扩张血管、利尿排钠、抗心肌纤维化、抗心肌肥厚、抑制心脏重构的作用[6-7]。现有研究发现,ARNI在高血压、心肌梗死等疾病中也有治疗效果,但目前关于ARNI改善氧化应激、在抗肿瘤治疗过程中发挥心脏保护作用及其可能机制的报道仍较少。
本研究旨在探讨沙库巴曲缬沙坦能否改善阿霉素诱导的大鼠心肌纤维化及是否通过调节蛋白激酶C(PKC)/ROS信号通路减轻氧化应激而发挥心脏保护作用,为防止心肌重构和抗肿瘤药物治疗过程中的心脏毒性提供潜在的理论基础和实验依据。
1 材料与方法
1.1 实验动物、试剂及仪器
健康雄性6~8周龄SD大鼠40只,体质量180~200 g,购自西南医科大学实验动物中心,动物许可证号SCXK(川)2018-17。沙库巴曲缬沙坦钠片(国药准字J20190001)购自诺华公司。盐酸阿霉素(货号SD9280)、佛波酯(PMA,货号P6741)均购自Solarbio公司。二喹啉甲酸(BCA)蛋白质浓度测定试剂盒(货号AS1086)、增强型化学发光试剂(ECL)检测试剂盒(货号AS1086)均购自ASPEN公司。抗甘油醛-3-磷酸脱氢酶(GAPDH)抗体(货号ab181602)、抗PKC抗体(货号ab179521)均购自Abcam公司。DYY-6C型电泳仪购自北京市六一仪器厂。TGL-16型冷冻离心机购自湖南湘仪实验室仪器开发有限公司。JT-12K型脱水机、JB-P5型包埋机均购自武汉俊杰电子有限公司。
1.2 动物模型的建立及分组
适应性喂养1周后将40只大鼠随机分为对照组(N组,10只)、模型组(30只),模型组腹腔注射阿霉素,每次3 mg/kg,每周2次,共3周,诱导大鼠心肌纤维化,N组注射相同体积溶剂。3周后,模型组再随机分为DOX组、LZC696干预组(ARNI组)和PMA组,每组10只。ARNI组和PMA组采用沙库巴曲缬沙坦混悬液60 mg/(kg·d)灌胃,共4周;N组、DOX组灌胃相同体积的溶剂。PMA组大鼠灌胃2周后,腹腔注射PMA 2 μmol/kg,每隔1 d注射1次,共2周。N组、DOX组和ARNI组腹腔注射相同体积的溶剂。
1.3 心脏超声检查
药物干预结束后,大鼠均用水合氯醛(300 mg/kg)麻醉后进行心脏超声检查,记录左心室射血分数(LVEF)、左心室短轴缩短率(LVFS),完成超声心动图检测后称得体质量,处死大鼠后解剖大鼠并迅速取出心脏称取心脏重量(heart weight,HW)。计算心脏重量指数,心脏重量指数=心脏重量/体质量。
1.4 组织标本检测
取甲醛固定的心脏组织标本,制作为厚度约为4 μm的石蜡切片。苏木精-伊红(HE)染色观察心肌细胞形态及结构改变,Masson染色观察各组心肌组织胶原沉积情况并计算心肌胶原容积分数(collagen volume fraction,CVF),ROS荧光探针-DHE检测心肌细胞ROS含量。
1.5 酶联免疫吸附试验(ELISA)法测定N末端脑钠肽前体(NT-proBNP)水平
收集血液样本后,4 ℃下,2 000×g离心10 min,收集上清液,-20 ℃温度保存备用。采用双抗夹心法,分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步骤操作相同)、待测样品孔。在酶标包被板上待测样品孔中加样品50 μL,将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。1)加酶:每孔加入酶标试剂100 μL,空白孔除外。2)温育:用封板膜封板后置37 ℃温育60 min。配液:将20倍浓缩洗涤液用蒸馏水20倍稀释后备用。3)洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干。4)显色:每孔先加入50 μL显色剂A,再加入50 μL显色剂B,轻轻震荡混匀,37 ℃避光显色15 min。5)终止:每孔加终止液50 μL,终止反应(此时蓝色立转黄色)。6)测定:以空白孔调零,450 nm波长依序测量各孔的吸光度(OD)值。测定应在加终止液后15 min以内进行。
1.6 蛋白免疫印迹法(Western Blot)测定相关蛋白水平
心肌组织块用预冷的磷酸缓冲盐溶液(PBS)漂洗2次或3次,去除血污,剪成小块置于匀浆器中。加入10倍于组织体积的组织蛋白提取试剂,冰浴彻底匀浆,于离心管内振荡匀浆液,冰浴30 min,同时用移液器反复吹打以确保匀浆液完全裂解。4 ℃下12 000 r/min离心5 min,收集上清液。使用BCA蛋白质浓度测定试剂盒测定样品蛋白浓度,保证每个样品总蛋白上样量均为40 μg。在蛋白样品中加入适量的5×蛋白上样缓冲液,95~100 ℃沸水浴5 min。配制分离胶及浓缩胶,进行电泳分离;转聚偏二氟乙烯(PVDF)膜,将转好的膜加入封闭液室温封闭1 h;除去封闭液,加入用一抗稀释液,4 ℃孵育过夜;TBST洗膜3次,每次5 min;加入二抗稀释液稀释好的二抗,室温孵育30 min,用TBST在室温下摇床上洗四次,每次5 min;滴加新鲜配制的ECL混合溶液(A∶B=1∶1)到膜的蛋白面侧,暗室中曝光;根据不同的光强度调整曝光条件,显影、定影。用AlphaEasLVEFC软件处理系统分析目标带的光密度值。
1.7 统计学处理

2 结 果
2.1 各组体质量、心脏重量和心脏重量指数比较
与N组比较,DOX组体质量明显下降(P<0.05),心脏重量指数明显升高(P<0.05)。与DOX组比较,ARNI组和PMA组体质量明显增加(P<0.05),心脏重量指数明显降低(P<0.05)。与ARNI组比较,PMA组体质量降低、心脏重量指数升高,但差异均无统计学意义(P>0.05)。各组间心脏重量变化差异无统计学意义(P>0.05)。详见表1。

表1 各组体质量、心脏重量和心脏重量指数比较(±s)
2.2 各组LVEF、LVFS值比较
与N组比较,DOX组LVEF、LVFS均明显降低(P<0.05)。与DOX组比较,ARNI组LVEF、LVFS均明显升高(P<0.05),表明沙库巴曲缬沙坦干预可一定程度改善大鼠的心功能。与DOX组比较,PMA组LVEF、LVFS明显升高(P<0.05);与ARNI组比较,PMA组LVEF、LVFS明显降低(P<0.05)。详见表2。

表2 各组LVEF、LVFS值比较(±s) 单位:%
2.3 沙库巴曲缬沙坦对大鼠心肌纤维化的影响
2.3.1 HE染色
N组心肌纤维染色均匀,排列整齐,分布均匀,轮廓清晰,细胞核位于细胞中央,细胞间隙正常,而DOX组心肌纤维着色不均,排列紊乱,轮廓模糊,细胞核散乱分布,可见细胞水肿、肥大。ARNI组、PMA组心肌纤维较整齐,轮廓较清晰,细胞水肿、肥大较DOX组有所改善。详见图1。

图1 各组大鼠心肌HE染色图(×400)
2.3.2 Masson染色
N组胶原纤维呈蓝色,肌纤维呈红色。DOX组心肌细胞排列紊乱,心肌间质蓝色胶原纤维明显增多,心肌纤维化明显。ARNI组、PMA组心肌细胞排列较好,心肌间质胶原纤维较DOX组明显减少。ARNI组、PMA组较DOX组排列整齐,蓝色胶原纤维面积下降,提示ARNI组、PMA组心肌纤维化改善,详见图2。CVF分析显示,N组CVF为(0.31±0.09)%,DOX组CVF为(6.01±0.24)%,DOX组CVF较N组升高(P<0.05),ARNI组、PMA组CVF分别为(1.36±0.11)%、(2.18±0.25)%,均较DOX组下降(P<0.05),ARNI组CVF较PMA组下降(P<0.05),提示PMA组心肌纤维化较ARNI组加重,详见图3。

图2 各组大鼠心肌Masson染色(×400)
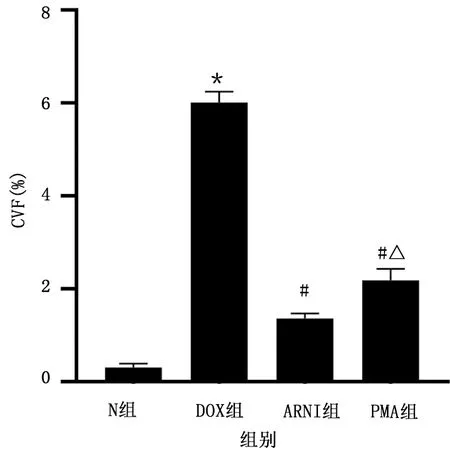
图3 各组CVF比较
2.4 沙库巴曲缬沙坦对心肌纤维化大鼠心脏组织ROS含量的影响
N组大鼠心脏组织ROS含量为(10.21±1.62)%;DOX组心肌内红色荧光较N组明显增强,ROS含量为(65.61±4.86)%,较N组明显上升(P<0.05)。ARNI组、PMA组荧光强度较DOX组明显减弱,ROS含量分别为(28.8±2.37)%、(44.3±2.3)%,较DOX组明显下降(P<0.05)。与ARNI组比较,PMA组ROS含量升高(P<0.05)。详见图4、图5。

图4 各组ROS含量比较

图5 各组大鼠心肌ROS荧光强度(×400)
2.5 沙库巴曲缬沙坦对心肌纤维化大鼠NT-proBNP的影响
N组血清NT-proBNP为(0.13±0.03)ng/mL,DOX组血清NT-proBNP为(0.99±0.07)ng/mL,与N组比较,DOX组NT-proBNP水平明显上升(P<0.05);ARNI组血清NT-proBNP为(0.42±0.04)ng/mL,PMA组血清NT-proBNP为(0.58±0.06)ng/mL,与DOX组比较,ARNI组、PMA组血清NT-proBNP水平下降(P<0.05);与ARNI组比较,PMA组血清NT-proBNP水平升高(P<0.05)。详见图6。

图6 各组血清NT-proBNP水平比较
2.6 Western Blot测定大鼠心脏组织PKC蛋白水平
N组PKC表达为0.08±0.00,DOX组PKC表达为0.38±0.03,与N组比较,DOX组PKC表达明显上升(P<0.05);ARNI组PKC表达为0.19±0.04,PMA组PKC表达为0.51±0.02,与DOX组比较,ARNI组PKC表达下降,PMA组PKC表达上升(P<0.05);与ARNI组比较,PMA组PKC表达升高(P<0.05)。详见图7。
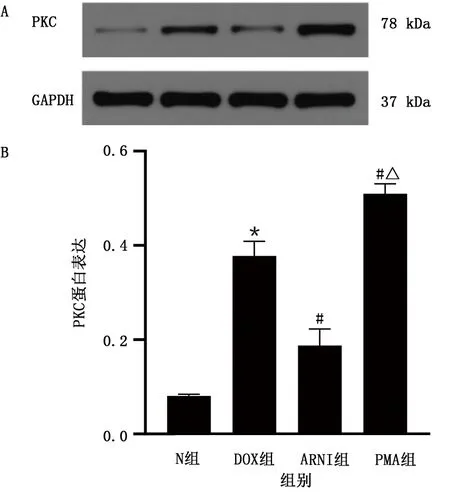
图7 各组PKC蛋白表达水平比较
3 讨 论
阿霉素是临床常用的蒽醌类广谱抗肿瘤药物,其抗肿瘤特性归因于其插入DNA、破坏拓扑异构酶Ⅱ介导的DNA复制,从而导致肿瘤细胞的DNA破坏和细胞凋亡。同时DOX还通过其醌基团氧化还原反应生成ROS,生成超氧阴离子(O2-)、过氧化氢(H2O2)和羟自由基,这些联合作用可能增强杀伤恶性肿瘤细胞的效果,然而也损害了包括心肌细胞在内的非正常细胞的结构和功能[3]。心肌纤维化是阿霉素所致心肌病发生发展过程中的重要病理改变,而氧化应激在该过程中起重要作用。氧化应激通常提示机体抗氧化防御系统中ROS的生成和清除严重失衡,导致ROS大量积聚。研究表明,阿霉素可明显上调心肌组织氧化应激水平,并导致心肌细胞凋亡,从而损伤心肌及心脏功能[3,8]。本研究结果显示,阿霉素诱导的心肌纤维化大鼠心肌间质胶原纤维增多明显,紊乱排列,左室心肌中ROS含量明显上升,超声心动图也显示左心收缩功能明显下降,心力衰竭标志物NT-proBNP明显升高,提示阿霉素诱导的模型组大鼠存在明显的心肌纤维化和收缩功能减退。
抗肿瘤药物治疗所致心脏毒性与其剂量呈正相关,临床治疗可以通过限制药物累积剂量以减轻毒性,或在剂量不变以保证治疗效果的同时改变用药方式,或予以有效保护心脏的药物治疗[2]。血管紧张素转化酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)、β受体阻滞剂和他汀类药物都被证明在抗肿瘤治疗过程中具有一定的心脏保护作用[2]。沙库巴曲缬沙坦通过抑制脑啡肽酶同时增强利钠肽系统,并通过阻断RAAS系统,通过改善利钠和利尿、降低交感神经张力、减少心肌纤维化和诱导有益的心脏逆向重构的血流动力学和电生理改变而产生多种有益效果[9],该药物作用也为其在抗肿瘤治疗中发挥心脏保护作用提供了基础。Peng等[10]研究表明ARNI可能通过调节去乙酰化酶3(Sirt3)/锰超氧化物歧化酶(Mn-SOD)通路减轻压力超负荷诱导的心力衰竭中心肌氧化应激和细胞凋亡。Gao等[11]研究发现,ARNI通过减少血管内皮细胞内ROS的产生和丙二醛水平来减轻脂多糖诱导的氧化应激。Ye等[12]研究发现,ARNI通过减少Toll样受体2(TLR2)-髓分化因子88(MyD88)复合物形成、通过抑制核转录因子κB(NF-κB)介导的炎症反应来预防阿霉素引起的心脏扩张衰竭、纤维化和炎症。Xia等[13]研究表明,ARNI可能通过减轻Drp1介导的线粒体功能障碍而起到对阿霉素诱导的心脏功能障碍的保护作用,减轻阿霉素心肌病左室心肌纤维化及改善心功能。总之,ARNI可能通过多种途径或信号通路起到减轻氧化应激、抗炎、改善心肌纤维化与心室重构的作用。
PKC信号通路广泛表达于全身,参与氧化应激、炎症反应、胶原合成和细胞凋亡,被认为在心肌纤维化、心力衰竭、心律失常过程中发挥重要作用,且研究表明PKC信号通路可在阿霉素的作用下被激活[3,14-19]。多项研究发现,PKC可调节ROS的生成以提高氧化应激水平而导致细胞或器官的损伤、影响其正常功能。Volpe等[20]的研究表明,高血糖状态下持续激活的 PKC可引起还原型辅酶Ⅱ(NADPH)氧化酶增多,继而导致ROS的产生,提升氧化应激水平而影响正常细胞功能。Lu等[21]研究发现,salusin-β通过激活PKC/ROS信号通路,引发肾小管细胞的凋亡和死亡,从而导致急性肾损伤。Liu等[15]研究结果显示,PKC能间接通过增加线粒体活性氧(mitoROS)的生成而下调Nav1.5的表达,可能具有诱发心律失常的作用。本研究利用阿霉素心肌纤维化大鼠模型,经沙库巴曲缬沙坦治疗后,ARNI组较DOX组大鼠心功能改善,LVEF和LVFS增加,NT-proBNP水平下降,病理染色结果显示,心肌纤维化明显改善,心肌胶原纤维、CVF明显减少,ROS含量、PKC蛋白表达水平明显下降,提示沙库巴曲缬沙坦可能通过抑制PKC而减少ROS生成,以减轻过度氧化应激,最终改善阿霉素诱导大鼠心肌纤维化而起到保护心肌的作用;经PMA干预后,PMA组CVF、NT-proBNP水平、ROS含量、PKC蛋白水平较ARNI组增加(P<0.05),进一步表明沙库巴曲缬沙坦减轻氧化应激、改善阿霉素诱导大鼠心肌纤维化的作用可能是通过抑制PKC/ROS信号通路表达而达到的。由此可见,沙库巴曲缬沙坦可改善阿霉素引起的心肌纤维化。
综上所述,沙库巴曲缬沙坦可以改善阿霉素诱导的大鼠心肌纤维化,从而抑制心肌重构,该保护心脏的作用可能与抑制PKC/ROS信号通路表达从而减轻氧化应激有关。

