心肌缺血再灌注致认知障碍与海马体自噬关系的实验研究
杨文曲,韩冲芳,王 慧,陈 焱,贺建东,师高翔,段应磊,赵雪丽,常 鑫
心肌缺血再灌注损伤是心脏手术和冠心病病人非心脏手术中常见的病理生理过程,在损伤心肌组织的同时,还会引发脑细胞线粒体膜去极化和线粒体功能障碍,同时表现出认知功能下降[1-3]。自噬是一种分解、清除细胞内异常蛋白质和细胞器的分解代谢机制,可在神经元细胞稳态和突触可塑性调节中发挥作用[4]。研究表明,激活海马体自噬对术后认知功能障碍有神经保护作用[5]。而心肌缺血再灌注所致认知障碍与海马体自噬之间的关系尚未明确,本研究拟探讨心肌缺血再灌注致大鼠认知障碍与海马体自噬的关系。
1 材料与方法
1.1 实验动物及分组
选取SD大鼠60只,19~21月龄,体质量300~350 g,采用随机数字表法分为未处理组(U组)、假手术组(S组)和心肌缺血再灌注组(I/R组),每组20只。大鼠于洁净、干燥环境中适应性喂养7 d。
1.2 模型制备方法
制备心肌缺血再灌注致认知障碍模型。大鼠禁食12 h后进行麻醉[3%仙台病毒(SeV)诱导,2% SeV维持]。行光棒引导下气管插管,连接动物呼吸机行机械通气(频率60次/min,潮气量20 mL/kg,吸/呼比1∶2),经BL-420F生物机能实验系统行心电图(ECG)监测。参考文献[1],采用结扎左冠状动脉前降支(LAD)30 min后开放LAD的方法制备心肌缺血再灌注致认知障碍模型。经第3肋与第4肋间开胸,在左心耳根部与肺动脉圆锥之间用6-0丝线结扎LAD。结扎后ECG显示ST段抬高,结扎线以下心肌组织发绀,说明实现心肌缺血。30 min后去除丝线,恢复灌注,关闭胸腔,采用荷包缝合法缝皮。去除丝线后ECG显示ST-T段降低50%以上,先前缺血的心肌复红,表明实现心肌再灌注。S组仅穿线不结扎,U组不处理。
1.3 Morris水迷宫行为学试验
进行Morris水迷宫行为学试验。1)造模前连续6 d行定向航行训练(每日3次)检测大鼠空间学习、运动能力,平台固定于SE象限,大鼠在平台上学习30 s后,进入水迷宫水池中。经水浴池上方的摄像系统化软件跟踪记录其游泳速度和潜伏期,潜伏期上限设置为60 s,潜伏期≥60 s者均记为60 s并被引导至平台停留学习15 s。2)造模次日行空间探索试验检测造模后记忆水平变化。撤去平台,将系统识别平台位置设置为造模前试验平台区域。将大鼠随机放入水迷宫水池中,跟踪记录大鼠穿越平台的次数。
1.4 海马体Beclin1、微管相关蛋白轻链3Ⅱ(LC3Ⅱ)的蛋白表达检测
采用二喹啉甲酸(BCA)蛋白定量法检测海马体Beclin1、LC3Ⅱ的蛋白浓度,并采用蛋白免疫印迹法(Western Blot)检测Beclin1、LC3Ⅱ蛋白表达。空间探索试验后立即处死大鼠取海马体,加入RIPA裂解液研磨、超声粉碎,4℃下,13 000 r/min离心30 min,取上清液,经十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳、转膜后,脱脂牛奶4 ℃封闭2 h。加入一抗Beclin1(1∶1 000)、LC3Ⅱ(1∶1 000)4 ℃过夜后,用TBST漂洗后分别加入抗鼠(1∶500)、抗兔(1∶500),室温孵育90 min。TBST漂洗后经化学发光法显影,采用Image J软件分析,以条带灰度值反映Beclin1、LC3Ⅱ蛋白表达水平。
1.5 统计学处理

2 结 果
2.1 Morris水迷宫试验结果
定向航行试验:3组大鼠各时间点游泳速度和潜伏期比较差异均无统计学意义(P>0.05),且潜伏期逐日缩短。详见表1、图1。空间探索试验:U组穿越平台次数为(6.50±0.56)次,S组穿越平台次数为(4.60±0.43)次,I/R组穿越平台次数为(3.15±0.42)次。与U组比较,S组和I/R组穿越平台次数明显减少(P<0.05);与S组比较,I/R组穿越平台次数明显减少(P<0.05)。详见图2。
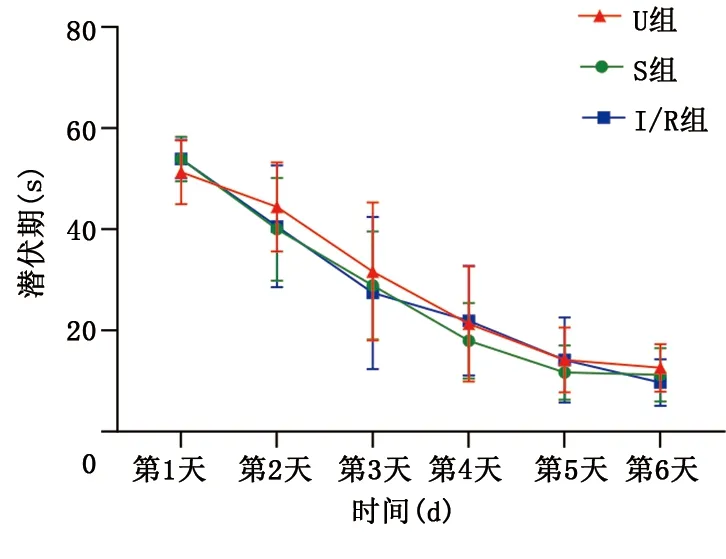
图1 3组定向航行试验潜伏期比较
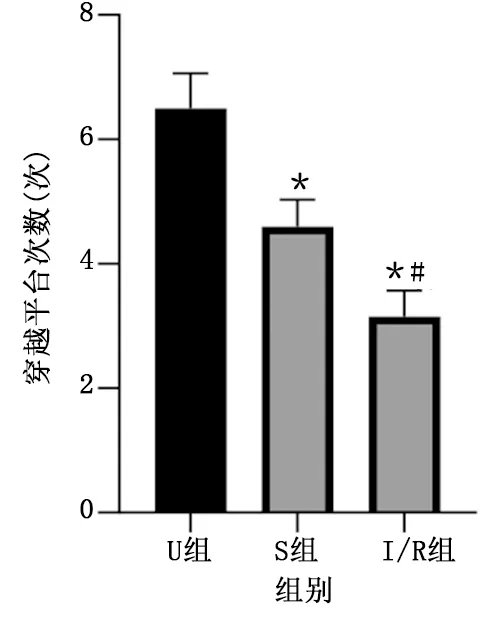
图2 3组穿越平台次数比较

表1 3组定向航行试验游泳速度比较(±s) 单位:cm/s
2.2 Western Blot检测大鼠海马体自噬相关蛋白表达情况
与U组比较,S组和I/R组海马体Beclin1、LC3Ⅱ蛋白表达上调(P<0.05);与S组比较,I/R组Beclin1、LC3Ⅱ蛋白表达上调(P<0.05)。详见图3。

图3 各组大鼠海马体Beclin1、LC3Ⅱ蛋白表达条带图
2.3 I/R组大鼠穿越平台次数与海马体自噬相关蛋白表达的相关性
Pearson相关分析结果显示,心肌缺血再灌注后大鼠在空间探索试验中穿越平台次数与Beclin1蛋白表达呈正相关(r=0.578,P<0.05),与LC3Ⅱ蛋白表达呈正相关(r=0.513,P<0.05)。
3 讨 论
Morris水迷宫试验是检验啮齿类动物神经认知疾病模型的典型方案,常用试验方法有定向航行试验和空间探索试验[6]。本研究通过参照文献[7],采用结扎LAD 30 min后开放LAD的方法建立心肌缺血再灌注致认知障碍模型,并利用Morris水迷宫试验检验模型制备情况。造模前,通过定向航行试验评价大鼠造模前的学习和运动能力,结果显示,3组大鼠各时间点游泳速度和潜伏期比较差异无统计学意义,潜伏期逐日缩短,表明造模前各组大鼠学习、运动能力相仿且确实形成了对平台所在空间位置的记忆,为大鼠心肌缺血再灌注后通过空间探索试验检验模型制备情况奠定基础,并排除大鼠学习记忆和运动能力低下对检验结果的影响。空间探索试验可评价大鼠长期记忆水平,本研究于心肌缺血再灌注次日进行空间探索试验,结果显示,心肌缺血再灌注后大鼠穿越平台次数较未经处理或假手术大鼠穿越平台次数明显减少,表明心肌缺血再灌注后大鼠出现认知水平下降,模型制备成功。
心肌缺血再灌注损伤会引发脑细胞线粒体功能障碍、蛋白异常聚集和神经元损伤[1,8]。自噬是细胞内异常蛋白质和细胞器的分解、清除代谢途径之一,可在应激状态下维持神经元活性[9]。LC3Ⅱ可参与自噬体形成,并介导自噬体与溶酶体融合,因其表达量与细胞中自噬体和自噬相关结构数量呈正相关,而广泛用于评估自噬活性[10]。Beclin1通过翻译后修饰参与调节自噬体形成和成熟过程,是调节细胞自噬活性的核心参与者[11-12]。本研究中,心肌缺血再灌注后大鼠脑海马体组织中自噬相关蛋白Beclin1和LC3Ⅱ表达较未经处理或假手术大鼠上调,表明大鼠心肌缺血再灌注过程伴随有脑海马体神经元自噬水平的提高。
自噬可以降解神经元内受损线粒体和异常蛋白质,也可以参与神经元的生长和成熟与突触的可塑性调节,从而维持神经元的活性和功能[4]。本研究应用Pearson相关性分析方法,探讨心肌缺血再灌注所致大鼠认知水平下降与大鼠脑海马体神经元自噬水平提高的关系,结果显示,心肌缺血再灌注后大鼠空间探索试验穿越平台次数与其脑海马体组织中自噬相关蛋白Beclin1和LC3Ⅱ蛋白表达均呈正相关,提示大鼠心肌缺血再灌注过程中伴随的脑海马体神经元自噬水平的提高可能有利于维持空间记忆、保护认知功能。有研究表明,可通过下调自噬相关抑制性受体增强小鼠海马体神经元自噬功能,减轻败血症相关性脑病及其认知缺陷[13]。也有研究表明,大鼠脑缺血再灌注1 h后海马体神经元自噬水平明显增强,而再灌注24 h后溶酶体相关功能障碍的出现会导致自噬通量受损,神经元损伤[14]。本研究中大鼠心肌缺血再灌注后虽有脑海马体神经元自噬水平的提高,但仍导致了不同程度的认知障碍,可能与神经元自噬水平提高不足或受限有关,其具体机制有待通过自噬激活剂干预或对自噬通量进一步研究。
综上所述,大鼠心肌缺血再灌注过程伴随有脑海马体神经元自噬水平的提高,且可能有利于减轻心肌缺血再灌注过程所致大鼠认知障碍。

