产胺菌拮抗菌的筛选鉴定及其抑菌物质特性研究
杨梓璐,石懿平,郑火建,李洪彪,汪立平,2,3*
(1.上海海洋大学 食品学院,上海 201306;2.上海海洋大学 食品热加工工程技术研究中心,上海 201306;3.农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306)
生物胺是具有生物活性的低分子量含氮化合物,广泛分布于食品,尤其是发酵食品中,如鱼露、豆豉、发酵香肠等。高浓度的生物胺会对人体健康产生影响,导致多种毒性作用[1]。大多数生物胺是由微生物产生的,因此腐败微生物是部分食品中生物胺的主要来源,当腐败菌在食品加工过程中成为优势菌时,食品中的生物胺容易出现过度积累[2]。因此,控制发酵过程中的生物胺含量非常重要。目前,食品中常用的生物胺控制方法主要有冷冻、辐照、超高压、添加山梨酸钾等防腐剂[3-4],但这些方法通常会对食品的风味、质量产生一定影响,并引发消费者对其安全的担忧。
乳酸菌作为公认的安全菌株,不仅有改善食品风味、提高营养价值的作用[5],还能产生细菌素抑制病原菌与腐败菌的生长[6],提高食品的安全。在发酵食品中接种能抑制生物胺产生菌活性的乳酸菌发酵剂,通过产生细菌素抑制产胺菌的生长,可以有效控制发酵食品中生物胺的积累[7-8],是非常有应用前景的生物胺控制方法。目前该方法已应用于发酵香肠和干酪的生产中[9-10],但在鱼露生产中的应用尚未见报道。
实验前期以南极磷虾为原料发酵得到了风味较好的高品质鱼露,但其中生物胺含量较高。结合高通量测序与平板分离的方法,从南极磷虾鱼露中筛选出2株产胺菌:金黄色葡萄球菌(StaphylococcusaureusXM2)和表皮葡萄球菌(StaphylococcusepidermidisXM3),其产组胺含量分别达到了(26.35±2.98)、(31.59±3.10)mg/kg,对发酵鱼露的安全造成了严重影响。实验以鱼露中产胺能力最高的菌S.epidermidisXM3为指示菌,从发酵食品中筛选产细菌素的乳酸菌,对其所产抑菌物质的抑菌谱和生物学特性进行研究,以期得到抑制产胺菌且不影响鱼露质量的安全菌株,为控制鱼露以及其他发酵食品中的生物胺含量提供理论基础。
1 材料与方法
1.1 实验材料
1.1.1 筛菌样品 实验所用泡菜来自吉林省长春市农家自制,香肠来自四川省宜宾市农家自制,鱼肠道来自上海市浦东新区古棕路菜市场。所有样品均在无菌环境中取样。
1.1.2 指示菌 采用S.epidermidisXM3,在农业部水产品贮藏保鲜质量安全风险评估实验室(上海)保藏。
1.1.3 试剂与培养基 试剂包括胰蛋白胨、碳酸钙、胰蛋白酶、木瓜蛋白酶、中性蛋白酶、α-淀粉酶、盐酸、氢氧化钠、乙酸乙酯等(国药集团化学试剂有限公司,分析纯)。培养基包括MRS(de Man,Rogosa and Sharpe)培养基、溶菌肉汤(Luria-Bertani,LB)培养基、酵母浸出粉胨葡萄糖(Yeast Extract Peptone Dextrose,YPD)琼脂培养基(广东环凯微生物科技有限公司)。
1.1.4 仪器与设备 包括拍击式均质机(上海松茂生物科技有限公司,JX-05),Ezup柱式细菌基因组DNA抽提试剂盒(生工生物工程(上海)股份有限公司),pH计(梅特勒-托利多仪器(上海)有限公司,FE28),可见分光光度计(尤尼柯(上海)仪器有限公司,7200),梯度聚合酶链式反应(polymerase chain reaction,PCR)(杭州朗基科学仪器有限公司,A300),电泳仪(北京市六一仪器厂,DYY-6C),双垂直电泳槽(北京君意东方电泳设备有限公司,JY-SCZ2+)。
1.2 实验方法
1.2.1 产胺菌拮抗乳酸菌的分离与初筛 取25g样品放入无菌均质袋中,加225mL生理盐水,用均质机处理10min。将无菌生理盐水梯度稀释,然后分别吸取不同稀释度的样品稀释液100μL涂布于含2% CaCO3的MRS固体培养基上,在37℃条件下培养48 h,挑选菌落生长密度合适的MRS平板进行下一步实验。
采用双层琼脂覆盖法[11]并进行一些改进,进行菌株的初筛。在菌落生长密度合适的MRS稀释涂布平板上倒1层含指示菌量为1×104CFU/mL的半固体培养基(含1%琼脂),在37℃条件下正置培养12h。培养结束后观察菌落周围是否产生抑菌圈与溶钙圈,对有抑菌圈和溶钙圈的菌株进行分离纯化和保藏。
1.2.2 产胺菌拮抗乳酸菌的复筛 将筛选得到的菌株接入MRS液体培养基中培养得到发酵液,离心后将上清液过膜,得到无细胞上清液。采用有机溶剂萃取法[12],利用相似相溶原理对菌株所产抑菌物质进行分离纯化。将乙酸乙酯与无细胞发酵上清液按体积比1∶1进行萃取以制备细菌素粗提取物。无细胞发酵上清液一次性全部加入,乙酸乙酯分为相等3份,依次加入,每加入1份后充分振荡、摇匀,待其静置分层后再加入下一份并重复上述步骤,直至全部加完。加入乙酸乙酯待其静置分层后,将上层萃取液合并进行旋转蒸发(温度为55℃,转速为60r/min)以除去乙酸乙酯。取旋转蒸发所得粗提物,加入适量的超纯水重悬,得到粗提物溶液,同时消除有机酸与过氧化氢的影响。
采用琼脂打孔法对菌株进行复筛[13]。在含菌量为1×104CFU/mL的半固体指示菌平板(含1%琼脂)上打孔并加入无细胞上清液或粗提物溶液,每个孔里注入50μL液体样品,在4℃条件下静置2h后再在37℃条件下正置培养12h。培养结束后观察是否形成抑菌圈,并测量抑菌圈大小。菌株的生物胺产生量参照Ma等[14]的方法,将菌株活化后接种至额外添加氨基酸(含量为5g/L)的培养基中培养48h,使用分光光度法测定发酵液中的生物胺含量,以未接种菌株的培养基为对照,确定菌株的生物胺产生能力。通过无细胞上清液和粗提物溶液的抑菌圈直径评价各菌株的抑菌活性,选择抑菌活性最佳且无产胺能力的菌株进行下一步实验。
1.2.3 菌株的鉴定 1) 形态学鉴定:将筛选得到的具有抑菌效果的菌株(记为XCX1)划线至MRS固体培养基上,在37℃条件下培养24h,观察菌落形态。进行革兰氏染色后,在光学显微镜下观察菌体的形态和染色结果。2) 分子生物学鉴定:使用Ezup柱式细菌基因组DNA抽提试剂盒提取DNA。以总DNA为模板,使用通用引物27F和1492R进行PCR扩增,使用1%琼脂糖凝胶电泳方法检测扩增产物质量,PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序。在美国国家生物技术信息中心(national center for biotechnology information,NCBI)网站上使用基于局部比对算法的搜索工具(basic local alignment search tool,BLAST)将测序所得的16S rDNA序列与数据库中的序列进行比对,使用 MEGA 5.0软件采用基于距离(distance-based)的邻接法(neighbor-joining)构建系统发育树,建树检验方法为步长检验(bootstrap method),检验次数为1000次,计算模型为Kimura 2参数模型(Kimura 2-parameter model),缺口数据部分删除(partial deletion),自展值(bootstrap value)范围为0%~100%,支持度以百分数略去百分号形式表示。将该菌株的 16S rDNA序列提交至GenBank数据库中。
1.2.4 抑菌谱的测定 采用打孔法测定菌株XCX1所产抑菌物质的抑菌谱[11]。选取表皮葡萄球菌、金黄色葡萄球菌(有2种不同来源)、枝芽孢杆菌、戊糖片球菌、腐生葡萄球菌、单增李斯特菌、大肠杆菌、副溶血性弧菌、沙门氏菌、嗜水气单胞菌、米曲霉、酿酒酵母和汉逊德巴利酵母14株菌株作为指示菌。
1.2.5 抑菌物质的理化及生物特性 取适量无细胞发酵上清液,分别按以下方式处理,测定菌株XCX1所产抑菌物质的热稳定性、酸碱稳定性、紫外线稳定性、金属离子稳定性和蛋白酶敏感性。1) 热稳定性:分别在0、10、20、30、40、50、60、70、80、90、100、121℃温度下处理10min和30min。2) 酸碱稳定性:分别调节pH值至2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0,在37℃条件下水浴2h,之后再将pH值调回至7.0并用无菌水定容至相同体积。3) 紫外线稳定性[15]:将样品置于30W紫外灯下,在90cm处分别照射10、20、30、40、50、60min。4) 金属离子稳定性:在样品中分别加入NaCl、KCl、MgCl2、CaCl2、ZnCl2溶液,使体系中的Na+、K+、Mg2+、Ca2+、Zn2+摩尔浓度为10mmol/L。5) 蛋白酶敏感性:向样品中分别加入用磷酸盐缓冲液(phosphate buffered saline,PBS)配制的胃蛋白酶、胰蛋白酶、中性蛋白酶、α-淀粉酶、木瓜蛋白酶和蛋白酶K溶液,使溶液中各蛋白酶的最终质量浓度为1mg/mL,再调节pH值至各种酶的最适pH值,在37℃条件下水浴2h,之后再将pH值调回7.0并用无菌水定容至相同体积。
以S.epidermidisXM3为指示菌,以未处理的无细胞发酵上清液为对照,按照1.2.2节中的方法测定抑菌效果。
1.3 数据处理
所有实验平行进行3次,结果以平均值±标准差表示。采用SPSS Statistics 18.0软件分析数据,并用F检验进行差异显著性分析,使用Tukey检验进行多重比较。使用 OriginPro 8.1软件作图。
2 结果与讨论
2.1 产胺菌拮抗菌的筛选
利用双层琼脂覆盖法,以鱼露中的产胺菌S.epidermidisXM3作为指示菌,分别从泡菜、香肠、鱼肠道等样品中共分离出近40株具有抑菌效果的菌株,分离纯化后分别制取无细胞上清液,得到4株对S.epidermidisXM3具有较好拮抗作用的菌株。为排除过氧化氢和有机酸对抑菌效果的影响,利用乙酸乙酯萃取法对上清液中的抑菌物质粗提取,并进行抑菌实验,结果如表1所示。由表1可知,菌株XCX1的上清液和粗提液对S.epidermidisXM3均有较好的拮抗作用。检测菌株XCX1的产胺能力,结果表明其不产生组胺,最终确定对抑菌活力最佳的菌株XCX1开展后续研究。

表1 样品中拮抗菌对S.epidermidis XM3的抑制作用Tab.1 Inhibitory effect of antagonistic bacteria on S.epidermidis XM3
2.2 菌株XCX1的鉴定
2.2.1 形态学观察 菌株XCX1在MRS固体培养基上的形态学观察结果如图1所示。由图1可知,菌株XCX1菌落为圆形、微白色(图1(a)),表面光滑、湿润、凸起,边缘整齐,不透明,背面为黄色(图1(b)),菌落周围有溶钙圈(图1(c))。光学显微镜下观察结果如图1(d)所示,结果表明该菌为长杆状,多成短链状排列,为革兰氏阳性菌,不产芽孢,不运动,没有鞭毛。

图1 菌株XCX1的形态学观察Fig.1 Morphological features of strain XCX1
2.2.2 分子生物学鉴定 分子生物学鉴定结果如图2所示。由图2可知,菌株XCX1的16S rDNA在1000~2000碱基对(base pair,bp)处有1条清晰的条带,测序后得到全长约1431bp的基因序列。经BLAST同源性比对,结果表明菌株XCX1的16S rDNA序列与弯曲乳杆菌(Lactobacilluscurvatus)同源性高达99%。

图2 菌株XCX1的PCR扩增产物电泳图
利用MEGA 5.0构建系统发育树,结果如图3所示。由图3可知,该菌株与弯曲乳杆菌聚为一支,结合形态学观察结果,鉴定菌株XCX1为弯曲乳杆菌,将其命名为L.curvatusXCX1。获得GeneBank数据库登录号为OQ626370。
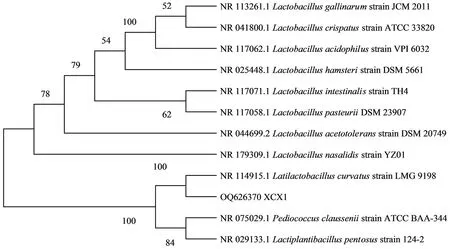
注:枝上数字为支持度,以略去百分号的百分数表示。 图3 菌株XCX1基于16S rDNA基因序列构建的系统发育树
2.2.3 菌株XCX1的抑菌谱 采用琼脂扩散法测定L.curvatusXCX1抑菌物质的抑菌谱,共测14株指示菌,包括鱼露中分离得到的产胺菌、产蛋白酶菌以及几种常见的革兰氏阳性菌、革兰氏阴性菌和酵母菌,结果如表2所示。由表2可知,L.curvatusXCX1对鱼露中产胺能力最高的2个菌株S.aureusXM2和S.epidermidisXM3有抑制作用,而对鱼露中产蛋白酶能力最高的菌VirgibacillusdokdonensisXM4无抑制作用。因此判断,L.curvatusXCX1可作为鱼露中主要产胺菌的拮抗菌,能控制鱼露中生物胺的积累且不影响鱼露的质量。

表2 菌株XCX1所产抑菌物质的抑菌谱Tab.2 Antimicrobial spectrum of antibacterial substances produced by strain XCX1
另外,表2中数据证明L.curvatusXCX1对供试的大部分菌株均有抑制效果,其中5株革兰氏阳性菌的抑菌圈直径达到(7.91±0.08)~(19.22±0.24)mm,4株革兰氏阴性菌抑菌圈直径达到(12.50±0.11)~(19.02±0.16)mm,细菌中对冷藏食品中常见腐败菌单增李斯特菌的抑制效果最好;然而,L.curvatusXCX1对益生菌枝芽孢杆菌、戊糖片球菌以及真菌酿酒酵母和汉逊德巴利酵母无抑制作用。
实验结果表明,L.curvatusXCX1能够抑制一些常见的食源性致病菌、水产致病菌,同时,相比于Heidari等[16]和任丽等[17]报道的弯曲乳杆菌所产抑菌物质的抑菌谱,L.curvatusXCX1所产抑菌物质的抑菌谱更广。
2.2.4 菌株XCX1所产抑菌物质的理化及生物特性 以S.epidermidisXM3为指示菌,测定L.curvatusXCX1所产抑菌物质在不同理化条件处理下抑菌活性的变化,结果如图4所示。

(a) 温度 (b) pH值
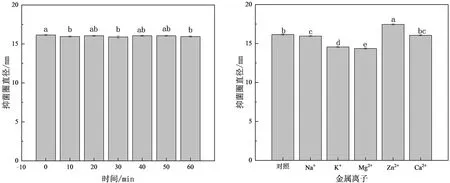
(c) 紫外线照射时间 (d) 金属离子注:不同小写字母表示差异显著 (P<0.05)。图4 不同因素对菌株XCX1所产抑菌物质活性的影响Fig.4 Effect of different factors on activity of antibacterial substances produced by strain XCX1
1) 热稳定性:由图4(a)可知,L.curvatusXCX1所产抑菌物质具有良好的热稳定性,在0℃~121℃条件下均能保留大部分抑菌活性,推测是因为该抑菌物质具有较为稳定的结构。在121℃条件下处理30min时,抑菌活性最低,与对照组相比有所降低,说明L.curvatusXCX1所产抑菌物质的热稳定性良好,在高压灭菌的处理条件下仍然具有一定的抑菌活性。因此,其在食品加工领域具有一定的应用前景,能够与高压杀菌的方式相结合用于食品加工。2) 酸碱稳定性:由图4(b)可知,L.curvatusXCX1所产抑菌物质在pH值为2.0~8.0时抑菌活性较好,当pH值大于10.0时抑菌活性出现显著性下降(P<0.05),但仍保持了不低的抑菌活性;表明该抑菌物质在酸性和中性环境中稳定性较好,甚至能够耐受极端酸环境,但在强碱性环境下稳定性较差,活性会受到抑制。因此,L.curvatusXCX1所产抑菌物质在低pH值环境中的良好稳定性对于其在酸性、中性和弱碱性条件下食品加工中的应用非常重要。3) 紫外线稳定性:由图4(c)可知,当紫外线照射10~60min时,对L.curvatusXCX1所产抑菌物质的抑菌活性影响很小,说明该抑菌物质具有良好的紫外线稳定性,这表示在食品加工过程中,可以将其与传统的紫外线杀菌方式相结合,以达到更好的效果。4) 金属离子稳定性:由图4(d)可知,不同金属离子对L.curvatusXCX1所产抑菌物质的抑菌活性影响程度不同,如Na+和Ca2+对抑菌活性几乎没有影响,K+和Mg2+对抑菌活性有轻微的抑制效果,而Zn2+能增强抑菌活性。
不同蛋白酶处理对L.curvatusXCX1所产抑菌物质抑菌活性的影响如表3所示。由表3可知,所有蛋白酶处理后,抑菌活性均出现了不同程度下降。α-淀粉酶和木瓜蛋白酶处理后,抑菌活性有所下降;而胰蛋白酶、胃蛋白酶、中性蛋白酶以及蛋白酶K处理后,抑菌活性完全丧失,说明该抑菌物质对这4种酶的敏感性较高。这可能是因为该抑菌物质为蛋白类或肽类物质,具有细菌素的常见特性,初步分析其是某种低分子量的细菌素;而这些蛋白酶能够破坏该抑菌物质中的活性部分。由于该抑菌物质对各种蛋白酶较为敏感,而人体消化道中都存在这4种蛋白酶,因此表明,该抑菌物质不会在人体内残留,当作为防腐剂或发酵剂在食品加工中添加时具有一定的安全性。
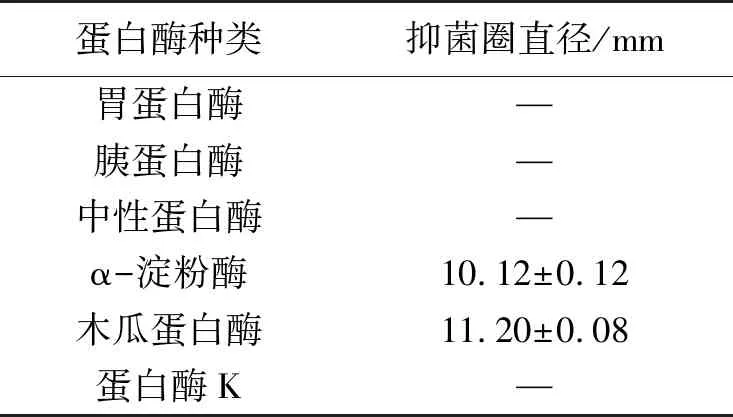
表3 菌株XCX1所产抑菌物质的酶敏感实验Tab.3 Enzyme sensitivity test of antibacterial substances produced by strain XCX1
3 结论
从发酵食品中筛选出1株产胺菌的拮抗菌株,结合形态学观察与16S rDNA检测鉴定该菌株为弯曲乳杆菌(L.curvatusXCX1)。其所产抑菌物质能够抑制鱼露中产胺菌的生长,而对鱼露中的产蛋白酶菌无抑制作用,因此可作为鱼露中产胺菌的拮抗菌,控制鱼露中生物胺的积累。实验表明,该菌株所产抑菌物质对绝大多数指示菌具有较好的抑菌作用,对供试的所有革兰氏阴性菌均具有较好的抑菌活性,对除枝芽孢杆菌(VirgibacillusdokdonensisXM4)、戊糖片球菌(PediococcuspentoseSL47)外的革兰氏阳性菌也都具有较好的抑菌活性,还能够抑制真菌中的米曲霉(AspergillusoryzaeYL001),可见L.curvatusXCX1所产抑菌物质具有广谱抑菌作用。此外,L.curvatusXCX1所产抑菌物质具有良好的热稳定性和紫外线稳定性,可耐受高压灭菌与紫外辐射;也具有较好的酸碱耐受性,活性pH值范围为2.0~8.0,有利于其在食品加工中的应用;L.curvatusXCX1使用安全性高,经6种蛋白酶处理后,所产抑菌物质的抑菌活性出现不同程度的下降,表明该抑菌物质为蛋白类或肽类物质,具有细菌素的常见特性,且对人体应具有一定的安全性。下一步将继续研究L.curvatusXCX1所产抑菌物质的结构与作用机制,进行全基因组测序以挖掘其潜在的细菌素基因簇,并进一步探究其作为新型发酵剂在提高食品安全方面的作用,为其在鱼露及其他发酵食品加工中的应用提供更多理论依据。

