枯草芽孢杆菌细菌素A32的抑菌机理研究
高娟娟,贾丽艳*,畅盼盼,田宇敏,甄晓君,王恬恬
(1 山西农业大学食品科学与工程学院 山西太谷 030801 2 山西省白酒生物工程研究生教育创新中心 山西太谷 030801)
在食品加工、运输、贮藏过程中经常会受到微生物的污染,使食品腐烂变质,造成巨大的经济损失[1]。目前,防止食品的腐败变质常用的方法是添加化学防腐剂[2],然而,使用化学防腐剂存在影响人类健康的隐患。开发绿色、安全、高效的天然防腐剂成为人们关注的热点[3]。近年来,细菌素作为绿色生物防腐剂的研究较多[4-5],特别是对乳酸菌所产细菌素的理论和应用研究。然而,乳酸菌产细菌素的抑菌谱较窄,主要是抑制革兰氏阳性菌,这限制了其的广泛应用[6]。为此,开发广谱细菌素成为亟待解决的问题。
枯草芽孢杆菌细菌素A32(简称细菌素A32)是本课题组由从山西老陈醋新鲜醋醅中分离筛选的枯草芽孢杆菌HJD.A32 发酵产生的抑菌蛋白[7-8],可通过酸沉淀法获得[9]。细菌素A32 具有广谱的抑菌性,对多种革兰氏阳性菌和革兰氏阴性菌都具有抑制作用,对温度、pH 值、表面活性剂等均具有一定的耐受性,对胰蛋白酶、胃蛋白酶等具有敏感性[8],具有一定的食用安全性,对人体不会造成危害,适合应用于不同食品加工中。研究细菌素A32的抑菌机理,可为该细菌素作为绿色生物防腐剂的开发利用提供理论基础。
1 材料与方法
1.1 菌株、材料及试剂
枯草芽孢杆菌HJD.A32(Bacillus subtilis),分离自山西老陈醋新鲜醋醅,保藏于中科院微生物菌种保藏中心,编号为CGMCC6624;大肠杆菌(Escherichia coli)CGMCC44102、金黄色葡萄球菌(Staphylococcus aureus)CGMCC26003,中国普通微生物菌种保藏管理中心。发酵液培养基[10]:葡萄糖1 g,酵母浸膏1 g,蒸馏水100 mL。牛肉膏蛋白胨培养基[11]:牛肉膏0.5 g,蛋白胨1 g,NaCl 0.5 g,琼脂2 g,蒸馏水100 mL,pH 7.2~7.4。牛肉膏蛋白胨液体培养基[11]:牛肉膏0.5 g,蛋白胨1 g,NaCl 0.5 g,蒸馏水100 mL,pH 7.2~7.4。
过氧化氢酶,北京solarbio 公司;碱式磷酸酶,南京建成生物工程研究所;其它试剂均为分析纯级。
1.2 仪器与设备
Centrifuge5417 R 高速冷冻离心机、Centrifuge5804 R 高速冷冻离心机,德国Eppendorf 公司;GZX-GF101-3-BS-Π/H 电热恒温鼓风干燥箱,上海跃进医疗器械有限公司;HPX-9272MBE电热恒温培养箱、YXQ-LS-75SⅡ立式压力蒸汽灭菌器、SW-CJ-2FD 净化工作台,上海博讯实业有限公司医疗设备厂;ZWYR-2102C 恒温培养振荡器,上海智成分析仪器制造有限公司。
1.3 方法
1.3.1 细菌素A32 的制备 将培养48 h 的枯草芽孢杆菌HJD.A32 菌液400 r/min 离心10 min,获取上清液。用6 mol/L 盐酸,调节pH 值至2.0,4℃,静置24 h;4 ℃,12 000 r/min,离心20 min,收集沉淀;真空冷冻干燥,条件为:冷肼温度-35~-40℃,板温25 ℃,真空度30~40 Pa。待干燥后,-20℃条件下保藏,备用。
1.3.2 细菌素A32 对指示菌的抑菌性及MIC 浓度测定 采用双层牛津杯法[9]及二倍倍比稀释法[12]。用0.2 mol/L(pH 5.7)的磷酸缓冲液溶解细菌素A32,配制质量浓度分别为80,40,20,10,5 mg/mL 的细菌素溶液。取200 μL 溶液,以大肠杆菌和金黄色葡萄球菌为指示菌,做抑菌试验,观察抑菌效果,确定其对指示菌的最小抑菌浓度(Minimum inhibitory concentration,MIC)。
1.3.3 指示菌菌悬液的制备 将对数生长期大肠杆菌和金黄色葡萄球菌采用倍比稀释法稀释,获得菌体浓度为106CFU/mL 指示菌菌悬液。
1.3.4 指示菌生长曲线的测定 将0.2 mL 不同质量浓度的细菌素A32 加入指示菌菌悬液中,130 r/min,37 ℃培养,每隔2 h 测定OD600nm值,连续测定24 h。以未经细菌素处理菌悬液作为对照。以时间为横坐标,OD600nm为纵坐标,绘制生长曲线[13]。
1.3.5 可溶性总糖含量的测定 采用蒽酮法[14]。以未经细菌素处理的菌悬液的上清液为对照。
1.3.6 磷含量的测定 向指示菌菌悬液中加入5 mL 质量浓度为1 mg/mL 的葡萄糖溶液和1 mL 质量浓度为0.04 mg/mL 的磷标准溶液,分别加入不同质量浓度细菌素A32 0.5 mL,充分摇匀后置于37 ℃,130 r/min 培养0,2,4,6,8,10,12 h 后,取出1 mL 于离心管,加入5 mL 三氯乙酸-硫酸亚铁,静置10 min,4 000 r/min,5 min,取上清液于试管中,加0.5 mL 钼酸铵溶液处理后,30 ℃恒温水浴15 min,冷却后在630 nm 波长处测吸光值[15]。以未经细菌素处理的菌悬液的上清液为对照。
1.3.7 菌体形态的测定 参考Wang 等[16]的方法。
1.3.8 细胞膜渗透性的测定 将0.2 mL 不同质量浓度的细菌素A32 加入到指示菌菌悬液中,130 r/min,37 ℃分别培养0,2,4,6,8,10,12 h 后,取4 mL 菌悬液,4 000 r/min 离心10 min;取上清液,测定OD260nm值。以未经细菌素处理的菌悬液的上清液为对照。
1.3.9 细胞膜通透性的测定 采用电导率法[17],以未经细菌素处理的菌悬液的上清液为对照。
1.3.10 细胞膜完整性的测定 采用考马斯亮蓝法[18]。
1.3.11 AKP 含量的测定 将0.2 mL 不同质量浓度的细菌素A32 加入到指示菌菌悬液中,130 r/min,37 ℃处理0,2,4,6,8,10,12 h,取菌悬液,4 000 r/min 离心10 min,用碱性磷酸酶试剂盒方法测定上清液AKP 的含量[19]。以未经细菌素处理的菌悬液的上清液为对照。
1.3.12 蛋白质SDS-PAGE 检测 将质量浓度为80 mg/mL 细菌素1 mL 加入到指示菌菌悬液中,130 r/min,37 ℃培养12 h。4 ℃,12 000 r/min,3K 超滤管离心,收集沉淀,并悬浮于1 mL 无菌蒸馏水中。按体积比1∶2 加入样品缓存溶液,混匀后用沸水浴煮沸5 min,取20 μL,在15%的分离胶和5%的浓缩胶,稳定电压150 V 的条件下进行SDSPAGE 电泳[20]。利用BIO-RAD 凝胶成像仪得到图像。
1.4 数据统计分析
2 结果与分析
2.1 细菌素A32 的抑菌性及MIC
对通过酸沉淀获得的细菌素A32 进行抑菌性及MIC 测定。结果见图1、表1。pH 2 的盐酸溶液能够将细菌素沉淀下来,相同质量浓度的细菌素对金黄色葡萄球菌的抑菌性优于对大肠杆菌的抑菌性;在细菌素的质量浓度为80 mg/mL 时,抑制大肠杆菌和金黄色葡萄球菌的抑菌圈直径可分别达到(15.13±0.14)mm,(17.87±0.11)mm;当质量浓度为0.625 mg/mL 时,抑菌圈消失,表明细菌素A32 的MIC 为1.25 mg/mL。

图1 酸沉淀法提取的细菌素A32 的抑菌活性Fig.1 The inhibitory activities of A32 getting by acid precipitation method
2.2 细菌素A32 对指示菌生长曲线的影响
在适宜的生长条件下,菌体生长会出现4 个阶段:延缓期、对数期、稳定期、衰亡期。由图2可知,与对照组相比,随着细菌素A32 质量浓度的升高,OD600nm值逐渐降低,指示菌生长延缓期逐渐延长,各生长阶段也随之推后。以上结果表明,经不同质量浓度细菌素A32 处理的大肠杆菌和金黄色葡萄球菌,生长繁殖均受到不同程度的抑制,且随着细菌素质量浓度的升高,生长繁殖受到的影响加剧。

图2 细菌素A32 对指示菌生长曲线的影响Fig.2 Effect of bacteriocin A32 on growth curve of bacteria
2.3 细菌素A32 对指示菌悬浮液中可溶性总糖含量的影响
糖类是细菌生长主要的碳源和能量来源。细菌处于正常的生理状态时,会利用环境中的糖类物质,供菌体生长繁殖,当膜结构被破坏时,细胞内糖类物质外泄,导致环境中糖类物质升高。通过指示菌菌悬液中总糖含量的变化,可间接反映细胞膜结构的完整性[21]。由图3可知,随着培养时间的延长,空白对照溶液可溶性总糖含量几乎不变。经不同质量浓度细菌素A32 处理0~4 h,指示菌菌悬液中可溶性总糖含量逐渐升高,表明指示菌的细胞膜通透性发生了改变,细胞内糖类物质外渗。4 h 后可溶性总糖含量均有不同程度下降,说明细菌又开始增殖,利用培养基中的糖类物质。以上结果表明细菌素A32 对大肠杆菌和葡萄球菌膜结构均具有一定的破坏性。

图3 细菌素A32 对指示菌菌悬液中可溶性总糖含量的影响Fig.3 Effects of bacteriocin A32 on soluble total sugar content of the bacteria
2.4 细菌素A32 对指示菌磷代谢的影响
磷是微生物体内核酸、磷脂及糖代谢中间产物的重要组成成分,在细胞的能量代谢中起重要作用。通过测定微生物细胞代谢活动时磷的消耗情况,能够反映微生物细胞的整体代谢功能及其生长情况[22-23]。由图4可知,随着培养时间的延长,空白对照组的磷含量呈明显下降趋势,表明指示菌消耗了培养液中所添加的磷,对磷进行正常的代谢活动。加入细菌素A32,指示菌中的磷消耗量随着培养时间的延长而逐渐降低,磷含量变化趋势相对变缓,表明指示菌磷消耗受到了影响,微生物代谢和生长受到影响。

图4 细菌素A32 对指示菌总磷含量的影响Fig.4 Effect of bacteriocin A32 on total phosphorus content of bacteria
2.5 细菌素A32 对指示菌细胞结构的影响
由图5A 可知,培养12 h,未经细菌素A32 处理的大肠杆菌菌体外部光滑,细胞形态完好,细胞之间界限清晰。经10 mg/mL 的细菌素A32 处理后,大肠杆菌表面变得粗糙,有孔洞形成;当质量浓度升高到20 mg/mL 时,菌体细胞严重破裂,不具备完整的细胞形态,有明显的孔洞。由图5B 可知,培养12 h,未经处理的金黄色葡萄球菌胞体呈立体球状且饱满,细胞表面完整、光滑;经10 mg/mL 的细菌素A32 处理后,金黄色葡萄球菌菌体表面凹凸不平,出现了少量的溶出物,当质量浓度升高到20 mg/mL,菌体变形严重,有明显的孔洞。表明细菌素A32 能够破坏革兰氏阴、阳性细菌的被膜系统,可导致细菌形态改变,细胞内容物外流。

图5 细菌素A32 对指示菌结构的影响Fig.5 Effects of bacteriocin A32 on the structure of bacteria
2.6 细菌素A32 对指示菌细胞膜渗透性的影响
细胞膜可以防止外源物质进入,也可以阻止菌体内部物质流出[24],当细菌细胞膜受到损伤后,细胞内的小分子物质首先渗透到细胞外,然后是核酸等大分子物质向外渗出[25]。溶液中核酸的含量常被作为评价细胞膜完整性的指标[26]。由图6可知,对照组指示菌OD260nm值随着时间的推移,没有明显变化,说明对照组没有细胞内容物质溢出;经不同质量浓度细菌素A32 处理,指示菌菌悬液随着时间的延长,OD260nm值逐渐升高,说明细菌素A32 导致了指示菌细胞内大分子物质流出,影响细胞的正常生长,从而抑制了指示菌的繁殖;随着细菌素浓度的增加,对指示菌的影响增大。比较相同浓度的细菌素A32 处理的金黄色葡萄球菌和大肠杆菌菌悬液的结果发现,金黄色葡萄菌中OD260nm值变化大于在大肠杆菌中的变化,表明细菌素A32 对金黄色葡萄球菌菌悬液的破坏高于大肠杆菌菌悬液。

图6 细菌素A32 对指示菌细胞膜渗透性的影响Fig.6 Effect of bacteriocin A32 on the permeability of the cell membrane of the bacteria
2.7 细菌素A32 对指示菌细胞膜完整性的影响
由图7可知,经不同质量浓度的细菌素A32处理指示菌菌悬液,可溶性蛋白含量变化趋势相同。处理0~2 h,可溶性蛋白含量有较大幅度的降低,2~6 h 可溶性蛋白含量增加,6 h 后可溶性蛋白含量基本保持不变。说明细菌素A32 可以改变大肠杆菌和金黄色葡萄球菌的通透性,使蛋白质渗透到膜外。随着细菌素A32 质量浓度的增大,可溶性蛋白也随之增大,说明浓度越高,对细胞膜的破坏性越大。
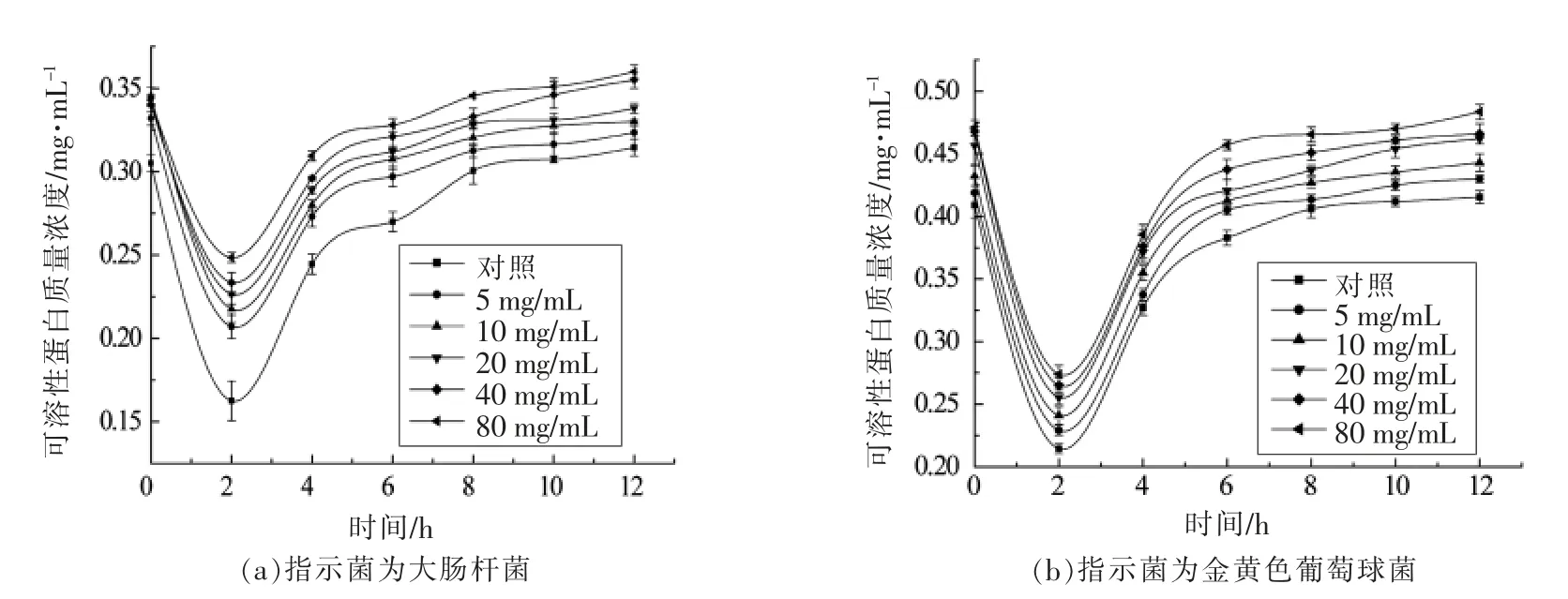
图7 细菌素A32 对指示菌细胞膜渗透性的影响Fig.7 Effect of bacteriocin A32 on the permeability of the cell membrane of the bacteria
2.8 细菌素A32 对指示菌细胞膜通透性的影响
细胞膜是细菌的一层保护屏障,当强抑制剂破坏细胞膜时,细菌的保护屏障被打破,使其内部的电解质,如钾离子等渗透到了细胞外的培养液中,使其培养液的电导率上升,电解质外渗导致细胞内多种代谢途径受阻,影响菌体的生长[2]。不同质量浓度的细菌素A32 对大肠杆菌和金黄色葡萄球菌的细胞膜的通透性均有一定的影响。由图8可知,加入细菌素A32,培养0~1 h 后,指示菌溶液的电导率显著增大,说明细菌素A32 在1 h 内的抑菌作用明显。随着细菌素A32 质量浓度的增大,电导率也随之增大,说明细菌素浓度越高,对细胞膜的破坏性越大。造成以上原因可能是由于细菌素作用于大肠杆菌和金黄色葡萄球菌后,使细菌细胞膜遭到破坏,通透性增大,细胞内Na+、K+等电解质外渗到培养液中,使菌液电导率增加。在相同处理时间测定电导率,发现电导率均明显高于空白对照组,且金黄色葡萄球菌菌悬液的电导率值大于大肠杆菌菌悬液,表明细菌素A32 对金黄色葡萄球菌菌悬液细胞膜通透性的破坏高于大肠杆菌菌悬液。

图8 细菌素A32 对指示菌细胞膜通透性的影响Fig.8 Effects of bacteriocin A32 on cell membrane permeability of the bacteria
2.9 细菌素A32 对指示菌细胞壁的影响
指示菌菌液中AKP 的含量变化可反应指示菌细胞壁的损伤情况[27]。由图9可知,经不同质量浓度的细菌A32 处理后,与对照组相比,指示菌上清液中AKP 的含量均有所增加,并且随着质量浓度的增加而增大;大肠杆菌菌悬液经细菌素A32处理0~10 h 内,AKP 含量逐渐增加,10 h 后,AKP含量保持稳定;金黄色葡萄球菌菌悬液经细菌素处理0~8 h 内,AKP 含量逐渐增加,8 h 后,AKP 含量保持稳定;细菌素A32 对大肠杆菌和金黄色葡萄球菌的影响不同,当等量细菌素处理指示菌时,金黄色葡萄球菌的菌悬液中AKP 的含量大于大肠杆菌菌悬液中的含量,表明细菌素A32 对革兰氏阳性菌金黄色葡萄球菌的细胞壁的影响强于对革兰氏阴性菌大肠杆菌的影响。其原因可能与2种菌在细胞壁结构组成上的差异有关[28]。
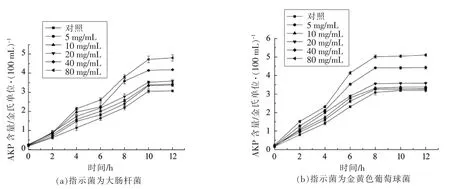
图9 细菌素A32 对指示菌细胞壁的影响Fig.9 Effects of bacteriocin A32 on the cell wall of the bacteria
2.10 细菌素A32 对指示菌蛋白质合成的影响
由图10可知,与对照组相比,经质量浓度80 mg/mL 细菌素A32 处理的大肠杆菌和金黄色葡萄球菌的蛋白质电泳条带只剩下几条清晰的条带,其余条带颜色较浅或没有。表明质量浓度为80 mg/mL 的细菌素A32 处理指示菌会影响细菌蛋白质的合成,推测细菌素导致指示菌菌体细胞膜破裂,菌体内容物发生泄露,从而抑制了菌体蛋白质的正常表达。

图10 细菌素A32 对指示菌蛋白质合成的影响Fig.10 Effects of bacteriocin A32 on protein synthesis of bacteria
3 结论
结果表明,细菌素A32 对大肠杆菌和金黄色葡萄球菌具有一定的抑菌性,MIC 为1.25 mg/mL;细菌素A32 可以使得指示菌生物量下降,对指示菌的生长曲线具有一定影响;随着细菌素质量浓度的升高,指示菌延缓期逐渐向后推迟;细菌素A32 能使指示菌菌悬液中可溶性总糖含量升高,指示菌无法进行正常的磷代谢,细胞壁和细胞膜受损、表面破裂、内容物外泄;使得指示菌蛋白质表达受到影响,导致蛋白质缺失或含量下降。推测细菌素A32 对大肠杆菌和葡萄球菌的抑菌机制均主要体现在细菌素通过在敏感菌的细胞膜上形成孔洞,使细胞内容物外泄,细胞内代谢受到影响。本研究将为细菌素A32 作为绿色、天然生物防腐剂应用于食品防腐保鲜中提供理论依据。

