头针针刺对血管性痴呆大鼠行为及海马体胆碱能抗炎通路的影响
李 忍,叶宇旋,周蔚华
(深圳市宝安区中医院,广东 深圳 518133)
血管性痴呆(Vascular dementia,VD)是一种认知功能障碍性疾病,主要致病原因是脑血管发生病变,其发病率仅次于阿尔兹海默症病的第二大类型痴呆症,在痴呆患者总人数中占比15%~20%,部分发展中国家或地区可达30%。随着全球人口老龄化,VD发病率明显上升[1]。研究表明VD具有可逆性,但由于病因复杂,目前尚未清楚其发病机制,故临床仍缺少针对的特异性治疗方法和药物。炎症反应在VD发病和进展中发挥重要作用,可引起胆碱能神经元损伤并造成认知功能障碍[2]。Custodero等[3]通过一项荟萃分析显示VD患者脑脊液白介素-6(Interleukin-6,IL-6)水平显著升高,而IL-6的升高可致VD发病风险显著增加[OR=1.28,95%CI:(1.03~1.59)]。机体内的胆碱能抗炎通路(Cholinergic anti-inflammatory pathway,CAP)可通过神经反射抑制全身炎症反应,其中乙酰胆碱与巨噬细胞表面受体结合可通过NF-κB信号通路抑制肿瘤坏死因子-α(TNF-α)和白介素-6(IL-6)等促炎因子的表达引起抗炎作用的产生,因此CAP可作为VD治疗靶点[4-6]。本研究拟通过建立大鼠VD模型,探讨头针对大鼠行为的影响并分析CAP及相关炎症因子表达水平。
1 材料与方法
1.1 实验动物 选取94只健康雄性Sprague-Dawley(SD)大鼠,来自广东省医学实验动物中心,许可证号SCXK(粤)2003-0002,月龄4~5个月,体重180~220 g。所有大鼠于广东省中医院中心实验室适应性饲养1周。室温20~25 ℃,相对湿度55%,每12小时昼夜交替。
1.2 主要仪器和试剂 400R低温离心机(德国HeraeuS);722型可见光分光光度计(上海市第三分析仪器厂);Multiskan MK3型酶标仪(芬兰Thermo Labsystem公司);HH-4数显恒温水浴锅(常州国华电器有限公司);Biofuge-28RS型高速冷冻离心机、DY89-1电动玻璃匀浆机(宁波市新芝科器研究所生产);DS-88型托盘天平(武汉市自动化工仪表厂生产);TGL-16C离心机(德国HeraeuS公司);JY3002型电子天平(上海市精密科学仪器有限公司);DYY-2稳压稳流电泳仪(北京市六一仪器厂);ProTEAN Ⅱ Xi cell电泳槽(美国Bio-RAD公司);TY-80B水平脱色摇床(上海浦东物理光学仪器厂);低温冰箱(南京伯乐电器集团);S2-93自动双重纯水蒸馏器(上海市亚荣生化仪器厂);MIAS医学图象分析仪(南京奥康分析仪器有限公司);Motic B5显微摄像系统(麦克奥迪实业集团公司);水合氯醛(上海市五联化工厂);亚硝酸钠(天津市四通化工厂);无水乙醇(郑州化学试剂二厂);胆碱乙酰转移酶(ChAT)试剂盒、乙酰胆碱酯酶(AChE)试剂盒、放射免疫沉淀试验(Radioimmunoprecipitation assay,RIPA)裂解液、考马斯亮兰蛋白试剂盒、TNF-α、IL-1β、IL-10、转化生长因子-β(TGF-β)定量ELISA试剂盒、兔抗鼠核因子-κB(NF-κB)抗体、辣根过氧化物酶(Horseradish peroxidase,HRP)标记羊抗兔IgG二抗、硝酸纤维素(Nitrocellulose,NC)膜、PBS、构橡酸盐缓冲液(深圳晶赛生物技术有限公司)。
1.3 大鼠VD模型建立 所有大鼠适应性喂养7 d后开展水迷宫测试,然后制备大鼠VD模型采用改良Pulsinelli四血管阻断法,术前常规禁食12 h,禁水4 h,使用10%水合氯醛腹腔注射以麻醉大鼠,剂量0.3 ml/100 g,将麻醉后的大鼠固定于操作板上并呈俯卧位状态,施术区进行备皮、杀菌消毒,以第2颈椎棘突为中心在大鼠背侧后颈部作一2 cm垂直切口,按顺序切开皮肤以及皮下组织,将颈后部肌群进行逐层钝性分离直至寰椎椎板处,在大鼠翼孔被暴露以后,朝向大鼠头部方向将直径0.5 mm的电烙针插入翼孔,深度约2 mm,对大鼠椎动脉进行间断性烧灼并维持5~8 s(可重复灼烧,但一般不超过3次),灼烧至大鼠翼孔周围的骨质逐渐呈现为苍白色并且无血性液体流出时停止,之后对大鼠两侧颈动脉进行烧灼以及造成血管腔闭塞,在上述操作完成后为预防感染应使用0.9%氯化钠溶液冲洗术区并滴加庆大霉素进行处理,肌肉和皮肤被逐层缝合后在大鼠切口处使用碘伏对其进行消毒处理,对大鼠进行标记处理后进行分笼饲养,对大鼠术后的精神状态及生命体征变化给予密切监测观察。在24 h之后再次对大鼠进行麻醉,使用腹腔注射10%水合氯醛溶液的方法,其剂量为0.3 ml/100 g,将麻醉后的大鼠于操作板上呈仰卧位固定,对施术区进行备皮、杀菌消毒,随后作一个1.5 cm纵行切口于腹侧颈正中偏下处,将皮肤至颈前肌群使用眼科手术剪剪开后沿颈正中部肌群与外侧肌群交界处进行仔细分离,分离至颈总动脉鞘走行搏动处后,将颈总动脉周围筋膜剥离开,使迷走神经分离开,3-0号线游离颈总动脉,完成上述操作后对对侧使用同法处理,之后使用微型动脉夹在游离备用的3-0号线指引下将双侧颈总动脉可逆性夹闭,松开动脉夹在夹闭15 min后。夹闭是否成功标准如下:在夹闭双侧颈总动脉30~60 s内大鼠出现四肢僵直状态并且其呼吸深度加深及速度加快,发生双侧眼球颜色变化呈现出灰白色眼球,瞳孔扩散变大,眼球颜色可立即恢复红色在松开动脉夹之后,瞳孔重新缩小呈回缩现象。为预防感染,在夹闭成功后对术区使用0.9%氯化钠溶液进行冲洗,并且使用庆大霉素进行处理,将其肌肉和皮肤进行逐层缝合后,对切口部位使用碘伏进行消毒处理,对大鼠进行标记处理后分笼进行饲养。
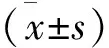
1.4 分组和给药 按大鼠体重对94只大鼠进行编号,给予常规饲养1周后将大鼠随机分为正常组12只、假手术组12只和造模组70只。本研究共造模造模成功48只,成功率为68.57%,其中假手术组大鼠仅暴露双侧椎动脉和颈总动脉,不行灼烧或夹闭操作。将造模成功的48只VD大鼠于造模第4周随机分为模型组、美金刚组、头针组及联合组各12只,各组干预方法如下。
美金刚组:按体表面积法将盐酸美金刚临床用量折算为大鼠用药剂量。人体表面积按照许文生氏公式计算:体表面积(m2)=0.0061×身高(cm)+0.0128×体重(kg)-0.1529,其中成人平均体重55 kg,平均身高165 cm。计算得成人平均体表面积为1.5576 m2,美金刚用量按10 mg/d计算,即成人用药量约0.181 mg/kg,按体表面积计算约为6.420 mg/m2。大鼠体表面积按照Meeh-Rubner氏公式进行计算:体表面积(m2)=K×体重W(g)2/3×10-3,大鼠K=9.1,平均体重200 g。计算得平均体表面积为0.031 m2,因此大鼠等效用药剂量为6.420× 0.031/0.2≈1 mg/kg,取10 mg盐酸美金刚加入50 ml 0.9%氯化钠溶液中,制成浓度0.2 mg/ml溶液,于每日8:00前对大鼠进行称重,计算用药量并进行灌胃。
头针组:选用28号1寸毫针,参照大鼠穴位图谱[9]选取百会、四神聪进行针刺,斜刺入针4 mm,施以捻转手法5 min,留针15 min,再次施以捻转手法5 min后取针,每周针刺6 d,休息1 d。同时于每日8:00前对大鼠进行称重,并按照每金刚组中用药量换算为相应体积0.9%氯化钠溶液进行灌胃。
联合组:按照头针组和美金刚组中针刺及给药方法进行干预。
正常对照组、假手术组和模型组:每日8:00前对大鼠进行称重,并按照美金刚组中用药量换算为相应体积0.9%氯化钠溶液进行灌胃。
1.5 行为学评价 分别于造模前、造模4周、治疗4周和治疗8周进行Morris水迷宫实验,水池高度为40 cm,直径160 cm,水深30 cm,水温(23±1)℃,直径10 cm,高度28 cm的无色透明平台。Morris水迷宫实验包括2个部分:①定位航行试验:将大鼠头朝池壁放入水池中开始计时,至四肢完全站上平台为止所需时间为逃避潜伏期,以120 s为限,超过者计为120 s,定位航行试验共进行5 d,前2天为适应性阶段,计算第3~5天逃避潜伏期均值,视为最终结果。②空间探索试验:定位航行试验结束第2天撤掉无色透明平台,将大鼠从平台所在象限放入水中并观察120 s内穿越原平台区域的次数,每只大鼠重复3次取平均值。
1.6 胆碱能神经递质活性检测 干预8周后将各组大鼠断颈处死,取出脑组织并分离海马,取部分海马组织称重后按重量与0.9%氯化钠溶液体积1∶10比例配制冰浴匀浆,震荡30 min后在4 ℃条件以3500 r/min离心10 min,取上清液采用比色法检测胆碱乙酰转移酶(Choline acetyltransferase,ChAT)和乙酰胆碱酯酶(Acetylcholinesterase,AChE)活性,按照试剂盒操作,分别于520 nm和324 nm处测量吸光度值,根据其颜色深浅进行比色定量。
1.7 炎症因子表达水平检测 取部分海马组织称重后按重量与0.9%氯化钠溶液体积1∶10比例配置冰浴匀浆,充分研磨后4 ℃条件下以10000 r/min离心10 min,再取上清液检测炎症因子TNF-α、IL-1β、IL-10、TGF-β表达水平。检测方法为ELISA,操作方法按照试剂盒说明书完成,于450 nm处检测吸光值并根据标准曲线计算各样品炎症因子水平。
1.8 NF-κB表达水平检测 采取部分海马组织称重后按20 mg:150 μl的比例加入裂解液,于冰浴下匀浆,4 ℃条件下12000 r/min离心10 min,取上清液采用二喹啉甲酸(Bicinchoninic acid,BCA)法测定总蛋白浓度,分别用10%和4%的分离胶与浓缩胶对蛋白进行处理,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),电泳分离蛋白后进行电转膜,以5%脱脂奶粉摇床室温封闭1 h后加入以兔抗鼠NF-κB抗体并于4 ℃孵育过夜,室温环境下以TBST冲洗3次,10 min/次,然后加入羊抗兔IgG二抗(使用HRP标记),室温环境孵育2 h,再以TBST洗涤3次,10 min/次,取出NC膜采用ECL试剂盒显影,采用凝胶成像系统进行扫描并测定各条带分光密度值,计算NF-κB相对蛋白表达水平。
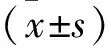
2 结 果
2.1 各组大鼠行为学评估结果比较 造模4周时,模型组、美金刚组、头针组和联合组大鼠逃避潜伏期显著升高(P<0.05),穿越原平台次数显著降低(P<0.05)。治疗8周时,美金刚组、头针组和联合组逃避潜伏期显著降低(P<0.05),穿越原平台次数显著升高(P<0.05),且头针组改善效果显著优于美金刚组(P<0.05),联合组改善效果显著优于美金刚组和头针组(P<0.05)。见表1。

表1 各组大鼠行为学评估结果比较
2.2 各组大鼠海马组织ChAT和AChE活性比较 治疗8周时,模型组、美金刚组、头针组和联合组海马组织ChAT和AChE活性均显著低于正常组(P<0.05),头针组和联合组ChAT和AChE活性均显著高于模型组和美金刚组(P<0.05),联合组ChAT活性高于头针组(P<0.05),见表2。
2.3 各组大鼠海马组织炎症因子表达水平比较 治疗8周时,模型组、美金刚组、头针组和联合组海马组织TNF-α和IL-1β水平显著高于正常组(P<0.05),IL-10和TGF-β水平显著低于正常组(P<0.05);美金刚组、头针组和联合组TNF-α和IL-1β水平显著低于模型组(P<0.05),IL-10和TGF-β水平显著高于模型组(P<0.05),且头针组TNF-α和IL-1β水平显著低于美金刚组(P<0.05),IL-10和TGF-β水平显著高于美金刚组(P<0.05);联合组TNF-α和IL-1β水平显著低于头针组(P<0.05),IL-10和TGF-β水平显著高于头针组(P<0.05)。见表3。

表3 各组大鼠海马组织炎症因子水平比较(ng/mg)
2.4 各组大鼠海马组织NF-κB表达水平比较 治疗8周时,模型组、美金刚组、头针组和联合组海马组织NF-κB蛋白表达水平显著高于正常组(P<0.05);美金刚组、头针组和联合组NF-κB蛋白表达水平显著低于模型组(P<0.05),且头针组NF-κB蛋白表达水平显著低于美金刚组(P<0.05),联合组NF-κB蛋白表达水平显著低于头针组(P<0.05)。见图1。
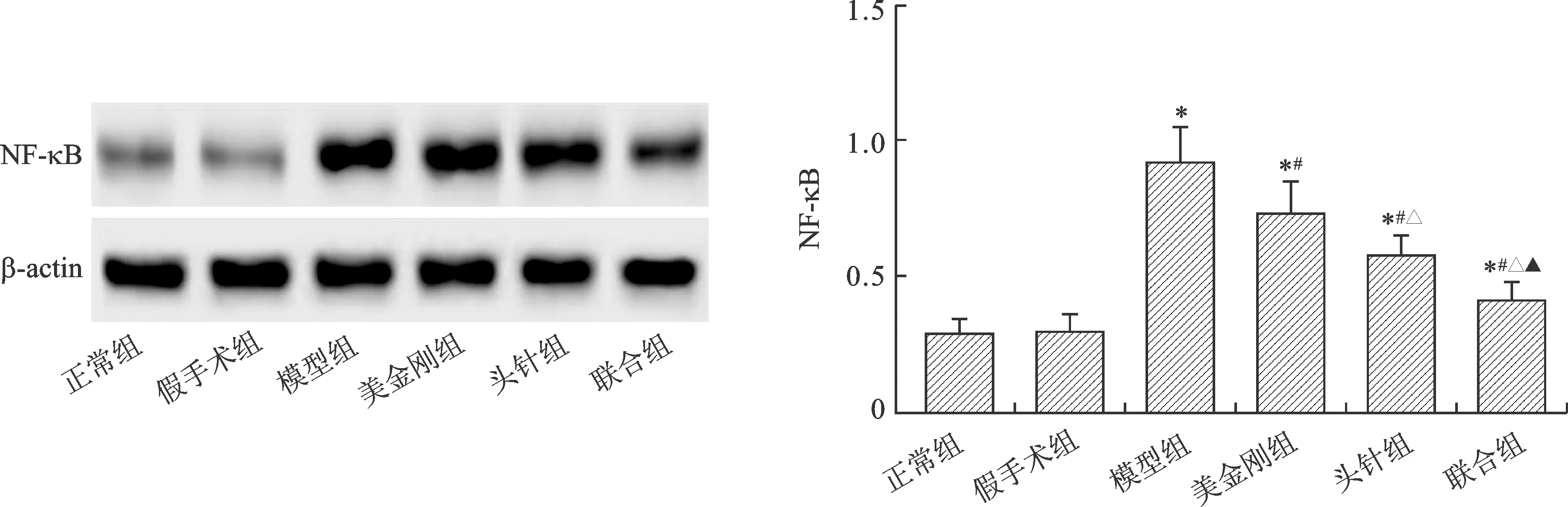
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与美金刚组比较,△P<0.05;与头针组比较,▲P<0.05
3 讨 论
中医将VD归属于“呆病”“健忘”或“不慧”等范畴,其病位在脑,《灵枢·大惑论》记载“上气不足,下气有余,故善忘也”,病机主要为阳气虚衰,血气瘀滞,痰凝阻络,浊毒内蕴,从而破坏脑髓,导致迷惑健忘,行动呆滞等症状。本病为虚实夹杂之证,治疗以补虚为主,同时兼顾祛邪,达到平衡阴阳,调和气血的目的[7]。本研究建立大鼠VD模型进行研究显示,造模4周时Morris水迷宫实验评估逃避潜伏期,结果显示模型组、美金刚组、头针组和联合组潜伏期时间更长,对比穿越平台次数,模型组、美金刚组、头针组和联合组次数更少,说明建模成功后大鼠空间学习记忆能力明显受损。对百会和四神聪进行针刺,并于治疗8周时逃避潜伏期降低,且穿越原平台次数增加。百会是调节大脑功能的要穴,具有通达阴阳,贯通诸经之功;四神聪可安心宁神,醒脑开窍。本研究结果显示针刺百会和四神聪对VD大鼠空间学习记忆能力有良好改善效果,且效果优于西药美金刚治疗。头针与美金刚联合治疗VD大鼠具有协同作用,有利于提升疗效。
CAP是生物体内广泛分布的“免疫-神经-内分泌”信号通路,胆碱能神经递质与受体结合后可启动反馈调节,从而产生抗炎效应。Damodaran等[8]研究认为大脑皮层和海马等为较脆弱区域,缺血缺氧状态下容易引起神经元发生损伤,导致认知障碍和造成记忆功能受损,刺激胆碱能系统利于改善认知缺陷。ChAT为催化乙酰胆碱合成的酶,AChE为催化乙酰胆碱分解的酶,两者活性变化可共同维持脑组织中乙酰胆碱动态平衡[9-10]。本研究结果显示模型组海马组织ChAT和AChE活性较正常组和假手术组均明显降低,表明ChAT和AChE活性降低可能是引起VD的重要因素,其机制可能与乙酰胆碱合成减少导致下游抗炎信号通路激活障碍有关。头针治疗可明显提升VD大鼠海马组织ChAT和AChE活性,与黄东挺等[11]报道显示头针可上调老年痴呆大鼠海马组织乙酰胆碱表达水平的结果一致,有利于提升乙酰胆碱代谢转换率,乙酰胆碱与受体结合激活抗炎通路,从而改善VD大鼠学习和记忆能力。本研究结果显示头针治疗8周时VD大鼠海马组织TNF-α和IL-1β表达水平显著降低,同时IL-10和TGF-β表达水平显著升高,表明针刺百会穴和四神聪有利于抑制促炎因子表达,增强抗炎因子表达,通过改善海马组织炎症反应,可减轻神经功能损伤,促进VD大鼠学习和记忆能力恢复,与李娜等[12]、邓畅等[13]和田文静等[14]研究结果相近。既往研究ChAT和AChE不仅参与调节乙酰胆碱代谢,还具有神经营养因子样作用,可促进神经元发育和再生[15]。TGF-β属于肽类生长因子,可促进细胞生长、增殖和分化,且对神经元损伤和凋亡具有拮抗作用,有利于减轻认知功能损害[16]。付伦姣等[17]研究发现TGF-β1/SMAD2信号通路被钙通道α3亚基基因(GABRA3)所抑制,该机制会使神经元凋亡被促进,突触形成和递质释放被抑制。
目前认为针刺调控CAP的机制可能与NF-κB等信号通路密切相关。冷凤等[18]建立Alzheimer’s病大鼠模型进行研究显示,预针刺可降低神经炎症反应并改善学习记忆功能障碍,且其机制可能与抑制TLR4/NF-κB信号通路激活存在密切联系。本研究结果显示模型组、美金刚组、头针组和联合组海马组织NF-κB蛋白表达水平显著高于正常组,表明VD大鼠海马组织NF-κB信号通路激活,头针治疗8周时NF-κB水平明显降低,提示头针治疗VD可抑制NF-κB信号通路,从而抑制炎症反应水平。既往研究认为针灸可刺激迷走神经,同时对ChAT和AChE活性进行调控,从而调节乙酰胆碱合成和代谢,乙酰胆碱与免疫细胞表面特异性受体结合后形成的复合物影响NF-κB等下游信号通路激活,产生抗炎作用[19]。针刺百会穴和四神聪则可抑制海马细胞炎症信号通路活化并减少细胞凋亡,同时还可改善血液循环,抑制兴奋性氨基酸毒性,通过多重生理机制促进神经功能修复和重建[20]。本研究结果显示对VD大鼠针刺百会穴和四神聪进行治疗有利于增强ChAT和AChE活性,提升乙酰胆碱代谢水平,增强CAP作用,从而达到改善大鼠空间学习记忆能力的效果,且与兴奋性氨基酸受体拮抗剂美金刚联合治疗可进一步提升疗效。

