一株Olivibacter jilunii 纤维素降解菌株的分离鉴定与降解能力分析
饶紫环 谢志雄
(武汉大学生命科学学院,武汉 430000)
木质纤维素是自然界中含量最丰富的有机物,主要由木质素、纤维素和半纤维素组成。木质纤维素的生物处理一直被认为是解决化石燃料短缺问题的有效方法,也是未来新能源开发的趋势。木质纤维素的生物处理通常使用降解木质纤维素的酶,包括木质素酶、纤维素酶和半纤维素酶。其中纤维素酶主要应用于造纸业、洗涤剂、食品、工业生产酒精等领域[1-2],约占全球工业酶需求的8%[3]。针对不同的产业和目的,采用的纤维素酶种类也不同。尽管目前关于纤维素酶的研究不断取得进展,酶产品的成本仍然居高不下。筛选新型纤维素酶对相关工业的发展有着至关重要的作用。
纤维素酶根据作用位点,可以大致分为外切葡聚糖酶、内切葡聚糖酶和β-葡萄糖苷酶等[4]。外切葡聚糖酶主要作用于纤维素结晶区,终产物可以是葡萄糖或者纤维二糖。内切葡聚糖酶主要作用于纤维素无定形区,随机切割产生新的末端,产物是一些不定长度的寡糖。β-葡萄糖苷酶更倾向作用于非还原端,水解纤维糊精和纤维二糖产生葡萄糖。纤维素酶主要来源于纤维素降解菌株。其中真菌是研究最多的一类纤维素降解微生物。一般认为真菌的纤维素分解能力和酶活性普遍高于细菌,然而真菌的高酶活可能是源于其较强的蛋白分泌能力[5],若具体到单酶的活性,细菌产生的酶可能会更适用于工业生产[4]。同时由于真菌酶系更为复杂,在纯化单酶时面临更多的技术问题。因此近年来相关研究更多集中于得到具有降解能力的细菌[1]。适应极端环境的细菌,如嗜热、耐碱等方向尤为受到关注。然而日常工农业生产活动更多的是在常温下进行,常温纤维素降解菌株有着更广阔的应用前景。不断筛选鉴定发现新型常温纤维素降解菌株对充实相关微生物资源有着重要意义,也为新型纤维素酶的研发提供了更多的思路。
Olivibacter属最早发现于2007年[6],模式菌株为 Olivibacter sitiensis AW-6T,因在橄榄油废料中分离得到而得名。该属的典型特征为棒状,革兰氏染色阴性。Olivibacter属内迄今为止已有10个已鉴定的新种,其中Olivibacter jilunii 14-2AT于2013年从DDT污染土壤中分离得到[5]。
由于纤维素降解菌株主要富集在纤维素丰富的环境中,因此本研究从园林堆肥中选取分离基质,设计筛选培养基,得到常温下的纤维素降解菌株。根据分子鉴定,该菌株属于Olivibacter属,为该属内首次报道的具有纤维素降解能力的菌株。
1 材料与方法
1.1 材料
园林堆肥样品:香樟(Cinnamomum camphora)落叶、法国梧桐(Platanus orientalis L.)落叶和杏鲍菇(Pleurotus eryngii)培养物等堆肥。
CMC-Na(羧甲基纤维素钠)培养基:氯化钠6.0 g/L,硫酸铵2.0 g/L,无水氯化钙0.1 g/L,七水合硫酸镁0.1 g/L,磷酸二氢钾0.5 g/L,磷酸氢二钾2.0 g/L,CMC-Na 10.0 g/L。
纤维素酶底物:10.0 g/L羧甲基纤维素钠溶于pH 5.0柠檬酸-柠檬酸三钠缓冲液。
1.2 方法
1.2.1 菌株的分离纯化及纤维素降解能力检测 从堆肥中取样,按10倍梯度稀释涂布于CMC-Na平板,每个稀释度进行3个平行。37℃恒温培养3 d后挑取单菌落。于CMC-Na平板上进行平板划线纯化。连续5代培养纯化后,挑取单菌落接种于CMCNa液态培养基中,37℃培养3 d,取培养上清滴在CMC-Na平板上,37℃恒温培养5 d后用刚果红染色液初步检测纤维素酶活。同时,取0.5 cm × 2 cm的滤纸条灭菌烘干后加入CMC-Na液态培养基中,接入菌液,置于37℃培养10 d后,根据滤纸降解程度初步确定菌株的降解能力。经过上述两次初步筛选,选取降解性能优良的菌株进行下一步分析。
1.2.2 菌株的16S rRNA基因序列比对分析 挑取单菌落利用PCR[7]扩增16S rRNA基因序列,将PCR产物送交天一辉远公司测序后获得16S rRNA基因序列信息,在NCBI(https://www.ncbi.nlm.nih.gov/)和EZBioCloud(https://www.ezbiocloud.net/)上分别进行比对,确定菌株所属种属。根据NCBI的16S rRNA基因序列比对结果,下载相近序列后,利用MEGA-X用非加权组平均法(unweighted pairgroup method with arithmetic means, UPGMA)构建进化树[8-9]。利用PAUP* 4.0a169[10]构建最大简约树(maximum parsimony tree, MP-tree)。
1.2.3 菌株基因组比较分析 将分离的菌株送生工生物公司进行全基因组测序。相近种属的基因组序列在NCBI上获得。利用EZBioCloud(https://www.ezbiocloud.net/)计算OrthoANIu,在JSpeciesWS(https://jspecies.ribohost.com/jspeciesws/)上计算ANIb和ANIm;利用Genome-to-Genome Distance Calculator 3.0(https://ggdc.dsmz.de/ggdc.php)计算DDH;利用Mauve进行共线性比对[11];用BRIG进行GC值比对,并利用BRIG的基因位置标注功能特别标注纤维素酶相关基因[12]。
1.2.4 生理生化特征检测 检测菌株18B和O.jilunii 14-2AT的生长温度、生长pH、NaCl耐受、糖酵解、硝酸盐还原、氧化酶和β-半乳糖苷酶活性等生理生化指标。VP测试采用Barritt法。将菌株平板划线法接种于MacConkey平板,37℃培养3 d连续观察菌落形态和颜色[13]。
1.2.5 纤维素酶活的测定 酶活单位:1 min催化底物羧甲基纤维素钠生成1 μmol还原糖的酶量即为1 U。葡萄糖标准曲线的制作参照Miller的方法[14],使用Cytation3酶标仪测定540 nm吸光度。将菌株按照0.5%(V/V)的比例接种于CMC液体培养基中,37℃,200 r/min培养,不同时间取培养液经0.22 μm滤膜过滤得到粗酶液。将粗酶液100 μL与底物900 μL混合后,对照组立即沸水浴5 min,然后冰浴;实验组在50℃水浴锅中反应20 min。随后向对照组和实验组中同时添加2.0 mL DNS,沸水浴5 min后,冷却至室温,吸取反应液200 μL,加入96孔酶标板中,使用Cytation3酶标仪测定540 nm吸光度。将所得吸光度代入公式:
(k:葡萄糖标准曲线斜率;t:反应时间)计算酶活。
1.2.6 纤维素酶相关基因异源表达及检测 根据全基因组测序的基因注释,结合蛋白结构分析,定位菌株纤维素酶相关基因,并对其中酶活潜力最大的蛋白基因克隆进pET26b质粒,将质粒转入Escherichia coli BL21中。利用IPTG进行诱导表达。检测异源表达蛋白纤维素降解活性。
2 结果
2.1 菌株的筛选及16S rRNA 序列进化分析
在CMC-Na平板上共纯化得到纤维素降解细菌17株,根据滤纸降解能力(图1-A)和刚果红褪色圈直径(图1-B)确定编号为18B的菌株降解能力最为突出。
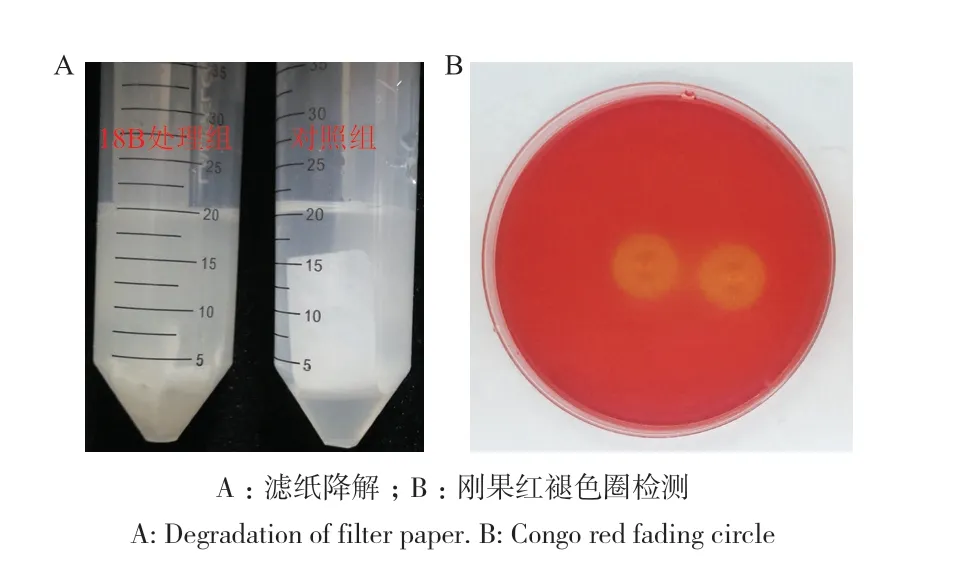
图1 菌株18B纤维素降解能力检测Fig. 1 Detection of cellulose degradation ability of strain 18B
通过PCR扩增获得菌株18B的16S rRNA基因序列(1387 bp)及NCBI和EZBioCloud比对发现,与其相似度在97.00%以上的细菌有2株。菌株18B的16S rRNA基因序列在NCBI数据库中比对结果最相近的分别为O. jilunii 14-2AT(99.35%)和Olivibacter oleidegradans TBF2/20.2T(99.28%)。在EZBiocloud数据库中比对结果最相近的为O.oleidegradans TBF2/20.2T(99.42%)和O. jilunii 14-2AT(99.13%)。利用MEGA-X构建进化树,其中UPGMA进化树见图2,与菌株18B亲缘关系最接近的是O. jilunii 14-2AT和O. oleidegradans TBF2/20.2T两菌株。利用PAUP构建的MP进化树(图3),一致性指数(consistency index, CI)值为0.553,保留指数(retention index, RI)值为0.689,重缩放一致性指数(rescaled consistency index, RC)值为0.381,非同源相似性指数(homoplasy index, HI)值为0.447。MP进化树与UPGMA进化树相似,表明结果可信,提示菌株18B属于Olivibacter属。
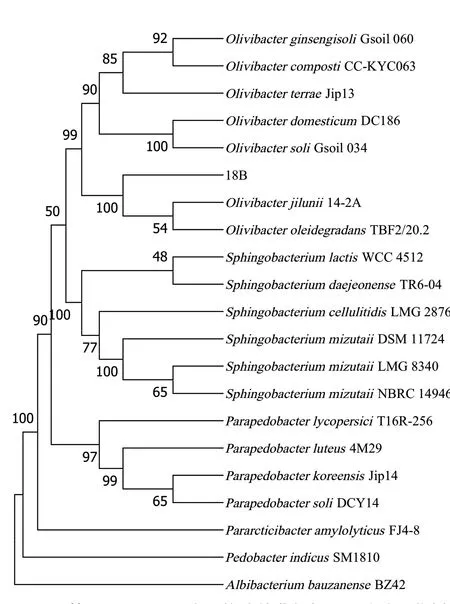
图2 基于16S rRNA序列构建的非加权组平均法进化树(以Albibacterium bauzanense BZ42为外群)Fig. 2 UPGMA-tree based on 16S rRNA (Albibacterium bauzanense BZ42 used as the outgroup)

图3 基于16S rRNA序列构建最大简约树(以Albibacterium bauzanense BZ42为外群)Fig. 3 MP-tree based on 16S rRNA (Albibacterium bauzanense BZ42 used as the outgroup)
2.2 菌株18B的基因组比较分析
为进一步鉴定菌株18B,对其进行全基因组测序及比对分析。全基因组测序的结果表明菌株18B的基因组长度为5976 778 bp,利用 EZBiocloud和JSpeciesWS的ANI(average nucleotide identity)计算结果显示18B和O. jilunii 14-2AT的相似度均在95%以上,不符合新种界定的范围。EZBiocloud上计算OrthoANIu(orthologous average nucleotide identity),结果显示18B与O. jilunii 14-2AT的ANI为98.42%。在JSpeciesWS上,以O. jilunii 14-2AT的基因组作为参考序列,ANIb为97.58%,ANIm为98.85%。在Genome-to-Genome Distance Calculator 3.0计算菌株18B和O. jilunii 14-2AT的DDH(DNA-DNA hybridization),参考结果为87.60%。根据以上结果,可确定18B属于O. jilunii。对18B和O. jilunii 14-2AT进行进一步的比对分析。图4展示的共线性结果可知,18B与O. jilunii 14-2AT之间存在着一定的进化关系。图5展示的为BRIG绘制Olivibacter属内的基因组比对结果,参考序列为18B,由图可知18B与该属内的其他菌株之间存在着一定的进化距离,部分小片段上相似度较低。

图4 菌株18B和O. jilunii 14-2AT的全基因组共线性比对Fig. 4 Genome-wide covariance alignment of strain 18B and O. jilunii 14-2AT
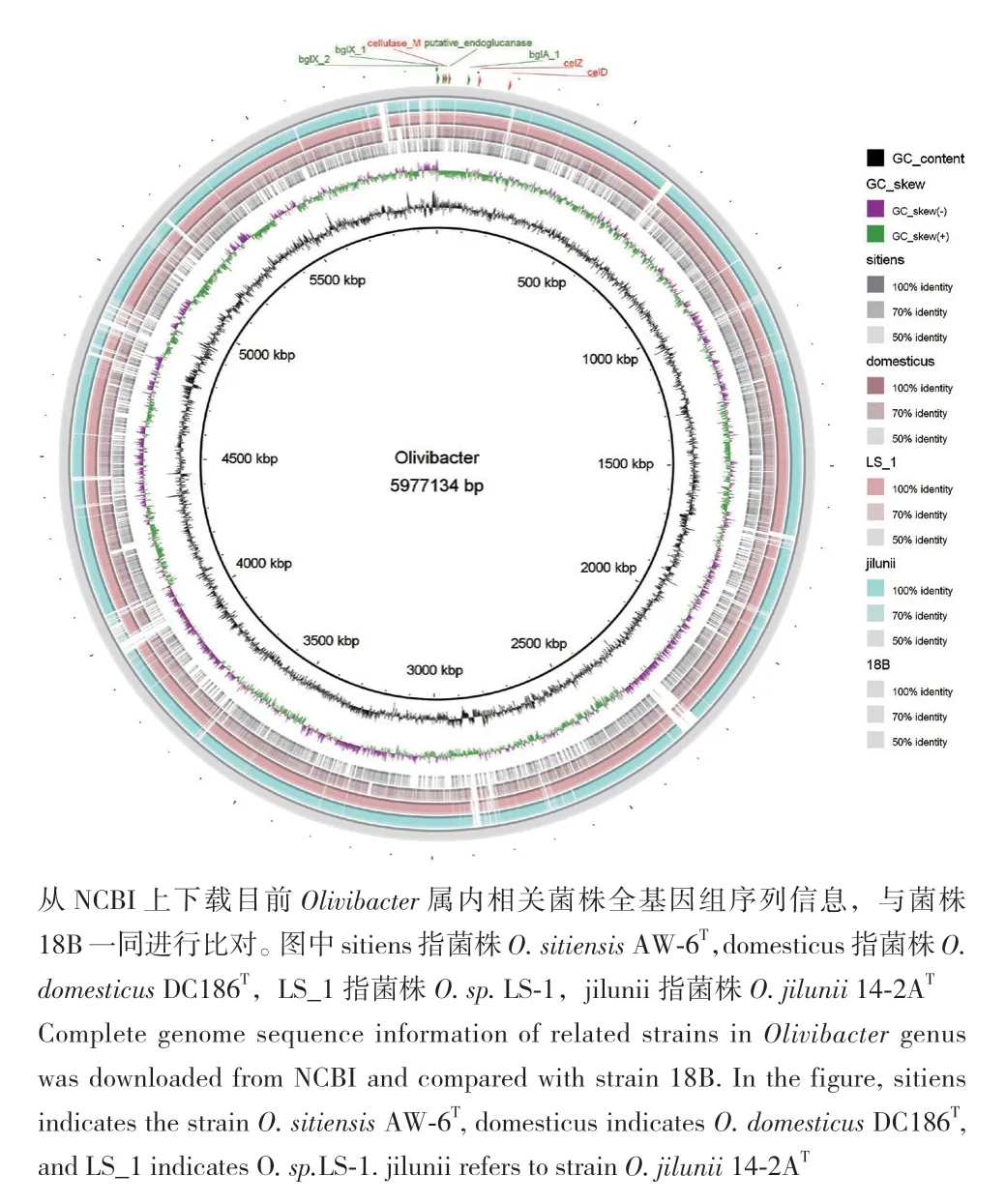
图5 Olivibacter属内基因组比对Fig. 5 Genome alignment within the genus Olivibacter
2.3 生理生化检测分析
对菌株18B和O. jilunii 14-2AT进行常见生理生化特征比较实验,发现菌株18B与O. jilunii 14-2AT在生长温度、氧化酶和糖酵解等方面存在差异(表1)。

表1 18B和O. jilunii 14-2AT常见生理生化特征比对Table 1 Comparison of common physiological and biochemical characteristics between 18B and O. jilunii 14-2AT
2.4 菌株18B产纤维素酶活分析
在LB中转接一代后,菌株18B产纤维素酶活有明显的下降,表明菌株18B在营养丰富培养基中培养存在严重的产酶退化现象,但是在仅含羧甲基纤维素钠的培养环境中,菌株18B的退化不明显(图6)。同时,未测得O. jilunii 14-2AT的纤维素酶活。
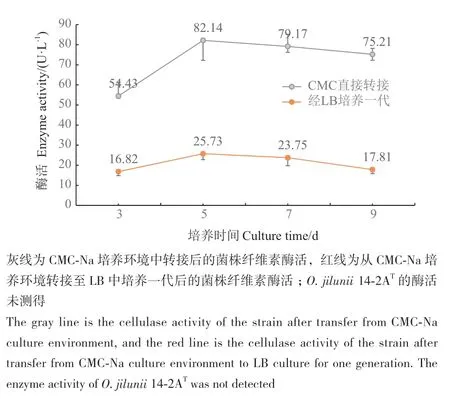
图6 18B纤维素酶活随培养时间变化Fig. 6 Variation of 18B cellulase activity with incubation time
2.5 菌株18B纤维素酶合成相关基因分析
因为该属内的菌株未有关于纤维素降解能力的报道。根据全基因组测序的注释结果,对菌株18B纤维素酶合成相关基因进行分析,共得到纤维素酶合成相关基因7个(图4),选择其中标记为纤维素内切酶的基因序列,使用NCBI蛋白比对功能确定相关基因具有纤维素酶活性位点。最后确定4个最优潜力的纤维素酶合成相关基因。这4个基因分别编码蛋白为内切葡聚糖酶D前体(endoglucanase D precursor, celD),标记为D;内切葡聚糖酶Z前体(endoglucanase Z precursor, celZ),标记为Z;纤维素酶M(cellulase M),标记为M;纯内切葡聚糖酶(putative endoglucanase),标记为P。图7显示异源表达后菌液中的基因检测结果,表明诱导表达后的菌液中携带有目的基因。图8展示的是蛋白质的检测,表明各基因在该条件下诱导表达成功。D蛋白和P蛋白主要存在于上清中,Z蛋白和M蛋白沉淀中含量更高。同时测得酶活,D蛋白酶活为3.17 U/L,Z蛋白酶活为2.37 U/L,M蛋白酶活为2.57 U/L,P蛋白酶活为1.98 U/L。

图7 诱导表达后基因检测Fig. 7 Gene amplification after induction of expression
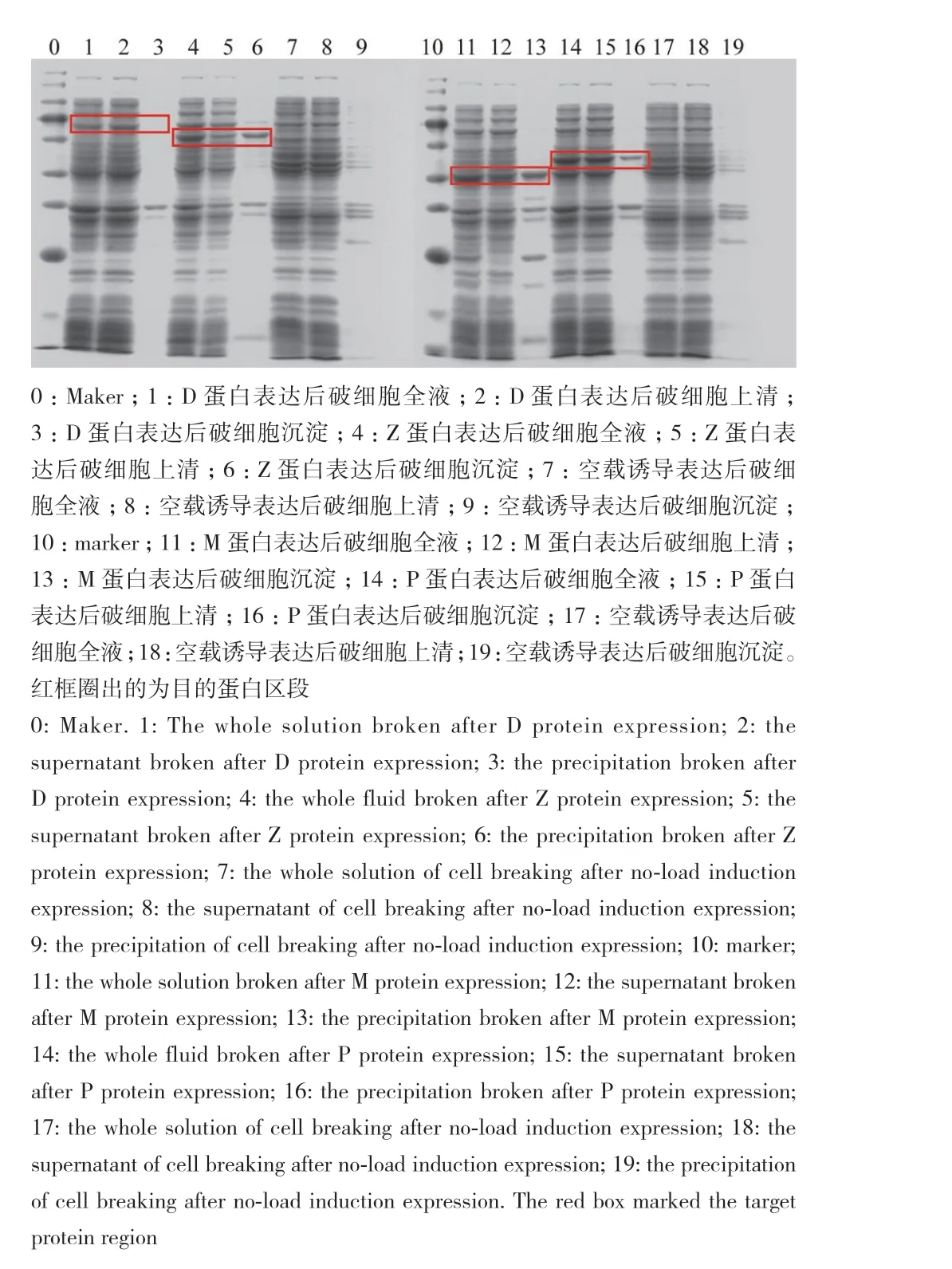
图8 纤维素酶基因诱导表达蛋白检测Fig. 8 Protein assay of cellulase gene induced expression
3 讨论
3.1 菌株18B属于O. jilunii
根据16S rRNA基因序列、全基因组序列和生理生化特征比对,确定菌株18B属于O. jilunii。其中,菌株18B与O. jilunii 14-2AT的基因组长度差距较大。同时,通过共线性分析可知,菌株18B与O. jilunii 14-2AT存在大区段的重排和缺失。在生理生化特征上,菌株18B和O. jilunii 14-2AT的主要区别在于生长温度、氧化酶、糖酵解以及纤维素降解。由于堆肥发酵存在高温时期[15],菌株18B的生长温度和最适温度较O. jilunii 14-2AT有向高温区段偏移的趋势。这是一种环境适应性的表现。综合以上证据,可以判断菌株18B与O. jilunii的模式菌株存在一定差别,可定为新的生理株,补充了国内该属的种质资源。
3.2 菌株18B的纤维素降解能力
菌株18B的主要纤维素酶系为内切葡聚糖酶和β-葡萄糖苷酶,根据几个相关基因的异源表达结果,可知这些基因具有一定的活性。但是相比于全菌的纤维素酶活性,相关基因的纤维素酶活性较低。可能是由以下两个原因导致。其一,异源表达载体采用T7启动子,非强启动子,蛋白表达量有限。其二,菌株18B具有调节纤维素酶基因和运送相关蛋白酶的通路,可增强相关基因的表达并将蛋白酶高效运输出细胞,以提高培养环境中羧甲基纤维素的利用效率。在内切葡聚糖酶D前体的上游,有外膜蛋白组装因子BAMB前体(outer membrane protein assembly factor BamB precursor),后者具有组装和运输外膜蛋白的功能[16]。同时,通过全基因组测序筛选出菌株18B具有半纤维素酶系相关基因16个,而半纤维素酶可协同促进纤维素酶发挥作用[17]。
3.3 菌株18B的应用前景良好
作为Olivibacter属内首次报道具有纤维素酶活性的菌株,菌株18B的应用前景也较为广泛。细菌所产的纤维素大多附着于细胞外膜[18-19],而菌株18B的纤维素酶活在去除细菌的培养上清中亦可检测到,表明菌株18B可产生胞外纤维素酶,这一点有利于后续工业化的利用。在羧甲基纤维素钠培养基中,培养到后期(>14 d),可通过酸性重铬酸钾检测到培养上清中含有酒精,且16S rRNA测序无双峰,表明该培养环境无污染。暗示菌株18B在纤维素发酵产乙醇的工业方面亦可有应用。在pH 5.0和pH 7.0的反应条件下,均可检测到菌株18B培养上清的纤维素酶活,表明该菌株所产纤维素酶系的应用环境广,在中性和偏酸性环境下均可发挥降解能力。细菌纤维素酶广泛应用于洗涤剂领域,以提高洗涤剂的去污能力并保持织物表面光滑度[20]。以往研究关于适用于洗涤产品的纤维素酶更多集中于碱性环境,近年来,一些酸性洗涤剂的推广给耐酸性细菌纤维素酶提供了更多的应用方向。而菌株18B的适应性和酶活力表明在该方向上它有优良的应用前景。
4 结论
菌株18B属于O. jilunii,是不同于模式菌株的一株生理株,主要区别在于生长温度和纤维素酶活性。菌株18B具有能合成纤维素酶的基因,主要为内切葡聚糖酶和β-葡聚糖苷酶。

