黄瓜枯萎病拮抗芽孢杆菌的筛选、鉴定及其生防潜力
褚睿 李昭轩 张学青 杨东亚 曹行行 张雪艳
(1. 宁夏大学农学院,银川 750021;2. 银川市农业技术推广服务中心,银川 750016)
黄瓜(cucumber)是一种重要的商业蔬菜作物,目前已成为我国设施蔬菜的主体[1],长期以来,大规模种植、连作等一系列措施导致土传病害肆虐,土壤生态平衡被破坏,其中黄瓜枯萎病(Cucumber Fusarium wilt)是影响黄瓜产量的主要土传病害之一。黄瓜枯萎病是由尖镰孢菌黄瓜专化型(Fusarium oxysporum f. sp. cucumerinum)引起的全球性土传病害,通常发病率在20%-50%,严重时达80%,甚至绝产,造成巨大的经济损失[2]。黄瓜枯萎病是设施连作蔬菜的直接致死因子,在黄瓜的整个生育期均可发生,在开花结果期黄瓜枯萎病发病率更高,严重影响黄瓜的产量和品质[2-4]。因此,解决由尖镰孢菌黄瓜专化型引起的枯萎病对黄瓜产业可持续发展至关重要。
目前,国内外关于黄瓜枯萎病已研究出多种防控措施,包括嫁接防治、化学防治、物理防治、农业防治等。但部分存在效率低、田间管理难度大、污染环境等缺点[5]。在现有的枯萎病防治方法中,主要依赖化学防治,虽然化学农药应用在一定程度上能达到防控病害的要求,但残留的农药会带来环境污染以及作物抗药性[6]。使用植物根际促生菌(plant growth promoting rhizobacteria, PGPR)和生物防治剂(biocontrol agents, BCAs)是防控枯萎病的另一种方法,PGPR能定殖在植物根际,利用有益微生物,通过竞争作用、抗生作用、重寄生作用、溶菌作用及诱导抗病性等多种防病机制拮抗病原菌,有利于促进作物健康生长[7]。芽孢杆菌因其具有遗传稳定性强、耐高温、抗逆性强和抑菌范围广等特性被广泛用于土传病害的防治。冉新炎等[8]分离获得的贝莱斯芽孢杆菌(Bacillus velezensis)K-19对根腐病和灰霉病病原菌均有一定的拮抗效果。刘雪娇等[9]研究发现贝莱斯芽孢杆菌3A3-15产生抑菌物质表面活性素,该次生代谢产物对尖孢镰刀菌的菌丝有较强致畸作用,且对孢子萌发抑制效果达 93.2%。张德锋等[10]研究发现贝莱斯芽孢杆菌具有广谱抑菌活性,此外,还表现出促生长的作用。Han等[11]研究发现解淀粉芽孢杆菌(B. amyloliquefaciens)B1408改变了FOC的菌丝形态,引起细胞质畸形、变形和外渗,使枯萎病发病率降低59.0%,并且促进黄瓜植株生长。此外,Liang等[12]研究发现B. velezensis ATR2对多种植物病原真菌表现出优异的拮抗活性,在植物病害方面表现出巨大的应用潜力。
本研究针对宁夏设施蔬菜高度集约化、复种指数高、高投入水肥管理等栽培模式下引起连作障碍,导致土传病害肆虐、蔬菜产量和品质下降等问题,以实验室保存的对黄瓜根腐病具有一定抗性的芽孢杆菌为研究材料,通过平板对峙法对50株芽孢杆菌进行初筛,筛选出抑菌率大于69%的芽孢杆菌,利用芽孢杆菌重悬液对抑病效果较好的菌株进行复筛,确定3株抑制尖镰孢菌生长效果显著的芽孢杆菌,分别对其进行形态学鉴定、生理生化鉴定、16S rDNA和gyrA双基因分子鉴定、抗病促生特性鉴定,结合各项鉴定结果,明确其分类地位。选择抑制病原菌生长效果最为显著的菌株进行温室盆栽试验,评价其防病促生效果,明确一株对黄瓜枯萎病防病效果最为显著的生防菌,探究其对黄瓜幼苗枯萎病的防控效果及对植株生长特性的影响,以期为研制多功能菌剂或菌肥提供生物原料和理论基础,为有效防控黄瓜枯萎病提供理论和技术支撑。
1 材料与方法
1.1 材料
供试黄瓜品种为‘博美626’,黄瓜幼苗购买于宁夏天缘种业有限公司。供试50株芽孢杆菌均由宁夏大学园艺实验室保存。供试尖镰孢菌黄瓜专化型(Fusarium oxysporum f. sp. cucumerinum, FOC)购买于商城北纳创联生物科技有限公司。
培养基:NA培养基用于拮抗菌的分离和培养[13],PDA培养基用于真菌培养及拮抗细菌的筛选[13],PDB培养基用于病原真菌液体培养,LB肉汤培养基用于拮抗细菌的液体培养[14]。
1.2 方法
1.2.1 高效抗病促生芽孢菌株的筛选 采用平板对峙培养法[15]从50株对茄病镰刀菌有一定防控效果的芽孢杆菌中筛选出对黄瓜枯萎病病原菌(尖镰孢菌黄瓜专化型)有抑制作用的菌株进行初筛。选择出现抑菌圈的菌株,记录抑菌圈直径并计算抑菌率。挑选抑制效果明显的芽孢菌株纯化保存,用于后期试验。
采用以菌液通过平板对峙培养法对初筛抑菌率高于69%的菌株进行复筛。具体操作如下:将直径为5 mm的病原菌菌饼接入PDA平板中央,然后在距菌饼四周2.5 cm处打孔,并且接种5 μL生防菌菌悬液(挑取一环纯菌接种在冷却的装10 mL LB液体培养基的50 mL三角瓶中,置于30℃,200 r/min摇床内培养24 h,10000 r/min离心5 min后取上清液待用),以不接种分离菌株作阴性对照,培养箱28℃培养7 d,每个处理重复3次,记录抑菌半径,并统计抑菌率。
抑菌率(%)=(对照病原菌菌落直径-处理病原菌菌落直径)/(对照病原菌菌落直径-病原菌菌饼的初始直径)×100%
1.2.2 高效抗病促生芽孢菌株的鉴定
1.2.2.1 菌株的形态学和生理生化鉴定 将复筛后拮抗效果最好的3个菌株分别在NA平板上划线,置于30℃恒温培养箱中培养24-48 h,参照《伯杰细菌鉴定手册》及《常见细菌系统鉴定手册》[16]进行菌落形态观察和生理生化等特征分析。
1.2.2.2 菌株的抗病促生特性测定 固氮能力:将待测菌株接种到阿须贝培养基,培养观察其有无菌体生长[17]。溶磷能力:将待测菌株接种于固体无机溶磷培养基平板,培养观察其有无透明溶磷圈出现[18]。解钾能力:将待测菌株接种到硅酸盐培养基上,培养观察其有无透明圈出现[19]。产铁载体:将待测菌株接种到铬天青CAS培养基上,培养观察有无黄绿色晕圈出现[20]。ACC脱氨酶活性:将菌株接种到ADF液体培养基培养,将培养所得菌液涂布于ADF固体平板,30℃培养后观察ADF平板上有无菌落生长,有菌落生长则具有 ACC脱氨酶活性,反之则无[19]。根据要雅倩等[21]的方法进行蛋白酶、果胶酶、几丁质酶、纤维素酶活性的检测。
1.2.2.3 菌株的分子鉴定 菌株16S rDNA:挑取单菌落接种于LB肉汤培养基30℃培养24 h后,采用DNA提取试剂盒(天根生化科技有限公司)提取菌株的总DNA,使用细菌通用引物(27F: 5'-AGAGTTTGATCATGGCTCAG-3'和1492R:5'-CTACGGCTA CCTTGTTACGA-3')扩增各菌株的16S rDNA基因序列。PCR反应体系(40 μL):模板(基因组DNA)2 μL,前后引物(27F和1492R)各2 μL,ddH2O 14 μL,MIX(2×Taq plus Master Mix)20 μL。PCR扩增反应条件:98℃预变性45 s;98℃变性10 s,60℃退火30 s,72℃延伸30 s;终延伸72℃ 5 min,共30个循环。扩增产物经1.2%琼脂糖凝胶电泳检测,PCR产物回收后送至生工生物工程(上海)股份有限公司进行测序。将测得的菌株序列在NCBI数据库中进行BLAST对比,使用MAGA-X软件构建系统发育树。
目标菌株靶基因gyrA 分子鉴定:挑取单菌落接种于LB肉汤培养基30℃培养24 h后,采用DNA提取试剂盒(天根生化科技有限公司)提取菌株的总DNA,使用细菌gyrA 基因扩增引物(L100:5'-AAATCTGCCCGTATCGTCG-3'和R836:5'-GCGTCACGGCGRATCTCAA-3')扩增各菌株的靶基因gyrA序列。PCR扩增反应体系(40 μL):模板2 μL前后引物(L100和R836)各2 μL,ddH2O 14 μL,Mix(2×Taq plus Master Mix)20 μL。PCR扩增反应条件:94℃预变性3 min;94℃变性40 s,61.7℃退火40 s,72℃延伸25 s;终延伸72℃ 10 min,共30个循环。
1.2.3 高效抗病促生芽孢菌株的盆栽试验 选复筛效果较好的3株芽孢菌株进行盆栽实验,共3种处理。选取长势一致的健康成苗,长到两叶一心时移栽定植,分别用20 mL菌株发酵液(108CFU/mL)灌根处理,CK1为清水浇灌,CK2只接种致病菌,N1、N3、N6分别接种复筛效果好的3种芽孢杆菌及致病菌。CK1:清水灌溉,CK2:10 mL 106CFU/mL尖镰孢菌悬液+10 mL清水,T1:10 mL 106CFU/mL尖镰孢菌悬液+10 mL菌N1,T2:10 mL 106CFU/mL尖镰孢菌悬液+10 mL菌N3,T3:10 mL 106CFU/mL尖镰孢菌悬液+10 mL菌N6。各处理先接种芽孢菌株(108CFU/mL),24 h后接种尖镰孢菌孢子悬浮液(106CFU/mL),每株10 mL,每个处理15株,接种10、13、15、17 d后调查发病情况,病情分级标准参考[22],计算病情指数和防病效果。第20天时测定株高、茎粗、叶绿素含量、地上部鲜重、地下部鲜重。每个处理选择代表性植株3株,连续测定3次,株高采用卷尺从生长定点到基部测定,茎粗采用游标卡尺在子叶下1 cm位置测定,相对叶绿素含量采用叶绿素仪(SPAD-520 Plus)对植株最大的叶片进行叶绿素含量测定,植株根系特性用万深根系扫描仪(EPSON V700)进行测定。
1.2.4 数据处理 采用Execl 2020和SPSS25.0进行数据统计与分析,使用Origin 2018软件绘图。利用MAGA-X数据软件建立系统发育树。
2 结果
2.1 尖镰孢菌拮抗菌的分离与筛选
将50株生防菌通过对尖镰孢菌的抑菌活性测定试验,筛选出抑菌率在69%及以上的有7株,60%-69%的菌株有19株,抑菌率在50%-60%的有9株(表1),15株菌株对尖镰孢菌抑菌效果不佳。对抑菌率在69%以上的菌株采用菌悬液进行复筛。
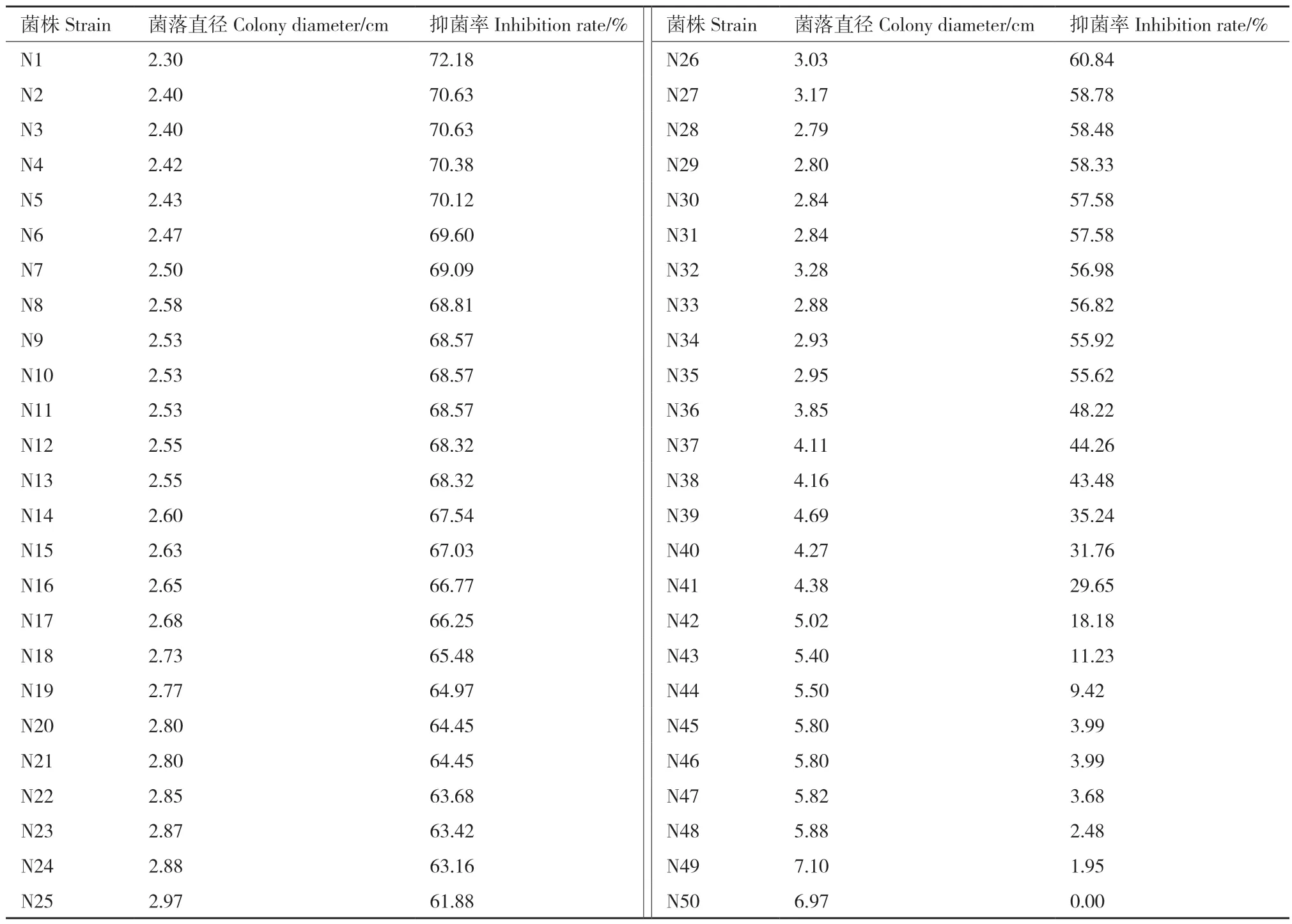
表1 拮抗抗性芽孢杆菌菌株对尖镰孢菌的抑菌作用Table 1 Inhibition of antagonist Bacillus strain against Fusarium oxysporum f. sp. cucumerinum(FOC)
复筛结果表明,菌株N1、N3和N6对尖镰孢菌有明显的拮抗效果(图1),抑菌率分别为77.71%、75.94%、74.76%(表2)。
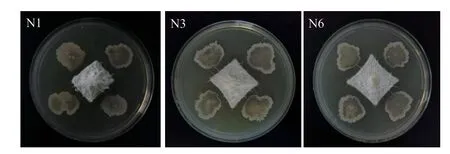
图1 N1、N3和N6菌株(四周)重悬液对尖镰孢菌(中心)的抑制效果Fig. 1 Inhibitory effect of N1, N3 and N6 strains(all around)resuspension on FOC
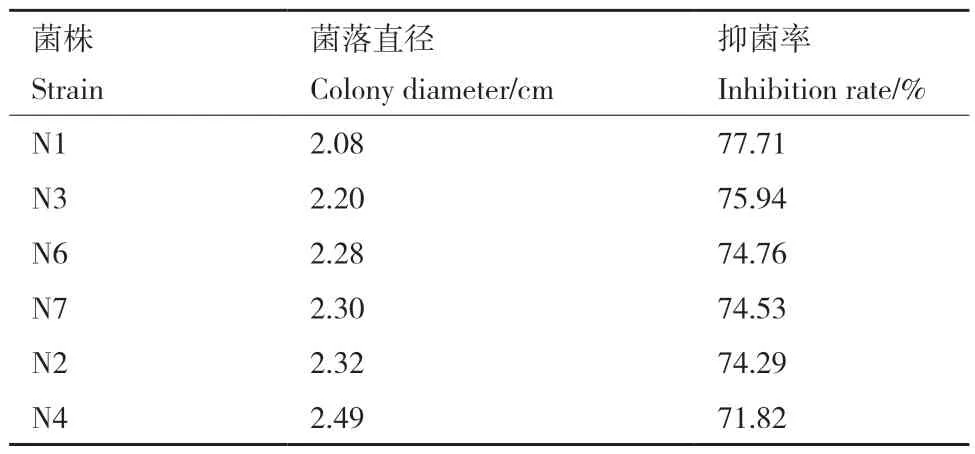
表2 尖镰孢菌抗性芽孢杆菌复筛抑菌率Table 2 Inhibition rate of Bacillus spp. re-screening on FOC
2.2 尖镰孢菌拮抗菌菌株的鉴定
复筛得到的3株拮抗效果最好的菌株在NA平板上均长势良好。培养24 h后,N1菌株的菌落为白色,表面粗糙不规则,隆起有褶皱,边缘光滑,不透明,干燥,无色素产生;菌株N3的菌落呈白色,表面隆起有褶皱,边缘光滑,不透明,干燥,无色素产生;菌株N6的菌落表面凸起,边缘光滑,不透明,湿润,无色素产生。3株拮抗菌均为革兰氏阳性菌、杆状、产椭圆形芽孢(图2)。
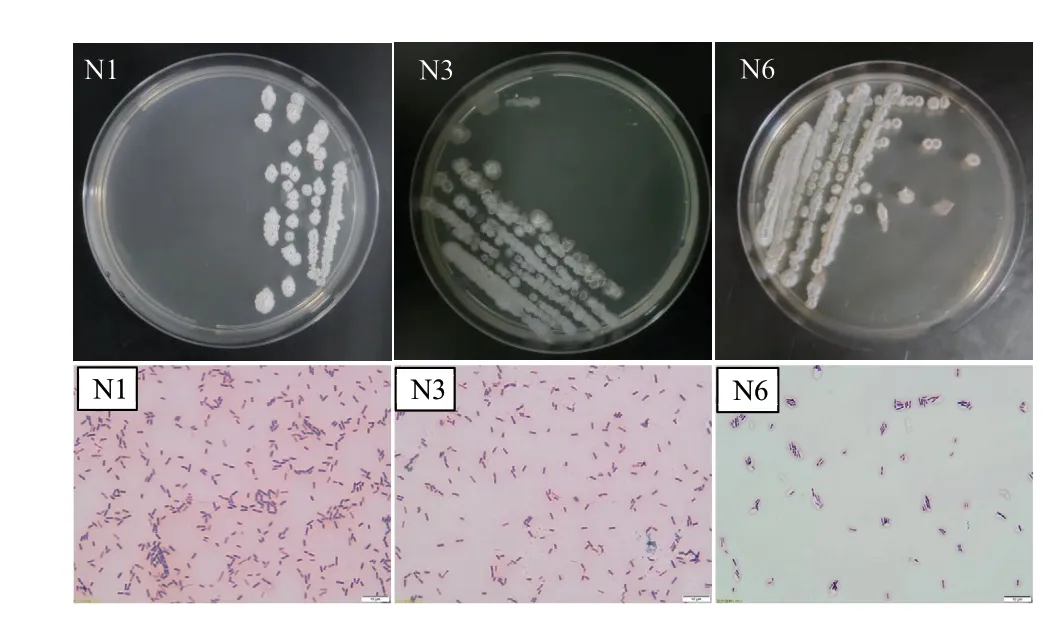
图2 N1、N3和N6菌株形态(A)及革兰氏染色图片(B)Fig. 2 Morphologies(A)of N1, N3, and N6 strains and Gram staining(B)
N1、N3和N6菌株的生理生化试验结果表明(表3),N1、N6菌株氧化酶试验、葡萄糖氧化发酵和明胶液化试验为阳性,其余试验结果均为阴性。N3菌株氧化酶试验和葡萄糖氧化发酵试验为阳性,其余试验结果均为阴性。
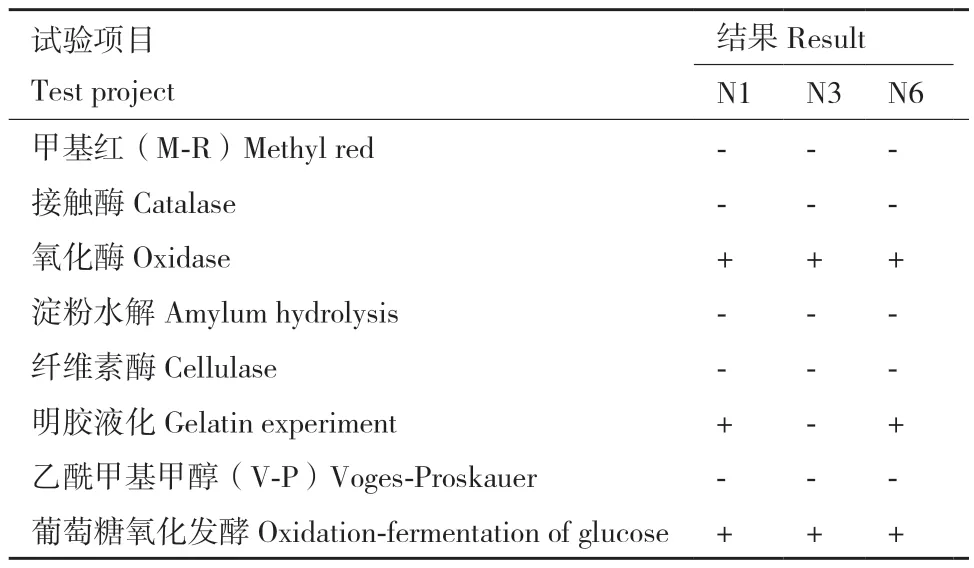
表3 N1、N3和N6菌株的生理生化结果Table 3 Physiological and biochemical results of N1, N3,and N6 strains
N1、N3和N6菌株的抗病促生试验结果表明(表4,图3)这3株芽孢杆菌均没有固氮、溶磷的能力,但其具备解钾的功能。3株菌均可以分泌铁载体、蛋白酶、几丁质酶、果胶酶。3株菌的抗病促生特性较为一致。
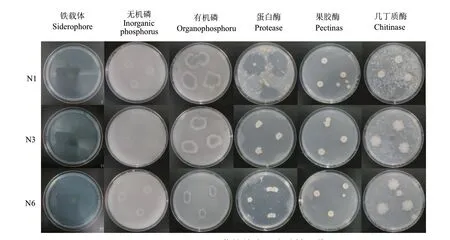
图3 N1、N3和N6菌株抗病促生特性图片Fig. 3 Pictures of disease-resistant and growth- proweting properties of N1, N3, and N6 strains
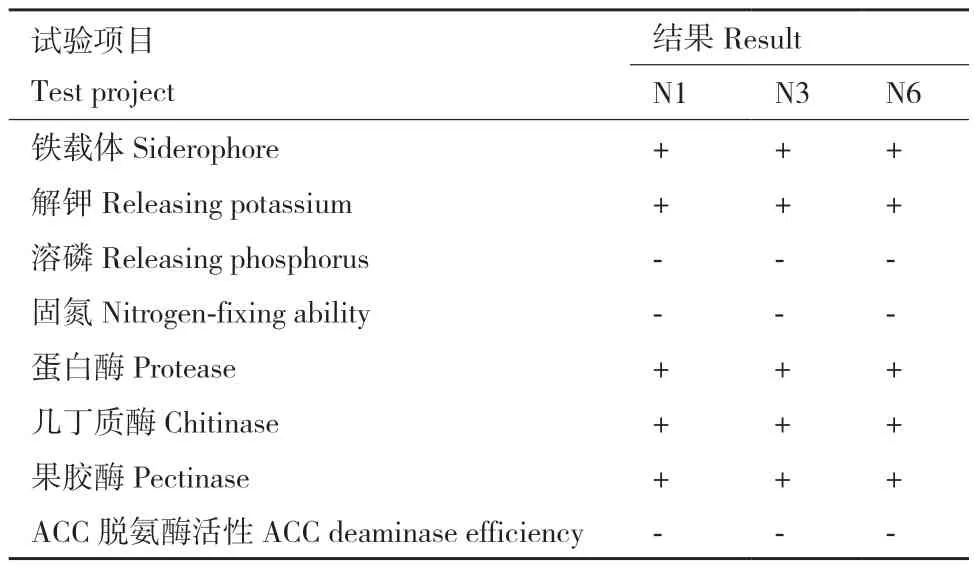
表4 N1、N3和N6菌株的抗病促生特性鉴定Table 4 Identification of disease resistance of N1, N3, and N6 strains and growth- promoting characteristics
根据生防菌N1、N3和N6的16S rDNA基因序列构建系统发育树(图4-A)。N1、N3和N6的基因序列与MF375212.1 B. velezensis strain和MW165777.1 B. amyloliquefaciens strain处于同一个分支内,N1、N3和N6可能为贝莱斯芽孢杆菌或解淀粉芽孢杆菌。仅凭16S rDNA分子鉴定试验无法确定N1、N3和N6菌株所属菌属,所以以gyrA基因作特异性引物,基于gyrA基因序列构建系统发育树。结果(图4-B)表明,N1、N3、N6菌株与MK775701.1 B. velezensis聚在一支。根据系统进化树结果推测,N1、N3、N6属于贝莱斯芽孢杆菌。
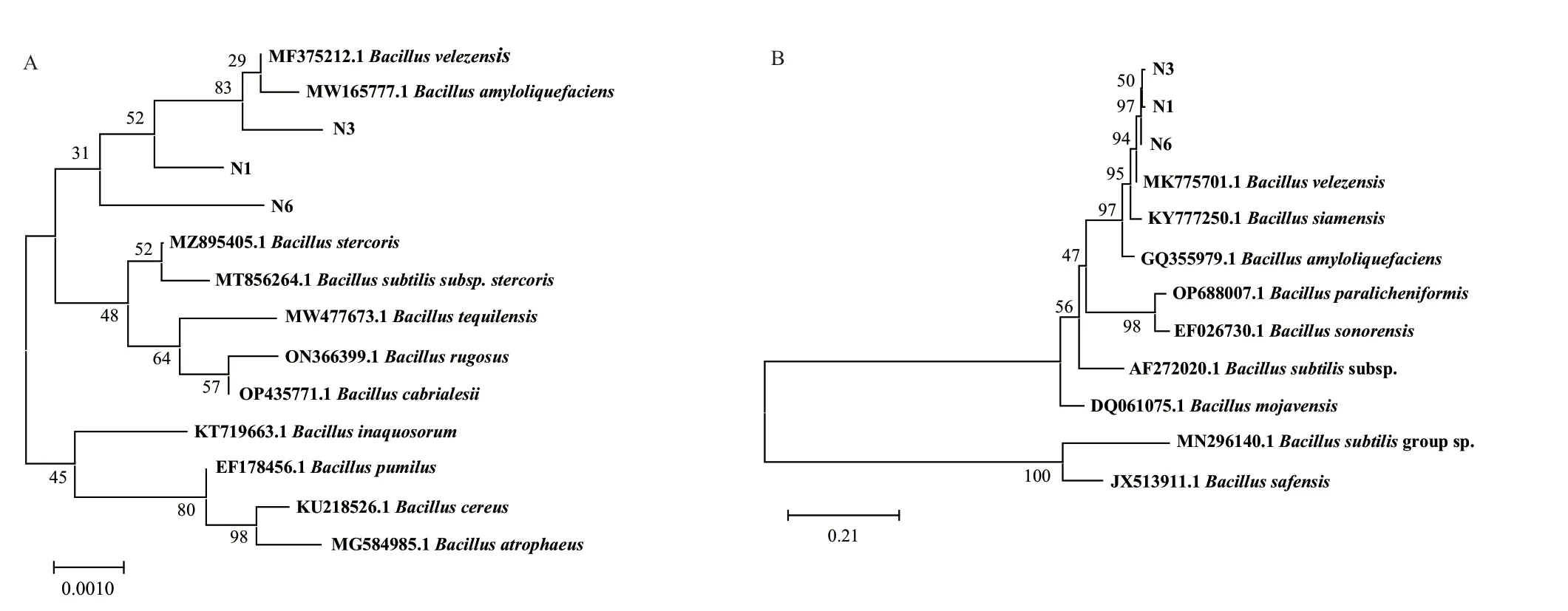
图4 基于N1、N3和N6菌株16S rDNA(A)和gyrA基因(B)构建的系统发育树Fig. 4 Phylogenetic trees constructed based on N1, N3, and N6 strains 16S rDNA(A)and gyrA gene(B)
2.3 拮抗性菌株盆栽试验防病及促生效果
接种生防菌10 d后,各处理均开始发病;接种生防菌14 d后N1、N3和N6处理防病效果逐渐降低并趋于稳定;CK2处理病情指数随接种时间递增,于接种后22 d达到86.11。接种菌株悬浮液的处理中N6菌株的防病效果最佳,达到66.13%,N1次之(表5)。
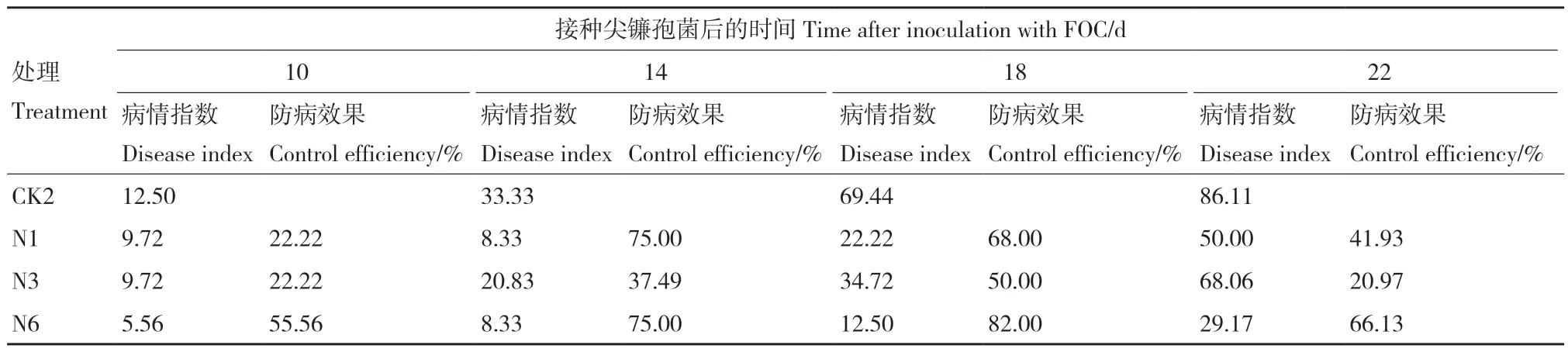
表5 菌株对黄瓜枯萎病的防病效果Table 5 Disease-prevention effect of the strain on cucumber wilt
统计各处理植株长势(表6)发现,只接种病原菌的处理长势显著低于其他处理,该处理叶绿素含量、茎粗、生物量显著降低,说明尖镰孢菌侵染会显著降低叶绿素含量、减少生物量的积累,与N1、N3和N6处理相比,接种生防菌可以最大程度缓解病原菌对植株造成的损伤,提高植株叶绿素含量、生物量并达到增粗的效果。N1和N3处理株高低于对照,茎粗、叶绿素含量显著高于对照,叶面积、地上部鲜重和地下部鲜重则与对照无显著性差异。N6处理的茎粗、叶绿素含量及生物量显著高于对照,株高、叶面积与对照组无显著性差异。综合评价可知与CK1相比,N1、N3和N6菌株对黄瓜幼苗均有一定的促生效果,特别是在增粗、提高叶绿素含量方面,3个生防菌处理相比,N6菌株的促生效果最佳,显著优于N1和N3菌株。
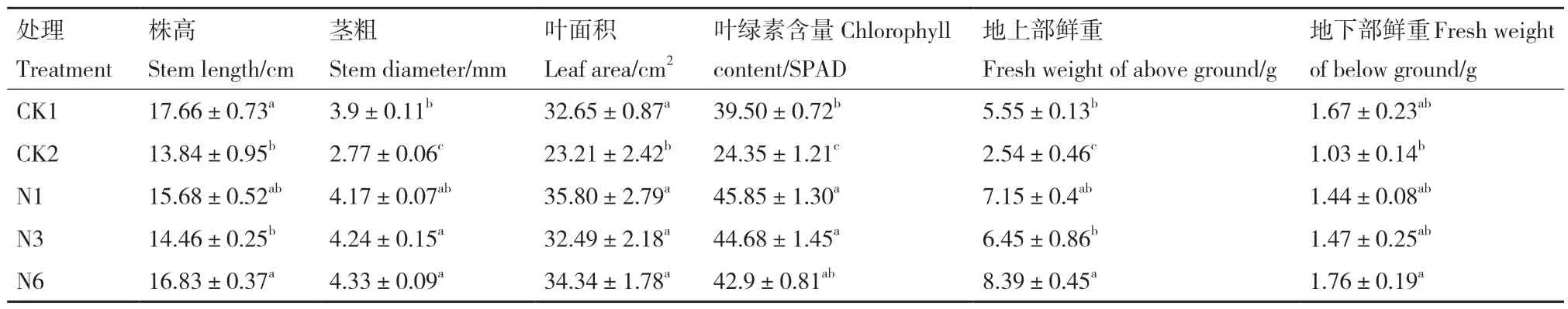
表6 菌株对黄瓜幼苗的促生效果Table 6 Growth-promoting effect of strains on cucumber seedlings
3 讨论
黄瓜枯萎病严重威胁设施蔬菜生产的产量和品质,传统的农业防治、化学防治等方法都有一定的弊端,应用微生物防治枯萎病是一条有效的技术途径[23]。其中生防细菌由于所需营养少、根际定植迅速、繁殖快等优点而具有很大的发展潜力。Banat等[24]研究发现,防治植物病害潜能的生防细菌有假单胞菌(Pseudomonas sp.)、芽孢杆菌、沙雷氏菌(Serratia sp.)等,主要的生防菌是芽孢杆菌和假单胞菌。据报道,从番茄中分离出来的2株丁香假单胞菌(Pseudomonas syringae)对黄瓜枯萎病病原菌具有显著抑制作用,显著降低枯萎病的发病率[25],并且可以通过诱导植物的系统抗性(ISR)从而在植物防御机制激活和植物生长促进中起重要作用[26]。
生物防治主要是利用拮抗微生物及其代谢产物防治植物病害。已报道芽孢杆菌可以产生抗生素、降解酶、ACC脱氨酶、挥发性化合物等参与拮抗菌的生物控制间接促进植物生长[27]。马兴[28]发现生防细菌分泌挥发性物质抑制黄瓜枯萎病病原菌菌丝的生长。部分芽孢杆菌通过溶解磷酸盐、产生铁载体、生物固氮等方式提高植物根际养分的可利用性。本研究贝莱斯芽孢杆菌N1、N3和N6严重抑制了尖镰孢菌的生长,经抗病促生特性鉴定,3株菌株均可产生几丁质酶、果胶酶和蛋白酶,分解尖镰孢菌细胞壁进入细胞,从而抑制病原菌的生长,这与杨茉[29]研究结果一致。此外,3株菌株显著提高了植株叶绿素含量、促进植株生物量积累的功能,通过溶解钾帮助根系吸收矿物质元素,并产生铁载体增加土壤中可被植物吸收的有效态铁元素含量,促进植株对铁元素的吸收,达到促生的效果。
生防菌株能否在植物根际或根部有效定殖是决定根部病害防治成功的关键一步[26]。PGPR定殖在植物根际,可以促进植株生长。试验明确了筛选出的3株贝莱斯芽孢杆菌对尖镰孢菌菌丝生长具有显著抑制效果,这可能与贝莱斯芽孢杆菌对尖镰孢菌菌丝具有强致畸能力有关[30],但盆栽效果并不如平板对峙试验效果显著,说明N1和N3可能并没有在植株根际迅速定殖,没有占据有利生态位点,可能是由于贝莱斯芽孢杆菌在根际定殖效果差或复杂的基质环境导致的。而N6盆栽试验效果与平板对峙效果一致均具有显著防病效果,具有很大的生防潜力。探究贝莱斯芽孢杆菌在植株根系的定植机制以及复杂的基质环境对贝莱斯芽孢杆菌繁殖的影响需要进一步探究。
芽孢杆菌N1、N3和N6具有良好的防病促生效果,为黄瓜尖镰孢菌枯萎病的生物防治提供了理论依据,也为芽孢杆菌的产业化开发提供了菌种资源。但对其防病效果的广谱性、其在根际定殖的动态规律与代谢产物的研究、发酵工艺优化等均有待进一步明确,以便全面地发掘N1、N3和N6的防治潜力,进而研发出多功能的芽孢杆菌制剂。
4 结论
筛选出3株对尖镰孢菌拮抗效果显著的贝莱斯芽孢杆菌N1、N3和N6,抑菌率分别为77.71%、75.94%和74.76%,菌株防病效果分别为41.94%、20.97%、66.13%。接种N1、N3和N6可以显著促进黄瓜幼苗的株高、茎粗、叶面积、叶绿素含量、地上和地下部鲜重的增加,其中N6处理增加效果最显著,可作为防控黄瓜苗期尖镰孢菌枯萎病、促进黄瓜幼苗生长有潜力的生物防治资源。

