金花茶CnbHLH79转录因子的克隆、亚细胞定位及表达分析
李博 刘合霞 陈宇玲 周兴文 朱宇林
(1. 玉林师范学院生物与制药学院,玉林 537000;2. 福建工程学院建筑与城乡规划学院,福州 350118;3. 玉林师范学院广西高校亚热带生物资源保护与利用重点实验室,玉林 537000)
金花茶(Camellia nitidissima)为山茶科(Theaceae)山茶属(Camellia)植物,主要分布在中国广西地区[1]。金花茶花色金黄,是培育黄色山茶的珍贵种质资源[2]。已有研究表明,金花茶花瓣中富含的类黄酮物质,不仅是金花茶抵御外界胁迫的有用物质,而且可能是促使金花茶开黄花的关键色素[3-4]。植物中类黄酮的合成由一系列结构基因编码的酶催化完成[5-6]。目前,利用转录组测序及基因克隆技术,金花茶中类黄酮合成途径的大部分结构基因已被克隆[7-11],金花茶花色形成机理正在逐渐阐明,但是关于金花茶花色的转录水平调控机制及转录因子的作用机理尚不明确。
MYB转录因子、碱性螺旋-环-螺旋(bHLH)转录因子、WD40 转录因子及其互作形成的MBW(MYB-bHLH-WD40)复合体是植物中广泛存在、可调控植物类黄酮物质合成的关键转录因子[12-14]。目前,许多构成MBW复合体的转录因子已陆续从各种植物中被分离和克隆出来,利用亚细胞定位、酵母杂交实验、双荧光素酶互补反应实验等技术手段,这些转录因子的调控机制已被阐明,MBW复合体或单独的MYB、bHLH均可参与调节植物组织的着色,在类黄酮合成途径中发挥重要的调控作用。例如,MBW复合体可调节茶树(Camellia sinensis)叶片中类黄酮物质的合成以及叶片颜色的形成[15];而矮牵牛(Petunia hybrida)[16]、蝴蝶兰(Phalaenopsis aphrodite)[17]、百合(Lilium brownii)[18]等植物的MBW复合体或单独的MYB、bHLH则可调节花瓣颜色形成,使花瓣呈现多彩的颜色,或使花瓣上形成类型各异的花斑;此外,将克隆获得的MYB或bHLH导入到非同种植物中进行异源表达,也能发挥其调控花色改变的作用[19-20]。
本课题组前期研究发现,CnbHLH79转录因子在金花茶开花过程中差异表达,且它与部分催化类黄酮合成的结构基因及MYB转录因子具有较高的相关性,推断该转录因子可能是MBW复合体的关键成员之一(数据未发表)。但是金花茶CnbHLH79转录因子的克隆鉴定,以及它在金花茶中的表达情况尚未见报道。因此,本研究以金花茶花瓣作为研究材料,克隆金花茶CnbHLH79转录因子的全长序列,对该转录因子进行生物信息学分析和亚细胞定位研究,在转录水平上分析CnbHLH79转录因子在金花茶的侧根、茎、叶、盛开的花等不同组织,以及不同开花时期花瓣中的表达模式,并分析CnbHLH79转录因子的表达量与色相b*、类黄酮物质含量的相关关系。本研究为阐明CnbHLH79转录因子在金花茶类黄酮的合成调控机制,以及调控花瓣显黄色的作用机理奠定基础,为黄色山茶品种的培育提供理论依据。
1 材料与方法
1.1 材料
采集金花茶的根、茎、叶、花等不同组织,以及不同开花时期的花瓣(图1),该金花茶植株种植在广西玉林师范学院的苗圃内(N 22°40'58'',E 110°11'27'')。利用液氮速冻采集到的金花茶组织,然后保存在-70℃超低温冰箱中备用。
1.2 方法
1.2.1 金花茶不同组织总RNA的提取及CnbHLH79转录因子的克隆 首先利用RNA提取试剂盒(RNAprep Pure DP441,天根生化科技,中国北京)提取金花茶的根、茎、叶、花、花瓣等不同组织的总RNA,随后对金花茶总RNA进行琼脂糖凝胶电泳检测,再利用反转录试剂盒(PrimerScripTMRT reagent Kit, TaKaRa,中国大连)对总RNA进行反转录,从而获得cDNA模板。利用金花茶花瓣组织的转录组测序所获得的unigene序列,并从中筛选出金花茶CnbHLH79转录因子序列,利用prime primer 3在线软件设计出金花茶CnbHLH79转录因子的扩增特异性引物(表1),并利用该对引物对金花茶CnbHLH79转录因子进行PCR扩增,PCR反应程序如下:94℃预变性2 min;98℃变性10 s,55℃退火30 s,68℃延伸60 s,共32个循环;68℃延伸5 min。

表1 CnbHLH79转录因子克隆、亚细胞定位以及表达定量所用引物Table 1 Primers used for cloning, subcellular localization and quantitative analysis of CnbHLH79
利用1%琼脂糖凝胶电泳检测PCR扩增获得的产物,并将852 bp的电泳片段切下,使用琼脂糖凝胶DNA回收试剂盒(DP209-03,天根生化科技,中国北京)回收目的片段,按照试剂盒说明书进行操作。将目的片段连接在pEGOEP35S-H载体上(艾迪晶,中国武汉),再转化到大肠杆菌(Escherichia coli)DH5α(TaKaRa,中国大连)中,随后进行菌落PCR检测,提取阳性菌斑的质粒进行测序,测序工作由武汉艾迪晶生物公司完成。
1.2.2 CnbHLH79转录因子的生物信息学分析 使用ORF Finder(http://www.bioinformatics.org/sms2/orf_find.html)预测金花茶CnbHLH79转录因子的开放阅读框。通过NCBI网站的blastp程序(https://blast.ncbi.nlm.nih.gov/Blastp)进行同源性比对,获取金花茶CnbHLH79的同源基因。随后利用ExPASy在线网站(https://web.expasy.org/protparam/)预测金花茶CnbHLH79的蛋白质性质。而CnbHLH79蛋白的亚细胞定位及二级结构预测则通过利用Plant-mPLoc在线网站完成(http://www.csbio.sjtu.edu.cn/cgibin/PlantmPLoc.cgi),并利用DNAMAN 8.0软件对bHLH79蛋白进行多序列比对。利用SWISS-MODEL在线网站(https://swissmodel.expasy.org/interactive)对金花茶CnbHLH79蛋白的三级结构模型进行预测。再利用MEGA10软件,采用最大似然法(maximum likelihood, ML)构建系统进化树,分析CnbHLH79同源基因的系统进化关系(bootstrap=1000)。
1.2.3 金花茶CnbHLH79蛋白的亚细胞定位分析 构建融合表达载体pEGOEP35S-H-bHLH79-GFP,将其转化大肠杆菌DH5α感受态细胞,挑取阳性克隆进行测序。利用电转化法,将测序结果正确的阳性克隆的质粒转化到根瘤农杆菌(GV3101)。将农杆菌菌液注射到烟草下表皮叶片,弱光培养48 h后,将烟草叶片制作成玻片,在激光共聚焦显微镜(FV3000,Olympus公司,日本)下观察,并拍照。
1.2.4 CnbHLH79转录因子的定量分析及相关性分析 利用Primer 5软件设计CnbHLH79转录因子的荧光定量PCR引物(表1);利用18S rRNA作为内参基因进行荧光定量PCR反应[9,21],检测CnbHLH79转录因子在侧根、茎、叶、盛开的花等不同组织中的表达情况,此外还检测了CnbHLH79转录因子在花瓣发育过程中的表达情况,每个样品重复3次,采用 2-ΔΔCT法[22]计算差异基因的相对表达量,并利用单因素方差分析模型分析不同表达量之间是否存在显著性差异。将开花过程中CnbHLH79在花瓣中的表达量与金花茶的色相b*值、槲皮素-7-O-葡糖苷(quercetin 3-O-rhamnoside-7-Oglucoside, Qu7G)、槲皮素-3-O-葡糖苷(quercetin 3-O-glucoside, Qu3G)、槲皮素(quercetin)、山奈酚(kaempferol)等类黄酮物质含量(上述数值来自课题组之前的实验研究)[4]进行Pearson相关性分析,研究CnbHLH79的表达量与花色表型指标之间的相关性。
2 结果
2.1 金花茶CnbHLH79基因的克隆
以金花茶花瓣的cDNA为模板,利用特异性引物进行扩增,得到850 bp左右的扩增条带(图2);随后对扩增产物行测序,测序结果显示,克隆获得的金花茶CnbHLH79转录因子序列的开放阅读框长度为855 bp,该转录因子共编码284个氨基酸。在NCBI数据库中对CnbHLH79的编码序列进行Blast比对发现,CnbHLH79与茶树(C. sinensis)bHLH79-like转录因子(XP_028119408.1)、褐枝猕猴桃(Actinidia rufa)bHLH79-like转录因子(GFS32687.1)、中华猕猴桃(Actinidia chinensis var. chinensis)bHLH79-like转录因子(PSS07838.1)的相似性较高,CnbHLH79与这3个转录因子的相似性(identity)分别为98.94%、72.79%、72.44%。

图2 金花茶CnbHLH79基因cDNA 的PCR扩增Fig. 2 PCR amplification of CnbHLH79 gene cDNA in C. nitidissima
2.2 金花茶CnbHLH79转录因子的特征分析
对金花茶CnbHLH79转录因子的蛋白质特征及保守结构域分析,结果显示金花茶CnbHLH79转录因子所编码蛋白的分子式为C1294H2088N400O439S14,原子总数为4235,蛋白分子质量约为30.72 kD,等电点(pI)为7.02。CnbHLH79蛋白具有bHLH_AtBPE_like保守结构域,它的起止氨基酸位点为150-235位,该结构域属于bHLH_SF超基因家族(superfamily)(图3-A),分析结果显示金花茶CnbHLH79蛋白具有植物bHLH转录因子的典型保守区域。此外,对金花茶CnbHLH79转录因子、拟南芥(Arabidopsis thaliana)AtbHLH79转录因子(AT5G62610.1)、茶树CsbHLH79_like转录因子(XP_028119408.1)、褐枝猕猴桃ArBPEp转录因子(GFS32687.1)的蛋白序列进行多序列比对发现,它们都具有相同的保守区域(图3-B),其中近缘物种金花茶和茶树的CnbHLH79蛋白序列的相似性最高。
CnbHLH79蛋白含有影响蛋白质酸碱性的氨基酸共66个,其中呈碱性的氨基酸有33个,由19个精氨酸(Arg)、14个赖氨酸(Lys)所组成,而呈酸性的氨基酸有33个,由17个天冬氨酸(Asp)、16个谷氨酸(Glu)组成;CnbHLH79蛋白的不稳定系数值(instability index)为54.75,显示该蛋白为不稳定蛋白;CnbHLH79蛋白的亲水指数(grand average of hydropathicity, GRAVY)为-0.662,显示该蛋白具有亲水性,而脂溶指数(aliphatic index)则为64.26。
利用Psipred在线网站(http://bioinf.cs.ucl.ac.uk/psipred/)预测CnbHLH79蛋白的二级结构域发现,该蛋白主要包含无规则卷曲(random coil)和α-螺旋元件(α-helix),这两种元件所占的比例分别为68.66%、31.33%,而β-折叠元件、β-转角等其他类型的元件则没有预测到。此外,利用SWISS-MODEL对金花茶CnbHLH79蛋白进行三级结构预测发现,CnbHLH79蛋白主要由2个α-螺旋元件和2个无规则卷曲元件组成,研究结果表明CnbHLH79蛋白的二级结构和三级结构的预测结果基本相符(图4)。随后,利用Plant-mPLoc在线网站对CnbHLH79蛋白的亚细胞定位进行预测发现,CnbHLH79蛋白定位在细胞核中的可能性较大。
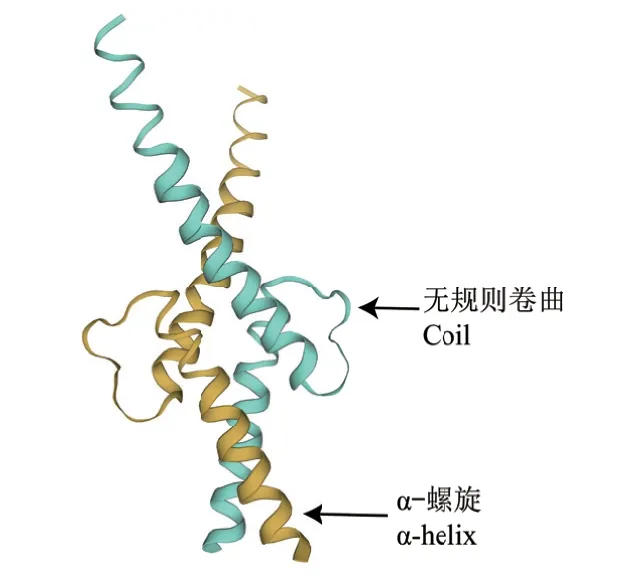
图4 金花茶CnbHLH79蛋白的三维结构预测Fig. 4 Tertiary structure prediction of CnbHLH79 protein in C. nitidissima
2.3 金花茶CnbHLH79蛋白的同源性比对及系统进化分析
为解析金花茶CnbHLH79蛋白在植物系统进化中的关系,本研究通过Blast比对,获取了17条与金花茶CnbHLH79蛋白同源性较高的蛋白序列(identity>65%),随后利用这17条序列与CnbHLH79蛋白序列一起构建系统进化树(图5)。分析结果表明,金花茶CnbHLH79蛋白与同为山茶科山茶属的茶树bHLH79蛋白的亲缘关系最近,它们在系统进化树中被聚类在一个小分支内。另外还发现金花茶CnbHLH79蛋白与高丛越橘(Vaccinium corymbosum)的VcbHLH044蛋白、中华猕猴桃(A.chinensis var. chinensis)的AcbHLH79_like蛋白、褐枝猕猴桃(A. rufa)的ArBPEp蛋白也具有较高的相似性,CnbHLH79蛋白与这些蛋白亲缘关系较近,它们被聚类在同一个小簇中。而金花茶CnbHLH79蛋白与灯笼辣椒(Capsicum baccatum)的CbbHLH79蛋白、辣椒(Capsicum annuum)的CabHLH_like89蛋白的亲缘关系最远。

图5 金花茶CnbHLH79蛋白系统发生树Fig. 5 Phylogenetic tree of protein CnbHLH79 in C. nitidissima
2.4 金花茶CnbHLH79转录因子的亚细胞定位验证
Plant-mPLoc在线预测结果显示,金花茶CnbHLH79蛋白定位于细胞核中,为了验证上述预测结果,构建获得了pEGOEP35S-H-CnbHLH79-GFP载体表达载体,通过农杆菌介导的烟草叶片下表皮细胞瞬时转化实验,分析金花茶CnbHLH79蛋白在细胞中的定位情况。目标蛋白主要使表皮细胞的细胞核发出绿色荧光,且在细胞核中与红色荧光染料(SV40 NLS)共定位,实验结果(图6)显示,CnbHLH79-GFP蛋白定位于细胞核中,表明该转录因子主要在细胞核中发挥功能。

图6 CnbHLH79蛋白的亚细胞定位Fig. 6 Subcellular localization of the protein CnbHLH79(Bar = 50 μm)
2.5 金花茶CnbHLH79的表达分析及相关性分析
通过对金花茶CnbHLH79转录因子的荧光定量PCR分析发现,该转录因子主要在金花茶的根和花中高表达,而在茎和叶中的表达量则相对较低(图7)。此外,还发现在不同开花阶段的花瓣中,CnbHLH79转录因子的表达总体呈现先高后低,逐步下降的趋势,在幼蕾期、初蕾期的表达量较高,在半开期、盛开期的表达量较低(图8)。将开花过程中CnbHLH79在花瓣中的表达量与金花茶的色相b*值、槲皮素-7-O-葡糖苷、槲皮素-3-O-葡糖苷、槲皮素、山奈酚等类黄酮物质含量的Pearson相关性分析,结果表明,CnbHLH79的表达量与色相b*值、槲皮素-7-O-葡糖苷的负相关性较高,其相关性系数分别为-0.92、-0.7(图9)。

图7 CnbHLH79在不同组织中的基因表达量Fig. 7 Relative expressions of CnbHLH79 in different culture
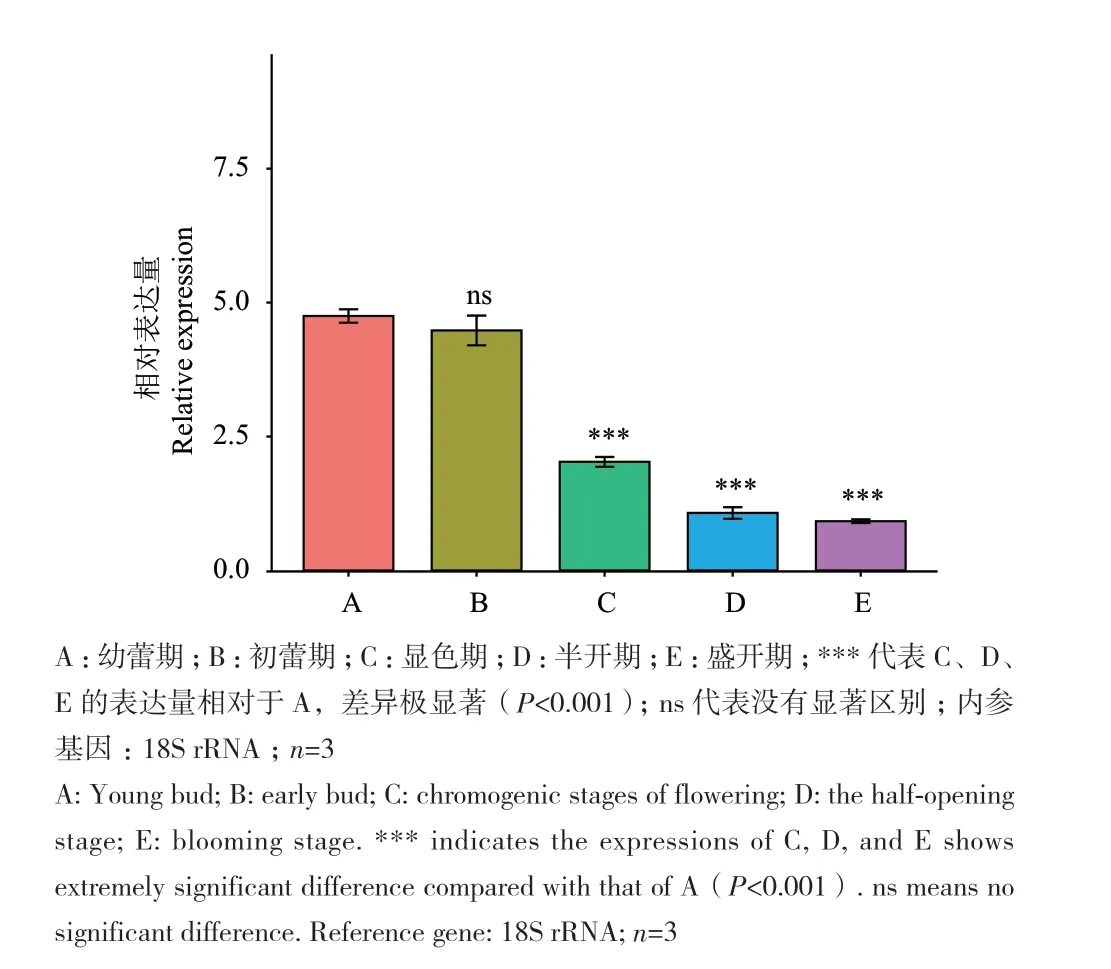
图8 CnbHLH79转录因子在不同开花时期的表达量Fig. 8 Expressions of CnbHLH79 at different flowering stages
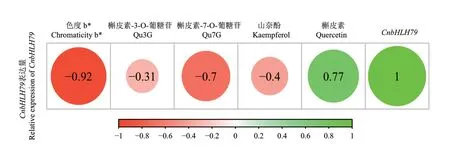
图9 CnbHLH79的表达量与花色指标、类黄酮化合物的相关性分析Fig. 9 Correlation analysis between expression of CnbHLH79 and color index, content of flavonoid compounds
3 讨论
3.1 CnbHLH79转录因子对金花茶花色形成的调控作用分析
bHLH基因家族作为植物第二大转录因子家族,在类黄酮代谢、逆境胁迫响应、植物生长发育等方面发挥了重要的调控作用[23-25]。例如,玉米(Zea mays)中bHLH转录因子B-peru和拟南芥mPAP1基因能协同作用,可增加番茄(Solanum lycopersicum)花瓣中类黄酮化合物的含量,使花瓣颜色变深[26];荷花(Nelumbo nucifera)中的bHLH转录因子NnTT8具有调节花青素和原花青素合成的功能,该基因可改变转基因拟南芥的种皮颜色[27];石斛杂交种(Dendrobium hybrids)的DhbHLH1转录因子可与DhMYB2共同作用,使石斛杂交种的白色花瓣生成紫色斑点[28];并且这些基因在它们发挥功能的部位都具有较高的表达量。金花茶CnbHLH79转录因子在不同组织中的荧光定量分析结果表明,CnbHLH79转录因子在金花茶根和花中的表达量较高,由此推断该转录因子主要在这两个组织中发挥作用。另外,还发现在金花茶开花过程中CnbHLH79转录因子在花瓣中的表达总体呈先高后低的下降趋势,所以CnbHLH79转录因子可能在开花过程的早期具有调控的作用。Liu等[29]在对金花茶全长转录组的研究中通过WGCNA分析发现,CnbHLH79转录因子与类黄酮合成通路中的结构基因PAL(phenylalanine ammonia-lyase)存在于一个共同的调控网络中,且CnbHLH79转录因子与该网络的核心基因PAL具有较高的关联度,CnbHLH79转录因子可能通过调控PAL的表达来调节金花茶花瓣中类黄酮物质的合成。此外,已有研究表明金花茶花瓣中的槲皮素-7-O-葡糖苷(Qu7G)、槲皮素-3-O-葡糖苷(Qu3G)是影响金花茶花色形成的关键化合物[30],色相b*是金花茶花色描述的主要指标[31]。本课题组在之前的研究中发现,CnbHLH79转录因子在花瓣发育过程中的表达量,与苯丙氨酸解氨酶(phenylalanine ammonialyase, PAL)、查尔酮合成酶(chalconesynthase, CHS)、二氢黄酮醇-4-还原酶(difunctional dihydroflavonol 4-reductase/flavanone 4-reductase, DFR)、黄酮醇合成酶(flavonol synthase, FLS)等类黄酮合成途径的结构基因的表达量,具有较强的相关性;且在本研究中通过相关性分析发现,CnbHLH79转录因子的表达量与金花茶花瓣的花色指标(色度b*值)、类黄酮物质含量,例如槲皮素-7-O-葡糖苷(Qu7G),具有较强的负相关性,因此推断CnbHLH79基因对于金花茶花色的形成以及类黄酮物质的合成,可能具有负调控的功能。
3.2 CnbHLH79转录因子对冷胁迫的作用分析
类黄酮化合物是植物中广泛存在的一类次生代谢物质,它可以提高植物对逆境的适应能力[32]。类黄酮化合物主要通过防止活性氧的产生以及清除已生成的活性氧,来完成其抗氧化功能,进而提高植物的适应性[33-34]。例如,在低温条件下,类黄酮化合物在苹果中会大量积累,从而提高苹果对低温逆境的适应能力[35]。此外,已有研究发现bHLH79转录因子具有提高植物适应冷胁迫的功能,例如在冷胁迫环境中,茶树CsbHLH79转录因子的表达量会显著提高[36]。CabHLH79通过调控CaNAC035的表达,进而增强活性氧簇(reactive oxygen species,ROS)相关基因及冷耐受基因的表达,从而提高辣椒对冷胁迫的适应性[37]。金花茶主要在冬季开花,不同开花过程的花瓣中CnbHLH79转录因子在低温环境中存在差异表达现象,并且该转录因子的表达量与槲皮素、槲皮素-7-O-葡糖苷等物质的相关性较强,因此在金花茶中可能存在着通过CnbHLH79转录因子调节类黄酮物质合成,从而适应低温逆境的机制。但目前有关金花茶CnbHLH79转录因子的功能研究尚未见报道,该转录因子的具体功能仍有待深入研究。
4 结论
CnbHLH79转录因子具有bHLH基因家族的bHLH_AtBPE_like保守结构域,与茶树bHLH79蛋白的亲缘关系最近,亚细胞定位在细胞核中,且主要在金花茶的根、花等组织中高表达。在金花茶开放过程中,CnbHLH79的表达量总体呈先高后低的趋势。此外,CnbHLH79的表达量与色相b*值、槲皮素-7-O-葡糖苷的负相关性较高。因此,推断CnbHLH79发挥功能的场所是在细胞核中,它主要在金花茶的根、花中发挥作用,且可能在金花茶花朵开放的早期对类黄酮物质合成进行负向调控。

