HCAR2介导低氧促K562细胞向红系分化作用
陈 迎,李 建,曹 炎,何云凌,吴丽颖,周钢桥
羟基羧酸受体2(hydroxy-carboxylic acid receptor 2,HCAR2)是一种Ⅱ型羟基羧酸受体,多在脂肪细胞中表达,并发挥抗脂解的作用[1]。低氧会上调人原代单核细胞和巨噬细胞中HCAR2的表达[2]。但是,低氧是否影响K562细胞中HCAR2的表达,以及HCAR2在K562细胞中发挥的作用目前尚不清楚。
人慢性髓系白血病K562细胞是一种红细胞和巨核细胞谱系高度未分化的祖细胞[3],具有分化为红系细胞和巨核细胞的潜力[4],有报道指出,低氧能够加速K562向红系分化的进程[5]。由于在hemin刺激下[6]K562细胞会产生胚胎型和胎儿型血红蛋白,这一特性为人类红系分化相关研究提供了一种理想的细胞模型。因此,该研究以K562细胞作为红系分化研究的体外模型,探究HCAR2对K562细胞向红系分化的影响,为揭示红系发育相关疾病的致病机制及研发相关诊疗药物提供新的思路。
1 材料与方法
1.1 材料
1.1.1实验细胞和载体 人慢性髓系白血病细胞K562受赠于军事医学研究院王华副研究员,HEK293T细胞保存于辐射医学研究所遗传学与整合组学实验室细胞库;pCDH-control-puro、pCDH-HCAR2-puro、pLVX-control-Puro、pLVX-HCAR2-puro均购于长沙优宝生物科技有限公司;包装质粒psPAX2和pMD2.G储存于辐射医学研究所遗传学与整合组学实验室。
1.1.2主要试剂和仪器 RPMI-1640培养基、FITC-CD71抗体购自美国Thermo Fisher Scientific公司;全细胞裂解液RIPA、山羊抗小鼠/兔二抗购自北京康为世纪生物科技有限公司;脱脂奶粉、APC-CD235a抗体购自美国BD Biosciences公司;逆转录试剂盒购自武汉莫纳生物科技有限公司;HM74抗体购自美国Bioword Technology Inc公司;β-actin抗体、CD235a抗体购自武汉Abclonal公司;γ-globin抗体购自美国Santa Cruz公司;hemin购自美国Sigma Aldrich公司;蛋白酶抑制剂购自瑞士Roche公司;一抗稀释液、ZLip2000转染试剂购自北京庄盟国际生物基因科技有限公司;SYBR Green荧光定量试剂盒购自美国Kapa Biosystems公司;二氧化碳培养箱(型号:FormaTM)购自美国Thermo Fisher Scientific公司;显微镜(型号:ECLIPSE Ti2)购自日本Nikon公司;流式细胞仪(型号:FACSAriaTMIII)购自美国BD公司;荧光定量PCR仪(型号:QuantStudioTM3)购自美国Applied Biosystems公司;SDS-PAGE电泳仪、电转仪购自美国Bio-Rad公司;全自动化学发光图像分析系统(型号:5200)购自上海天能公司。
1.2 方法
1.2.1细胞培养及向红系诱导分化 将K562细胞置于补充有10%胎牛血清和1%青链霉素的RPMI-1640培养基中,并在37 ℃、5%CO2、饱和湿度条件下培养。将K562细胞按照3×105/ml的密度铺于60 mm培养皿中,根据课题组前期筛选的最适药物终浓度(30 μmol/L),加入hemin诱导向红系分化。
1.2.2低氧处理条件 将K562细胞(3×105/ml)平均分为两组分别置于低氧(3% O2)和常氧(20% O2)培养箱中培养1、2、3 d;敲低和过表达的细胞株以相同密度铺板,分组标记,分别在常氧和低氧培养箱中培养2 d。
1.2.3慢病毒包装 利用HIV病毒将自身基因组插入整合到宿主基因组的特性,向HEK293T细胞转入psPAX2、pMD2.G和目的质粒。HEK293T接种于100 mm培养皿,待细胞密度达到70%~80%,按ZLip2000转染试剂说明书进行转染,目的质粒、psPAX2、pMAD2.G以3 ∶2 ∶1的比例添加。于转染后48 h回收含有病毒的培养基,用病毒浓缩液浓缩离心后分装,-80 ℃保存备用。
1.2.4HCAR2敲低、过表达稳转株的构建 用浓缩后的病毒液感染K562细胞,同时加入10 μg/ml的聚凝胺(Polybrene)以促进病毒进入细胞。感染48 h后,利用嘌呤霉素抗性进行药物筛选,之后通过检测HCAR2的mRNA和蛋白表达水平来鉴定敲低、过表达稳转株是否构建成功。shRNA序列见表1。
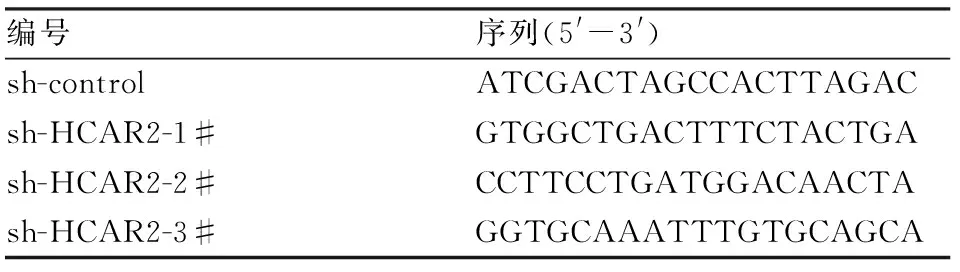
表1 shRNA靶向序列
1.2.5联苯胺染色观察红细胞生成比例 收取分化后的K562细胞,用PBS重悬细胞,将细胞密度调整为1×105个/ml,取100 μl细胞悬液与5 μl联苯胺工作液(配方:25 μl 联苯胺染液+25 μl H2O+1 μl H2O2)混匀,加入96孔板,室温避光反应5 min。最后在光学显微镜下进行观察拍照,每组至少随机选取5个视野,用以计算联苯胺阳性细胞比例。
1.2.6Western blot检测蛋白表达水平 收取细胞,离心后加入全细胞裂解液RIPA吹打均匀,4 ℃裂解30 min,12 000 r/min离心10 min后吸取上清液,加4×上样缓冲液煮沸10 min,-20 ℃冻存备用。根据目的蛋白分子量选用合适浓度的丙烯酰胺凝胶,上样、电泳、转膜,经5%脱脂奶粉封闭1 h、一抗4 ℃孵育过夜、二抗室温孵育1 h,最后在凝胶成像仪中显影。
1.2.7实时荧光定量PCR(RT-qPCR)检测mRNA水平 收集细胞,提取细胞总RNA,测定RNA样品浓度并进行逆转录。RT-qPCR反应体系在96孔板中充分混匀,置于RT-qPCR仪上进行反应,每组设3个复孔,以β-actin为内参进行定量分析。RT-qPCR引物序列见表2。

表2 RT-qPCR的引物序列
1.2.8流式细胞术 收取经处理后的各组细胞,每组细胞量不少于1×105个,用100 μl PBS溶液重悬细胞,加入CD235a抗体和CD71抗体,室温下避光孵育15 min,之后PBS洗3次,重悬于300 μl PBS中,混合均匀后用流式细胞仪进行检测。
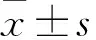
2 结果
2.1 低氧对K562细胞向红系分化的影响联苯胺染色结果显示,无论在常氧还是低氧条件下,联苯胺阳性细胞比例均随分化时间逐渐升高;且与常氧组相比,低氧组联苯胺染色阳性细胞比例更高(F=175.9,P<0.05)(图1A、B)。RT-qPCR和Western blot实验分别检测了红系细胞特异性分子CD235a和γ-globin的蛋白及mRNA表达水平,相较于常氧组,低氧组CD235a和γ-globin的表达增加(FCD235a=127.0,Fγ-globin=158.1,P<0.05)(图1C~E)。流式细胞术检测CD71和CD235a的表达情况,结果显示在分化的不同时间点,低氧组CD71+/CD235a+细胞的百分比均高于常氧组(F=85.8,P<0.01)(图1F、G)。
图1 低氧对K562细胞向红系分化的影响A、B:联苯胺染色观察K562细胞红系分化情况及其统计直方图 ×200;C:Western blot实验检测CD235a及γ-globin的蛋白表达变化;N:常氧组;H:低氧组;D、E:RT-qPCR检测CD235a及γ-globin的mRNA水平;F、G:流式细胞术检测CD71+/CD235a+细胞百分比及其统计直方图;与常氧组比较:*P<0.05,**P<0.01,***P<0.001
2.2 HCAR2与红系分化的相关性根据Western blot和RT-qPCR实验结果,低氧组HCAR2蛋白和mRNA的表达均高于常氧组(F=110.0,P<0.05)(图2A、B);与此同时,CD235a和γ-globin在低氧下的蛋白表达上调,变化趋势与HCAR2相似(图2A)。因此,采用pearson法进一步分析,发现K562细胞向红系分化过程中HCAR2分别与CD235a(r=0.631 1,P=0.006 6)和γ-globin(r=0.814 1,P<0.000 1)的mRNA水平呈正相关(图2C、D)。
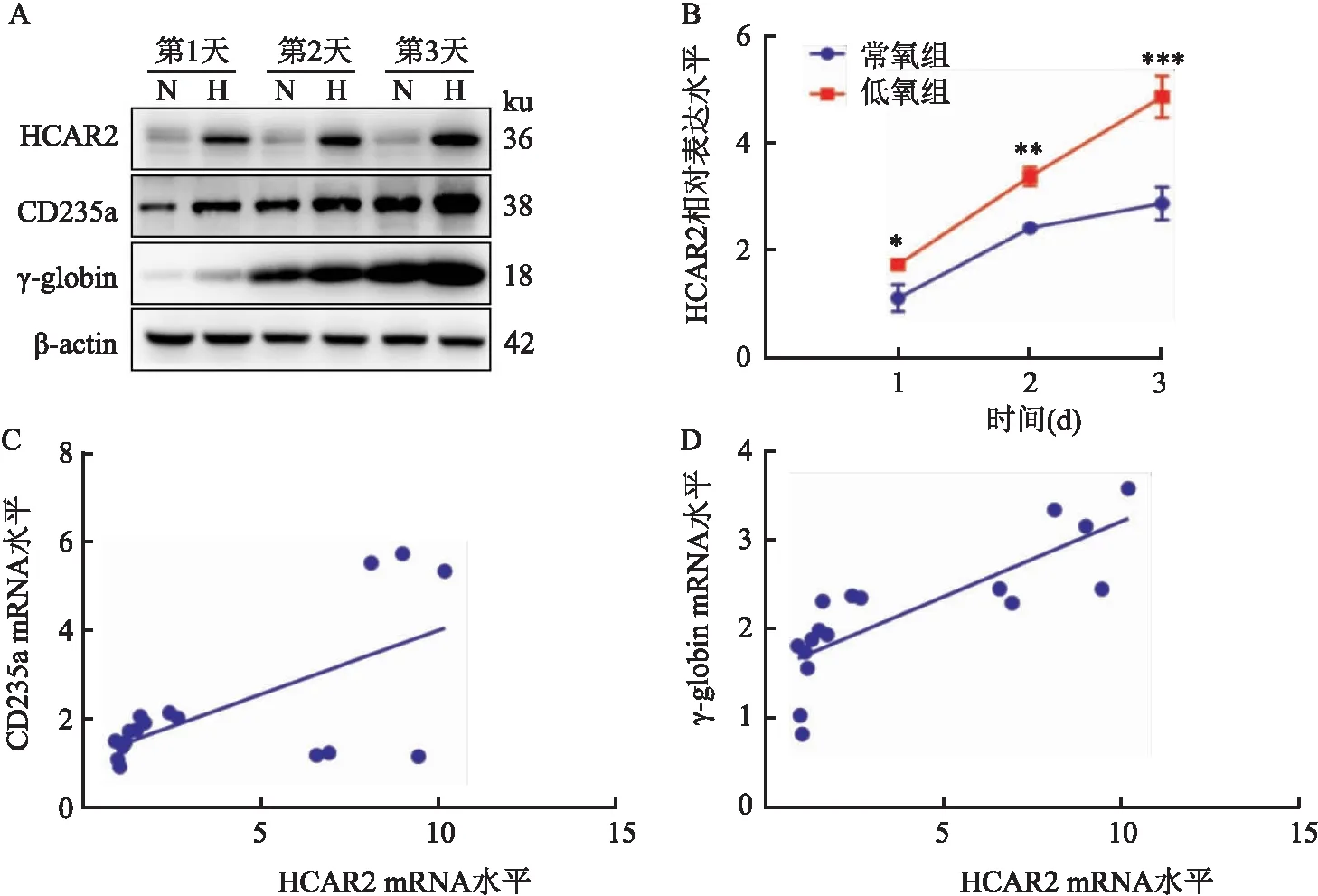
图2 HCAR2与红系分化的相关性A:Western blot实验检测HCAR2、CD235a及γ-globin的蛋白表达变化;N:常氧组;H:低氧组;B:RT-qPCR检测HCAR2的mRNA水平;C:HCAR2与CD235a 表达的相关性散点图;D:HCAR2与γ-globin表达的相关性散点图;与常氧组比较:*P<0.05,**P<0.01,***P<0.001
2.3 敲低HCAR2对低氧促红系分化的影响为了进一步探讨HCAR2对红系分化的影响,通过慢病毒感染构建了稳定敲低HCAR2的K562细胞株,用来研究HCAR2低表达对K562细胞向红系分化的影响。Western blot和RT-qPCR实验分别检测了敲低HCAR2后,K562细胞向红系分化时CD235a和γ-globin蛋白和mRNA的表达变化。结果显示,敲低HCAR2后,无论常氧组还是低氧组CD235a和γ-globin蛋白的表达均下调(图3A),CD235a和γ-globin的mRNA水平均降低(FCD235a=129.4,Fγ-globin=30.02,P<0.05)(图3B、C)。随后通过联苯胺染色观察显示,在常氧和低氧下敲低HCAR2均会使得联苯胺阳性细胞比例降低(F=31.86,P<0.05)(图3D、E)。流式细胞术检测结果显示敲低HCAR2后常氧组和低氧组中CD71+/CD235a+细胞百分比均有所减小(F=118.2,P<0.001)(图3F、G)。
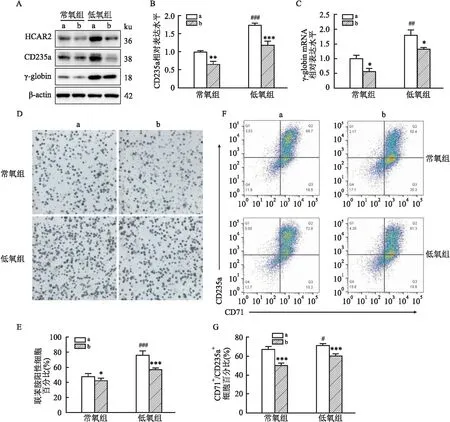
图3 敲低HCAR2对低氧促红系分化的影响A:Western blot实验检测HCAR2、CD235a及γ-globin的蛋白表达变化;B、C:RT-qPCR检测CD235a和γ-globin的mRNA水平;D、E:联苯胺染色观察K562细胞红系分化情况及其统计直方图 ×200;F、G:流式细胞术检测CD71+/CD235a+细胞百分比及其统计直方图;a:shCtrl组;b:shHCAR2组;与shCtrl组比较:*P<0.05,**P<0.01,***P<0.001;与常氧组比较:#P<0.05,##P<0.01,###P<0.001
2.4 HCAR2过表达对低氧促红系分化的影响Western blot实验结果显示常氧和低氧条件下过表达HCAR2后CD235a和γ-globin的蛋白表达上调(图4A),RT-qPCR实验结果显示HCAR2高表达时,CD235a和γ-globin的mRNA水平升高(FCD235a=67.04,Fγ-globin=81.74,P<0.05)(图4B、C)。联苯胺染色观察到过表达HCAR2后,常氧组和低氧组K562细胞中联苯胺阳性细胞比例均升高(F=52.99,P<0.01)(图4D、E)。流式细胞术检测结果显示,过表达HCAR2后CD71+/CD235a+细胞的百分比增加(F=53.37,P<0.05)(图4F、G)。
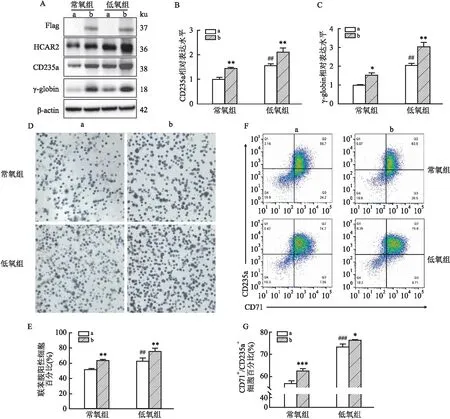
图4 HCAR2过表达对低氧促红系分化的影响A:Western blot实验检测HCAR2、CD235a及γ-globin的蛋白表达变化;B、C:RT-qPCR检测CD235a和γ-globin的mRNA水平;D、E:联苯胺染色观察K562细胞红系分化情况及其统计直方图 ×200;F、G:流式细胞术检测CD71+/CD235a+细胞百分比及其统计直方图;a:Vector组;b:HCAR2组;与Vector组比较:*P<0.05,**P<0.01,***P<0.001;与常氧组比较:##P<0.01,###P<0.001
3 讨论
研究表明低氧可促进红系分化,Cao et al[7]发现K562细胞中缺氧诱导因子-1 (hypoxia inducible factor-1, HIF-1)与TET3蛋白结合的位点缺失会抑制低氧条件下的红系分化,并使得细胞活力显著下降,这表明HIF-1可能介导了低氧促红系分化作用。之前的研究[8]进一步证实了HIF-1通过上调其靶基因REDD1来抑制mTORC1信号通路并增强自噬水平,从而促进了低氧下的红系分化进程。而本研究通过在常氧和低氧条件下分别诱导K562细胞向红系分化,观察到低氧具有促进K562细胞向红系分化的作用;在K562细胞向红系分化过程中HCAR2表达升高并受低氧调控。因此,推测HCAR2可能作为一个新的低氧靶分子参与调控红系分化过程。
本研究通过构建稳定敲低HCAR2的K562细胞株发现HCAR2的低表达能抑制K562细胞向红系分化,减弱低氧促红系分化的作用;同时,通过过表达HCAR2细胞株的构建,进一步证明了HCAR2的高表达更有利于红系分化,并且能够增强低氧对红系分化的促进作用。这些结果提示HCAR2参与介导了低氧对红系分化的促进作用。HCAR2是一种G蛋白偶联受体,与抑制型G蛋白(Gi)相连[9],可通过抑制腺苷酸环化酶的活性,降低细胞中环磷酸腺苷的水平[10]。有学者发现在红系分化过程中细胞内环磷酸腺苷水平呈持续性下降[11],因此,HCAR2可能是通过抑制腺苷酸环化酶活性降低细胞内环磷酸腺苷水平,从而介导低氧促K562细胞向红系分化的作用,但其中涉及的具体分子机制还有待研究。
本研究阐述了HCAR2自身表达水平的变化对红系分化的影响,然而HCAR2作为一种细胞膜受体,其功能的发挥也可以通过结合不同配体实现。例如,在肠上皮细胞中,通过识别β-羟基丁酸(BHB)诱导转录因子HOPX的表达,进而抑制细胞增殖,减慢肠道肿瘤的生长速度[12];而在动脉粥样硬化小鼠模型中,口服3-羟基丁酸可通过激活HCAR2促进巨噬细胞中的胆固醇外流,显著改善动脉粥样硬化[13]。但HCAR2对红系分化的调控中是否有某种配体的参与尚不清楚。
综上所述,该研究表明HCAR2在低氧刺激下表达升高,并可以促进K562细胞向红系分化,这为认识和探索HCAR2的新功能提供了参考。然而,低氧促HCAR2高表达的过程是否有HIF-1的参与,以及HCAR2配体刺激能否促进K562细胞向红系分化,还需要进一步实验验证。

