夹脊电针通过抑制Notch信号通路对脊髓损伤大鼠运动功能的影响
魏江曼,安郁坤,胡梦萱,陈和木
脊髓损伤(spinal cord injury, SCI)包括脊髓结构与功能的损伤,一般由脊柱骨折等外伤性因素引起,造成损伤部位微环境的改变及损伤平面以下运动感觉功能、胃肠道功能等障碍[1]。电针(electroacupuncture, EA)作为一种中医治疗方法,已被证实对SCI具有积极的治疗效果,如改善损伤部位局部微环境、减轻水肿和炎症反应、抑制神经元凋亡和瘢痕形成等[2]。但既往研究[3]多在督脉,而对于脊髓两旁夹脊穴的研究较少。夹脊穴的解剖学位置与脊髓旁神经根位置重合,夹脊电针对SCI的治疗作用已被初步证实,但其治疗机制尚不完全清楚。该研究探索夹脊穴电针干预与Notch信号通路的关系,以进一步揭示其治疗SCI的作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物与分组 健康清洁级雄性大鼠72只,体质量(250±20)g,均由安徽医科大学实验动物中心提供,生产许可证号:LLSC20221105。将72只大鼠随机分为假手术(sham)组、SCI组、电针(SCI+EA)组和针刺(SCI+AP)组,每组18只。每组按术后时间分为3个亚组,3天亚组、7天亚组和14天亚组,每个亚组6只。sham组只接受胸10节段(T10)的椎体切除术。其他3组中:SCI组只造成SCI,不做其他治疗干预,SCI+EA组在损伤后第2天开始接受电针治疗;SCI+AP组在损伤后第2天开始接受针刺治疗。大鼠自由获得水和食物,并给予20~25 ℃温度、50%~65%温度条件和12 h/12 h明暗照明。实验过程均遵循《关于善待实验动物的指导性意见》规定。
1.1.2试剂与仪器 Notch 3一抗购自武汉ProteintechGroup公司;Hes 3一抗、Notch 4一抗和胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)一抗购自美国Affinity公司;通用型二抗试剂盒、DAB显色试剂盒购自北京Zsbio公司;TRIzol试剂盒购自美国Invitrogen公司;SYBR Green PCR试剂盒和逆转录试剂盒购自美国Thermo Fisher Scientific公司;ECL Plus发光试剂盒、裂解液购自上海碧云天公司。徕卡切片机购自德国Leica 公司(货号:RM2016);生物组织自动包埋机购自湖北贝诺医疗科技有限公司(货号:ZT-12M);显微镜购自日本OLYMPUS公司(货号:CX43)、Real-time PCR仪购自瑞士Roche公司(货号:Lightcycler 96)、电泳凝胶成像仪购自美国Bio-RAD公司(货号:ChemiDoc XRS+System)。一次性无菌针灸针购自吉林长春爱康医疗器械有限公司(0.25 mm×13 mm);电针仪购自江苏佳健医疗器械股份有限公司(型号:CMNS6-1)。
1.2 实验方法
1.2.1造模方法 造模前所有动物禁食8 h,称重后给予10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉。以下手术过程在无菌条件下进行:将大鼠固定在手术台上,剃除手术区域毛发,并进行常规消毒。以T10段为中心,从脊柱正中做纵行切口,逐层剥离皮下组织,去除T10及部分T9、T11的椎板,充分暴露该节段背侧硬脊膜。用自制Allen脊髓撞击器以10 g×5 cm 的能量垂直撞击T10段脊髓,造成脊髓的急性压迫性损伤。以大鼠局部脊髓出现充血、全身痉挛、痉挛性摆尾作为造模成功的标志,然后逐层缝合被切开组织。术后予腹腔注射青霉素(100 U/d),连续3 d抗感染治疗,每日早晚予腹部按摩2次,帮助大鼠二便的排泄。sham组仅切除椎板暴露脊髓组织,不损伤脊髓,其余3组均在切除椎板的基础上损伤脊髓。
1.2.2针刺和电针治疗方法 将大鼠于俯卧位固定于自制的鼠板上,并暴露损伤的脊髓节段。SCI+AP组在术后第2天,取距损伤处上下端两个椎体的棘突间隙距中线旁开3~4 mm的夹脊穴,用针灸针向内斜刺4~5 mm深,使针尖触及椎板。然后将SCI+EA组连接电针仪,同一导线的两个夹子夹持在同侧上下两个针灸针针柄处,治疗频率为2/100 Hz,电流强度为 1~2 mA,以治疗部位肌肉轻微颤动但未引起病理损伤为宜,1次/d,15 min/次,连续14 d。sham组和SCI组大鼠仅用相同方法固定于板上15 min,不进行针刺。
1.3 观察指标及检测方法
1.3.1体质量与运动功能 分别在术前和术后第3、7、14 d记录每组大鼠的体质量,并在第3、7、14 d使用Basso、Beattie和Bresnahan(BBB)[4]开放场运动测试评估大鼠的后肢运动功能,其满分为21分,最低0分。评估方法为将大鼠放在1个开口容器中,测试者敲击容器壁观察大鼠后肢各关节的运动情况。此过程由2名不知情专业人员记录2次独立BBB评分,计算出每只大鼠的平均值。
1.3.2取材 术后第3、7、14天,在BBB测试完成后,用过量10%水合氯醛对大鼠行腹腔麻醉。开胸,从左心室插管,剪开右心耳,然后灌注生理盐水,直到有澄清液从右心耳流出,再灌注4%多聚甲醛1 h。打开椎弓管,取出损伤段约1 cm长的脊髓,浸泡在多聚甲醛中固定24 h。然后放入生物组织自动包埋机处理。对于需要做实时定量聚合酶链反应(real time quantitative polymerase chain reaction, qPCR)和免疫印迹分析的大鼠,在用相同方法灌注完生理盐水后打开椎弓管,取出损伤段约1 cm长脊髓组织,在液氮中快速冷冻,并在-80 ℃下储存待用。
1.3.3苏木精-伊红(hematoxylin eosin, HE)染色 将包埋后的组织切成4 μm厚的切片,放入烤箱烤干。烤干后依次进行脱蜡、苏木精溶液和伊红溶液的染色、脱水、二甲苯透明和封片。最后经显微镜镜检后进行图像采集分析。
1.3.4qPCR 使用qPCR法检测Hes3、Notch1、Notch3和Notch4的mRNA表达水平。制备好脊髓组织匀浆后,使用TRIzol溶液自各组大鼠脊髓样本中分离RNA。使用带有SYBR Green的qPCR系统和针对每个目标基因的引物对每个样本进行qPCR反应。qPCR引物序列见表1。实时qPCR的步骤为:在95 ℃、10 min激活,95 ℃、15 s,60 ℃、45 s,40个循环。甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)被作为内在阳性对照和正常化因子。每组设置3个重复孔,使用2-ΔΔCt法检测目标基因的表达。

表1 引物序列
1.3.5免疫印迹分析 将匀浆后的组织加入裂解液进行裂解,离心后取上清液进行BCA法蛋白浓度测定。将等量蛋白质使用聚丙烯酰胺凝胶电泳进行蛋白质分离,然后转移到聚偏二氟乙烯膜(polyvinylidene fluoride,PDVF)膜上,并室温封闭1 h。在4 ℃下孵育一抗兔多抗隆抗体Hes 3(1 ∶1 000)、Notch 3 (1 ∶1 000)、Notch 4 (1 ∶1 000)和内参GAPDH(1 ∶1 000)摇床过夜,然后,在室温下孵育二抗2 h。使用ECL发光试剂盒,经凝胶成像仪显影。使用Image J软件进行图像量化分析,计算Hes 3、Notch 3和Notch 4蛋白的相对表达量。
1.3.6免疫组织化学染色 从石蜡块上切下连续4 μm厚的切片。将切片与胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP, 1 ∶100)一抗抗体在4 ℃下孵育过夜,然后滴加辣根过氧化物酶标记的高敏兔小鼠通用二抗,在室温下孵育50 min。随后在显微镜下进行DAB显色,然后使用苏木精染色液对细胞核复染。最后在显微镜下观察切片,并收集图像。用苏木精染色的细胞核为蓝色,DAB的阳性表达为棕黄色。用Image J软件分析每张切片的GFAP表达区域图像,并统计阳性表达面积。
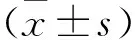
2 结果
2.1 各组大鼠的体质量和BBB评分比较各组大鼠的体质量变化和BBB评分统计结果见表2、3,折线图见图1A、B。如体质量曲线(图1A)所示,从整体趋势来看,sham组大鼠的体质量呈现上升趋势,其余3组则为下降趋势,且通过斜率可以看出,在术后前3 d体质量的下降速度最快,这可能与手术麻醉和创口的影响有关;与sham组相比,其余3组的体质量均下降(P<0.01);第7天和第14天时,SCI+EA和SCI+AP组高于SCI组(P<0.01),且SCI+EA组比SCI+AP组更高(P<0.05)。以上结果说明,电针和普通针刺能缓解SCI术后大鼠体质量的下降,而且电针的作用效果优于普通针刺。如BBB评分曲线(图1B)所示,术后第1天,除sham组外,其余3组的评分均为0,表示造模成功;术后第3天时,SCI+EA、SCI+AP和SCI组之间差异无统计学意义;在术后第7 天时,SCI+EA的BBB评分略高于SCI组(P<0.05)和SCI+AP组(P<0.05),到术后第14天时,SCI+EA组高于SCI组(P<0.01)和SCI+AP组(P<0.01),且SCI+AP组也显示出高于未进行干预的SCI组(P<0.05)的趋势。这些结果说明,电针和普通针刺在不同程度上都能起到促进SCI大鼠后肢运动功能恢复的作用,电针的起效时间比普通针刺快,且对后肢功能的恢复效果更明显。
图1 各组大鼠体质量(A)和BBB评分(B)折线图与sham组比较:*P<0.05;与SCI组比较:#P<0.05;与SCI+EA比较:&P<0.05
表2 4组大鼠术后不同时间段体质量统计
表3 4组大鼠术后不同时间段BBB评分统计(分,
2.2 各组大鼠HE染色比较假手术组大鼠的脊髓切片显示正常的中央管、灰质和白质,无出血性坏死、水肿或变性。前角神经元的细胞核大而圆,核仁清晰。而其他3组的脊髓结构均被破坏,中央管、灰质和白质出现不同程度的出血,灰质中的前角神经元发生核固缩。在术后第3天,SCI组损伤区周围的灰质和白质出现水肿和结构破坏,灰质边界模糊,灰质和白质之间可见空泡,并可见白质大量出血。此外,神经元的结构被破坏,神经元肿胀,部分神经元出现核固缩。术后第7天,灰质和白质水肿,结构紊乱,模糊不清,中央受损区周围的灰质和白质之间仍可见空泡。术后第14天,灰质和白质之间的界限模糊,出血消失,但空泡仍然可见。相比于SCI组,SCI+EA组和SCI+AP组在第7天和第14天的脊髓的形态学恢复程度更好。经电针和针刺治疗后,脊髓的水肿减轻,受损区的中央管、灰质和白质的出血减少,结构也有所恢复。并且SCI+EA组的恢复效果优于SCI+AP组。这些结果表明,电针和针刺干预都能促进SCI大鼠的脊髓结构恢复,减轻水肿和出血,且电针的效果优于普通针刺。见图2。
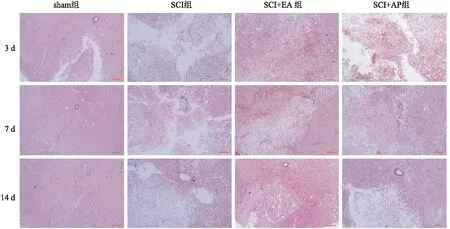
图2 各组大鼠脊髓组织HE染色情况 ×100
2.3 各组大鼠脊髓组织Hes3、Notch1、Notch3和Notch4mRNA的表达水平比较与sham组相比,其他3组的Hes3、Notch1、Notch3和Notch4的mRNA表达水平明显增高(P<0.05),在第7天时达到最高水平,第14天时显示出回落趋势。与SCI组相比,SCI+EA组和SCI+AP组的Hes3、Notch1、Notch3和Notch4降低(P<0.05),且在第7天和第14天时,SCI+EA组比SCI+AP组更低(P<0.05)。见图3和表4。

图3 各组大鼠Hes 3、Notch 1、Notch 3和Notch 4的mRNA表达水平A:Hes 3;B:Notch 1;C:Notch 3;D:Notch 4;与sham组比较:*P<0.05;与SCI组比较:#P<0.05;与SCI+EA比较:&P<0.05
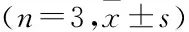
表4 4组大鼠术后不同时间Hes 3、Notch 1、Notch 3、Notch 4的实时定量PCR表达情况统计
2.4 各组大鼠脊髓组织Hes 3、Notch 3和Notch 4蛋白表达水平比较各组大鼠脊髓组织Hes 3、Notch 3和Notch 4蛋白的表达与mRNA表达呈现一致的趋势,即在SCI术后增高(P<0.01),在第7天时达到最高水平,第14天时显示出回降趋势。见图4。与sham组相比,SCI+EA组和SCI+AP组Hes3、Notch3、Notch4蛋白表达减少(P<0.05),且在第7天和第14天时SCI+EA组比SCI+AP组更低(P<0.05),与qPCR的结果一致。以上结果说明夹脊电针具有显著抑制SCI术后Notch信号通路和Hes 3表达的作用,夹脊针刺也具有相同作用,但效果次于电针。
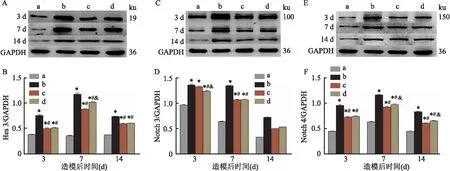
图4 各组大鼠Hes 3、Notch 3和Notch 4的蛋白条带曝光图及灰度值统计结果A、B:Hes 3;C、D:Notch 3;E、F:Notch 4;a:sham组;b:SCI组;c:SCI+EA组;d:SCI+AP组;与sham组比较:*P<0.05;与SCI组比较:#P<0.05;与SCI+EA比较:&P<0.05
2.5 第14天时各组大鼠脊髓GFAP免疫组化染色结果在第14天时对大鼠脊髓组织的GFAP进行免疫组化检测,染色结果见图5A,阳性表达面积统计结果见图5B。与sham组相比,SCI组的GFAP表达增多(P<0.05);而与SCI组相比,SCI+EA组(P<0.05)和SCI+AP(P<0.05)组GFAP表达减少,但仍高于sham组(P<0.05),且SCI+EA组低于SCI+AP组(P<0.05)。以上结果说明,SCI术后第14天时,夹脊电针和针刺能减少受损区域GFAP的出现,且电针的抑制效果比普通针刺强。
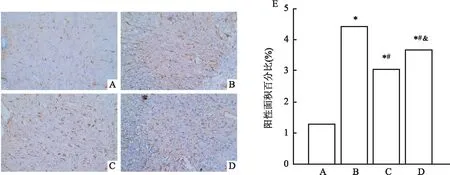
图5 术后第14天时各组大鼠GFAP的免疫组化阳性表达情况和阳性表达面积统计结果 ×200A:sham组;B:SCI组;C:SCI+EA组;D:SCI+AP组;E:各组阳性表达面积百分比统计结果;与sham组比较:*P<0.05;与SCI组比较:#P<0.05;与SCI+EA比较:&P<0.05
3 讨论
SCI后会经历急性期、亚急性期和慢性期三个阶段,急性期主要表现为组织水肿和炎症,之后神经元凋亡逐渐增多,过渡到亚急性期,而到了慢性期后,星形胶质细胞会大量生成瘢痕组织,阻碍神经元再生[5]。
神经干细胞是一种具有自我复制和分化多能性的细胞,在中枢神经系统受损、缺血时,能分化为星形胶质细胞[6]。SCI后,机械压力导致胶质细胞迅速死亡。随后,损伤部位出现炎症反应,并使幼稚的星形胶质细胞被激活并大量分化,此后一系列分化导致瘢痕形成性星形胶质细胞出现且大量增多,最终形成胶质瘢痕[7]。GFAP是星形胶质细胞的一种独特结构蛋白,在SCI后,迅速释放到生物流体中,被认为是星形胶质细胞独特的生物标志物[8]。本实验用GFAP标记星形胶质细胞,发现夹脊电针抑制了GFAP的生成,其机制可能是由于其抑制了神经干细胞向星形胶质细胞的转化。
电针在诱导神经元的分化中起到了积极作用,这一过程与Notch信号通路有关[9]。Notch信号通路是一种高度保守的信号转导通路,包括Notch受体、Notch配体和相关蛋白[10]。Notch途径的活性由碱性螺旋-环-螺旋(basic helix loop helix,bHLH)基因控制,bHLH基因是Notch信号通路的直接靶基因,分为促进型和抑制型。促进型包括Mash1等,其主要功能是促进神经干细胞分化为神经元;抑制型包括Hes3等,其会抑制神经干细胞分化为神经细胞,保持神经干细胞的特性,使其分化为星形胶质细胞[11],最终形成瘢痕组织。SCI后,脊髓微环境中的Notch配体上调,受体和配体结合激活这一途径,因此,抑制Notch信号通路的激活是促进SCI恢复的关键。本实验对Notch通路相关信号因子Notch3、Notch4和抑制性bHLH基因家族Hes3的基因水平和蛋白水平进行双重检测,研究表明,夹脊电针能抑制Notch通路的激活和Hes3基因的表达,从而减少GFAP的生成,促进脊髓功能的恢复。
夹脊穴为经外奇穴,《中国针灸学》将夹脊穴定位于T1-L5棘突下,左右旁开0.5寸,位于督脉与足太阳膀胱经之间,是沟通两条经脉的枢纽。督脉为阳脉之海,总督一身阳气,而膀胱经,通过背俞穴与五脏六腑相连,因此,通过针刺夹脊穴,可以同调两经气血,激发两经经气,进而调节全身阳气[12]。后世医家认为,相较于足太阳膀胱经,夹脊穴与督脉关系更密切,并将夹脊穴归属于督脉,与督脉一起,形成“督脉带”[13],明确了督脉和夹脊穴的整体性。对于神经系统疾病如SCI的治疗,已经从督脉电针扩展到了夹脊电针,并且疗效显著[14]。
本实验选取的夹脊穴,是受损脊髓节段上下的两对夹脊穴,靠近脊神经根位置。有研究[15-16]认为,穴位和神经根距离较近时,更有利于引起针感传导反应,直达病灶部位。本研究表明,夹脊电针和针刺虽然都对SCI的恢复有积极作用,但电针对脊髓的恢复程度和对Notch信号通路的抑制作用都比普通针刺效果明显。这可能是因为,相较于针刺,电针不但可以产生机械性物理刺激,还对穴位产生脉冲电流刺激[17]。当脉冲电流施加于受损脊髓时,会使细胞内外的离子产生定向移动,从而使细胞内外的离子浓度和分布发生显著变化,进而消除细胞膜极化状态,引起神经元兴奋[18]。此外,为了减少适应性耐受导致疗效减弱,该研究选择了2/100 Hz的疏密波模式(疏波2 Hz,密波100 Hz)。然而,该研究只讨论了夹脊电针对SCI急性期的影响,而夹脊电针对SCI大鼠的长期影响有待继续探究。

