口腔鳞状细胞癌中IGF1的表达及其临床意义
曾 洁,祖木热提古丽·阿不来提,马琰迪,俞雪燕,夏飞飞,徐 江
口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)约占口腔癌的90%,是一个日益严重的全球健康问题,到目前为止,尽管对OSCC的手术方法和辅助治疗不断改进,但5年生存率没有显著增加[1- 2]。胰岛素样生长因子1 (insulin like growth factor 1,IGF1) 是一种多效性因子,可循环至全身各处,由70多个氨基酸组成[3],其结构类似于人类胰岛素原,是多种正常和恶性细胞的生存、生长因子[4]。IGF1的表达与多种肿瘤相关,如结肠癌、乳腺癌和前列腺癌患病风险的增加被认为是由IGF1的增殖作用引起[5]。该实验将采用免疫组织化学Envision法,测定在OSCC和邻近正常组织中IGF1的表达情况,分析IGF1表达与OSCC临床特性和预后之间的关系,并从细胞水平进一步检测其表达情况。
1 材料与方法
1.1 组织标本和细胞系115份OSCC组织样本(OSCC组)及74份正常组织样本(正常组)(距离癌组织2 cm以上)均来自石河子大学第一附属医院2004—2019年间确诊的OSCC患者,由2位高年资病理医师对标本进行诊断并制作成组织芯片,收集相对应的基本病理信息及临床资料,通过电话、医院病历或其他方法等,在115例OSCC患者中随访70例。本研究经石河子大学第一附属医院伦理委员会批准(编号:A2021-073-01)。
本研究中使用了1种人口腔角质细胞株(HOK)和4种OSCC细胞系(CAL-27、TCA8113、SCC-15、SCC-25),其中HOK购自北京北纳生物科技有限公司,CAL-27、SCC-15购自美国ATCC细胞库,SCC-25、TCA8113细胞购自上海吉凯基因科技有限公司。
1.2 主要仪器与试剂细胞培养箱、超净工作台、-80 ℃冰箱购于美国赛默飞世尔科技有限公司;电泳仪、湿转转膜仪购于美国Bio-rad公司;蛋白成像仪购于上海天能公司;荧光定量PCR仪购于美国Agilent公司。兔抗IGF1单克隆抗体(ab263903)购于英国Abcam公司;GAPDH抗体(K200057M)、青链霉素混合液(P1400)购于北京索莱宝科技有限公司;辣根酶标记山羊抗兔IgG(ZB-2301)、免疫组化试剂盒(PV-6001)购于北京中杉金桥生物技术有限公司;DMEM、RPMI-1640培养基、血清购于以色列BI公司;反转录试剂盒(CW2582)、qRT-PCR试剂盒(CW2623)购于江苏康为世纪生物科技有限公司。
1.3 实验方法
1.3.1免疫组织化学 选取Envision二步法进行实验:切取经甲醛固定和石蜡包埋的4 μm组织切片,将组织切片依次在二甲苯、乙醇中脱蜡水化,室温下用3%H2O2封闭10 min后洗涤,然后将所有切片与IGF1一抗(1 ∶500)在4 ℃孵育过夜,继而与二抗孵育,PBS冲洗后DAB显色,苏木精核染色后封片,显微镜下阅片。
结果判定:以呈棕黄色颗粒为阳性,IGF1染色总得分=着色强度得分×阳性细胞百分比;为了便于统计分析,以<7为低表达,≥ 7为高表达[6],见表1。
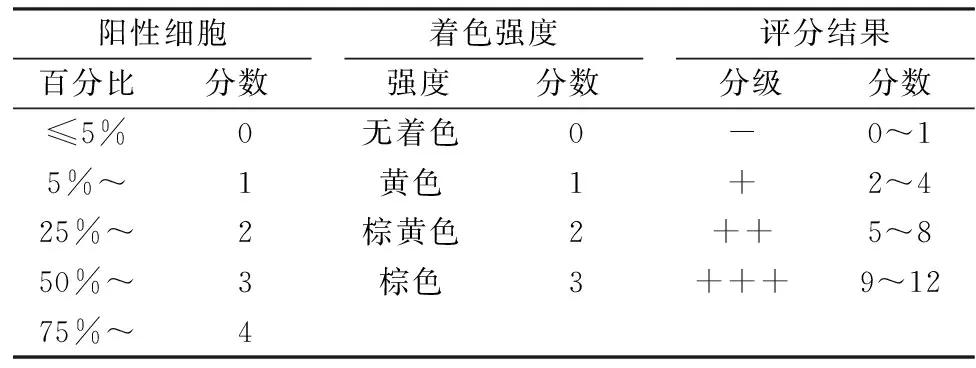
表1 免疫组化结果评定标准
1.3.2免疫印迹实验(Western blot) 收集HOK、CAL-27、TCA-8113、SCC-15和SCC-25五种细胞,用RIPA裂解液分离总蛋白,蛋白定量后进行SDS-PAGE电泳,结束后转移至PVDF膜,5%脱脂奶粉封闭,用稀释的一抗(IGF1,1 ∶1 000; GAPDH,1 ∶5 000)4 ℃下孵育过夜。隔天用含0.2%吐温(TBST)的TBS洗涤6次,每次5 min,后将膜与二抗[山羊抗兔IgG(H+L)-HRP,1 ∶15 000]静孵2 h,再次洗膜,蛋白成像仪检测蛋白条带, Image J 进行蛋白半定量,分析IGF1的相对表达水平。
1.3.3实时荧光定量PCR(qRT-PCR) 收集HOK、CAL-27、TCA-8113、SCC-15和SCC-25五种细胞,按照TRIzol 试剂说明提取总RNA,检测RNA浓度,反转录合成cDNA,用特异性引物扩增IGF1和GAPDH,引物序列见表2,以 GAPDH 基因 mRNA 表达水平为标准进行比较,采用2-ΔΔCt法计算上述五种细胞中的IGF1 mRNA的相对表达量。
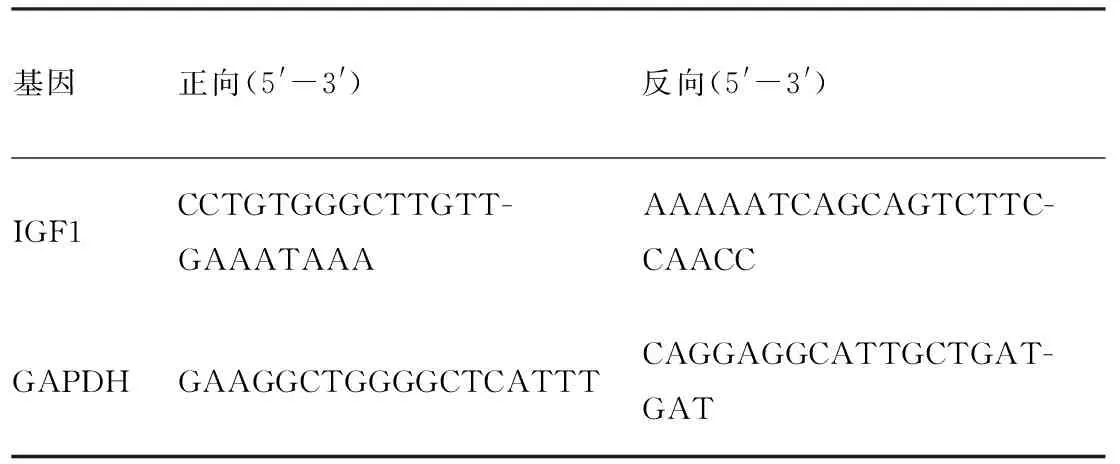
表2 目的基因引物设计
1.4 统计学处理采用GraphPad Prism 9.0软件
进行统计分析。用χ2检验比较OSCC组织中IGF1的表达水平与临床病理特征的相关性,存在个别数值的理论频数小于5时,以连续校正值为χ2检验结果。使用ROC曲线评估IGF1的表达高低,从而预测OSCC的免疫组化评分诊断价值。采用Kaplan-Meier法分析IGF1表达对OSCC患者的生存影响,并绘制生存曲线,生存资料中不同变量的风险比采用 COX 回归分析。计量资料采用表示,应用t检验对不同细胞系蛋白及mRNA表达数据之间的差异进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 IGF1在OSCC及正常组织中的表达IGF1主要定位于细胞膜,少量定位于细胞质,在OSCC组和正常组组织中均能观察到IGF1,但是IGF1在OSCC组中的高表达率为72.17%,在正常组中是2.70%,差异有统计学意义(P<0.001)。见表3和图1。IGF1在OSCC及正常组评分等级间的差异有统计学意义(P<0.05)。见表4和图2。

图1 IGF1在不同组织中的表达A:IGF1 在正常组中低表达情况;B:IGF1在OSCC组中高表达情况;1:×40;2:×200;3:×400
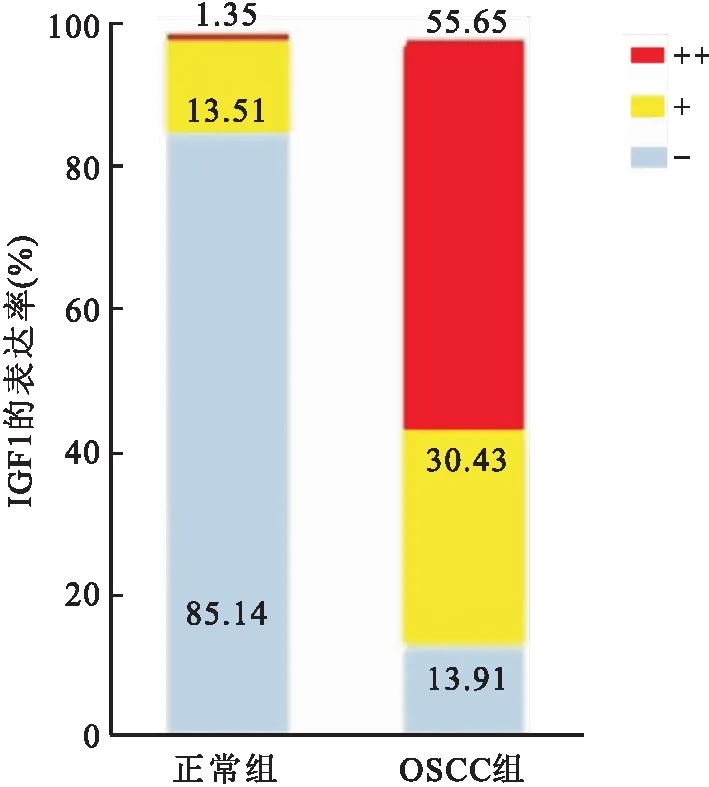
图2 IGF1在不同组织中的表达

表3 OSCC组及正常组中IGF1的表达[n(%)]

表4 OSCC组及正常组中IGF1的表达差异[n(%)]
2.2 IGF1在OSCC组织中的表达与临床病理因素之间的关联IGF1的表达与分化程度、T分期、浸润深度有相关性(P<0.05),与年龄、性别、N分期、TNM分期、吸烟、饮酒、HPV感染无相关性(P>0.05),见表5。
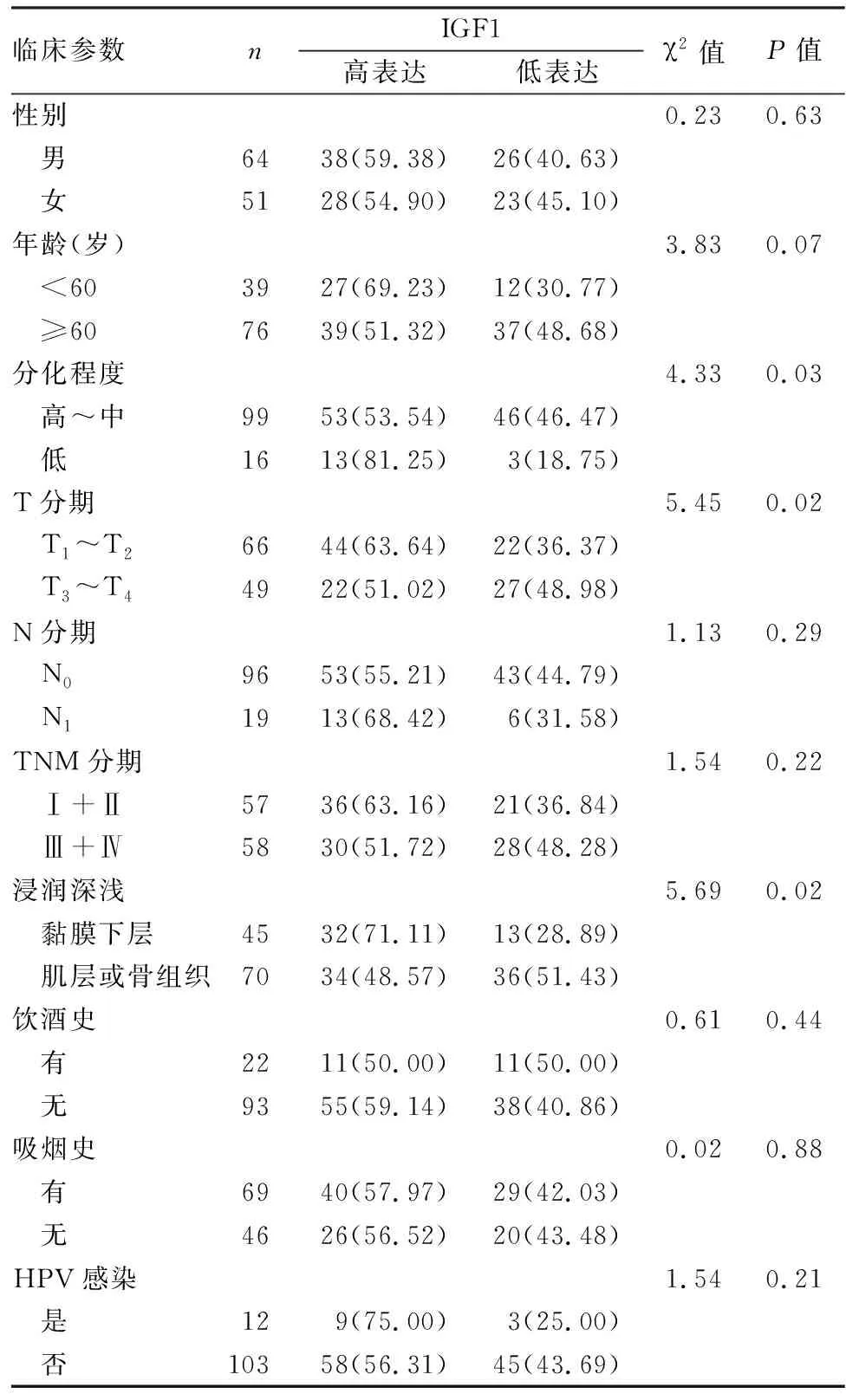
表5 IGF1表达与OSCC临床病理因素之间的关联[n(%)]
2.3 IGF1表达与OSCC的ROC曲线分析在本实验中,使用ROC曲线分析IGF1在OSCC及对照组中免疫组化评分的诊断价值,结果表明IGF1在OSCC的表达曲线下AUC值为0.81,95%CI:0.75~0.87,用诊断临界值确定OSCC的灵敏度和特异性,灵敏度为0.73,特异性为0.82(诊断临界点为5),见图3。

图3 ROC曲线分析IGF1在OSCC及对照组中免疫组化评分
2.4 IGF1表达与患者预后的关系Kaplan-Meier生存曲线对比OSCC中IGF1表达和患者预后的关系,高表达IGF1的OSCC患者生存时间较低表达患者缩短(P=0.03),见图4。COX单因素分析显示OSCC中IGF1表达量(HR=0.37,P=0.006)和分化程度(HR=1.87,P=0.04)和T分期(HR=2.04,P=0.03)和浸润深度(HR=1.94,P=0.04)是影响OSCC患者生存的重要因素,COX多因素生存分析表明IGF1高表达(HR=0.39,P=0.01)与死亡有关,是影响OSCC患者预后的独立因素,见表6。
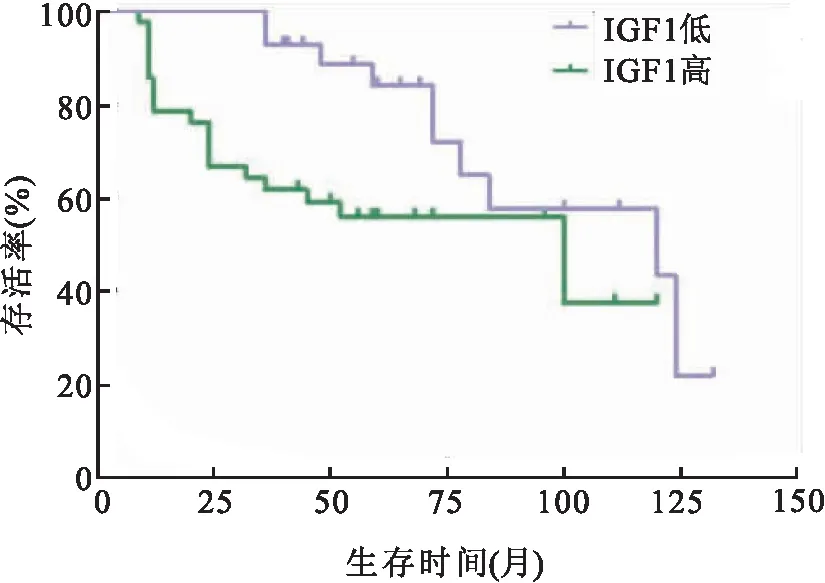
图4 IGF1表达与OSCC患者预后的生存分析
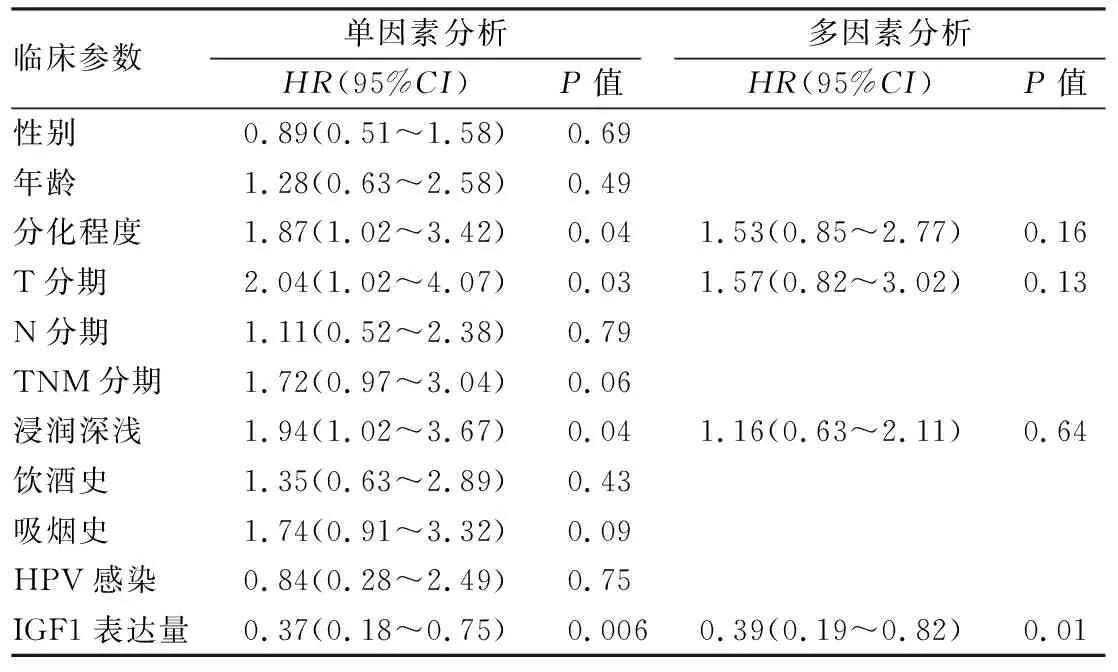
表6 COX单因素及多因素分析
2.5 IGF1在口腔鳞癌细胞系中高表达为了进一步确定IGF1的表达,使用Western blot检测了一组人类OSCC细胞系中的IGF1水平,其结果显示,OSCC细胞系与正常口腔上皮细胞HOK对比,IGF1蛋白的表达水平明显升高(P<0.01),见图5。实时荧光定量PCR实验结果显示IGF1在OSCC细胞系与HOK相比,mRNA表达水平增高(P<0.05),见图6。
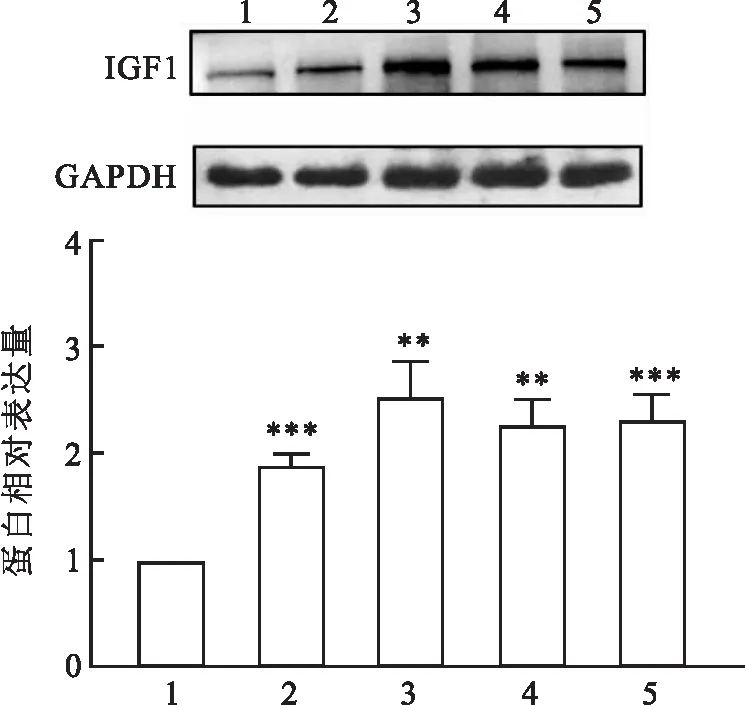
图5 IGF1在OSCC细胞系及口腔正常上皮细胞中的蛋白表达1:HOK;2:CAL-27;3:Tca-8113;4:SCC-15;5:SCC-25;与HOK比较:**P<0.01,***P<0.001
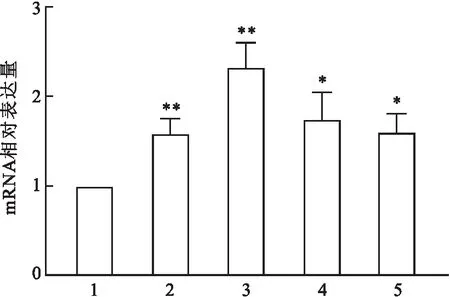
图6 IGF1在OSCC细胞系及口腔正常上皮细胞中的mRNA表达1:HOK;2:CAL-27;3:Tca-8113;4:SCC-15;5:SCC-25;与HOK比较:*P<0.05,**P<0.01
3 讨论
OSCC常起源于口腔上皮细胞逐渐发展为肿瘤,对患者的面容、功能和生存质量有严重影响[7],了解和发现新的临床生物标志物,对改善患者的预后分层及优化抗癌治疗有重要的研究价值。
IGF1在许多细胞类型的有丝分裂途径中起关键作用[8],被认为是一种细胞周期进展因子,参与大多数器官和组织的正常生长、发育和分化以及多种病理情况[9],除此之外,在肿瘤微环境中,IGF1能够驱动迁移、侵袭和增殖,促进血管生成并维持癌症干性[10]。肿瘤中 IGF1信号通路的改变已被广泛研究,循环IGF1水平确实与肿瘤进展无关,但肿瘤产生的局部IGF1和胰岛素生长因子受体(IGF1R)表达对疾病预后产生不利影响[11]。本研究免疫组化定性检查结果显示,IGF1主要表达在细胞膜,与正常组相比,OSCC组中IGF1过表达(P<0.001),但癌组织并不完全等同于细胞系,单一细胞通过反复传代等也可能会发生转化;Western blot半定量实验显示IGF1在OSCC细胞系中也高表达,提示IGF1可能参与并促进OSCC的发生、发展进程;qRT-PCR实验显示IGF1的mRNA在肿瘤细胞中同样高表达,提示IGF1很有可能作为癌基因在OSCC中发挥作用。另外,IGF1高表达还与一些临床特征密切相关,Aslan et al[12]发现IGF1在结肠癌中高表达,并与肿瘤位置和性别相关,Li et al[13]发现IGF1在卵巢癌中的表达与临床分期呈正相关,且IGF1的表达越高,卵巢癌患者的生存率越低。本研究显示IGF1的表达水平与T分期、浸润深度有关(P<0.05),提示IGF1高表达与 OSCC患者较高的肿瘤侵袭性有关。此外,IGF1的表达和分化程度相关(P<0.05),随着肿瘤组织的分化程度降低,OSCC组织中IGF1的表达水平在增加,提示表达水平与OSCC患者病情程度有关,因此推测IGF1可能参与了OSCC的癌变过程。采用受试者工作特征ROC曲线分析,将OSCC病例与相邻正常组织进行区分,IGF1的曲线下面积AUC值为0.81,并确定最佳临界点,特异性是82%,敏感性为73%,可以认为IGF1对OSCC患者具有良好的诊断效力。进一步数据分析IGF1蛋白对OSCC患者预后的临床价值,应用Kaplan-Meier 生存曲线对患者进行生存分析,高表达的IGF1与OSCC患者较差的整体生存率相关(P=0.03),提示预后不佳;相似的,在软骨肉瘤中IGF1的表达与预后不良有关[14]。同时对影响患者预后的因素进行COX回归分析,单因素分析显示,IGF1表达量、分化程度、T分期和浸润深浅均是影响OSCC患者预后的危险因素;多因素分析显示,IGF1表达量是影响患者预后的独立因素,且IGF1表达越高,患者预后越差。以上研究表明,IGF1高表达与患者的生存率呈负相关,可以作为判断OSCC预后的指标。

