低氧/冷暴露对肥胖大鼠模型白色脂肪棕色化的影响
郜 琨,杨历新,王 叶,许海琦
目前,肥胖是影响人类健康的重大问题,其成为了危害身体健康的头号杀手[1]。肥胖已经取代了营养不良和感染的疾病影响,与一些疾病如糖尿病[2]都有明显的相关关系。如何减控体质量已成为目前研究的热点及难点。低氧环境下的体质量减轻是近年发现的一个新的生理现象,国内外有包括长期慢性低氧和短期低氧暴露情况下关于体质量的各种观察研究。研究[3]表明,冷暴露不仅能提高棕色脂肪活性,还能高度选择性地刺激皮下脂肪解偶联蛋白1(uncoupling protein 1,UCP-1)的表达和产热活性。还有研究[4]指出,低氧暴露可以降低体脂,冷暴露可诱导白色脂肪棕色化和棕色脂肪组织分化,但有关低氧、冷暴露后白色脂肪棕色化的生物学机制尚不完全清楚。本研究通过白色脂肪棕色化对传统调控机制PPAR-γ2、PRDM16和UCP-1表达和活性的增强效应,探究低氧/冷暴露对肥胖大鼠白色脂肪棕色化的影响。
1 材料与方法
1.1 材料60只雄性SD大鼠购于南京君科生物公司,生产许可证号:SCXK(苏)2018-0001,将所有大鼠放在SPF级动物房中饲养,均自由摄食及饮水,每12 h光照/12 h黑暗,温度为19~25 ℃,湿度为45%~55%。
1.2 方法
1.2.1实验动物分组 60只大鼠通过高脂喂食构建肥胖大鼠模型。6周后超过普通饲料饲养大鼠平均体质量10%为肥胖造模成功。有40只大鼠建模成功,将其随机分为对照组、低氧组、低温组、低氧低温组,每组10只。其中对照组大鼠模型放置在正常环境中(氧浓度21%,实验温度>4 ℃),低氧组大鼠放置在低氧常温环境下(氧气含量为16.2%,实验温度>4 ℃),低温组大鼠放置在冷环境中(氧气含量为21%,实验温度0 ℃±4 ℃),低氧低温组大鼠大鼠放置在低氧/冷环境中(氧气含量为16.2%,实验温度0 ℃±4 ℃)。所有大鼠在实验期间均普通饲料饲养。
1.2.2测量大鼠体质量及体脂 观察4组大鼠精神状态、活动情况、每周测量体质量。4周时利用美国Columbus实验动物代谢和Echo Medical Systems体成分分析仪测量分析系统分别检测4组大鼠代谢率和体脂含量,随后大鼠禁食18 h后经乙醚麻醉后称体质量,眼球放血5 ml留取血清和分离肾周白色脂肪和肩胛棕色脂肪。各组小鼠血清样本通过4 ℃离心后-20 ℃保存。
1.2.3苏木精-伊红(HE)染色检测大鼠脂肪组织形态变化 新鲜的大鼠肾周白色脂肪和肩胛棕色脂肪固定于10%的甲醛溶液,固定时间约24 h。梯度乙醇脱水从80%乙醇、95%乙醇至无水乙醇约为4 h,组织透明后浸蜡,随后以石蜡包埋和切片厚度一般为5 μm,常规HE染色。染色理想的切片在显微镜下应是细胞核与细胞质蓝红相映,色泽鲜艳,核质对比明显,核膜及核染色质颗粒清晰可见。最后利用日本Keyence显微镜进行观察分析。
1.2.4免疫荧光法检测蛋白表达 新鲜的大鼠肾周白色脂肪和肩胛棕色脂肪经常规脱蜡水化后置于二甲苯Ⅰ、Ⅱ中浸泡,每次10 min。采用PBS冲洗3次,每次5 min,然后加入驴血清置于室温下封闭1 h,弃驴血清并加入一抗于4 ℃环境下孵育过夜;取出加二抗于室温下孵育2 h,经PBS冲洗后采用蒸馏水冲洗3次,每次5 min,加入含DAPI的抗淬灭封片剂,置于室温下避光反应5 min,封片然后置于显微镜下观察。
1.2.5荧光定量PCR检测基因的表达 利用TRIzol试剂分别从大鼠肩胛棕色脂肪及肾周白色脂肪中提取总RNA。每个循环94 ℃,变性15 s,55 ℃退火15 s,72 ℃延伸15 s。观察过氧化物酶体增殖剂激活受体γ2(PPAR-γ2)、PRDM16 和解偶联蛋白(UCP-1)基因的表达量,18s核糖体RNA(18S)作为参照。
1.2.6Western blot检测脂肪蛋白表达 利用BCA蛋白试剂盒分别从大鼠肩胛棕色脂肪及肾周白色脂肪中提取总蛋白,分别取各组总蛋白30 μg,蛋白样品用SDS-PAGE胶进行电泳,湿法将蛋白质从凝胶转移至PVDF膜上,用5%脱脂奶粉在室温的条件下封闭1 h,按照说明书的方法加入一抗(1 ∶1 000),4 ℃孵育过夜后加入二抗lgG(1 ∶3 000),室温条件下孵育1 h,显色显影,以β-actin蛋白为内参计算UCP-1蛋白的相对表达量。
2 结果
2.1 大鼠体质量、体脂比较与对照组相比,低氧组、低温组、低温低氧组大鼠体质量、体脂率均下降(P<0.05);与低温低氧组相比,低氧组、低温组大鼠体质量、体脂率均升高(P<0.05),见表1。
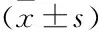
表1 各组大鼠体质量、体脂
2.2 大鼠脂肪组织HE染色细胞形态及脂肪细胞面积比较对照组大鼠脂肪组织内脂肪细胞面积较大呈不规则形状,可见大型脂滴;低氧组、低温组、低温低氧组大鼠脂肪组织内脂肪细胞面积减小且数量增多,其中低温低氧组细胞形态变化最为明显。另外,在低温低氧组大鼠肾周白色脂肪组织细胞可见有棕色化的趋势,见图1~3。
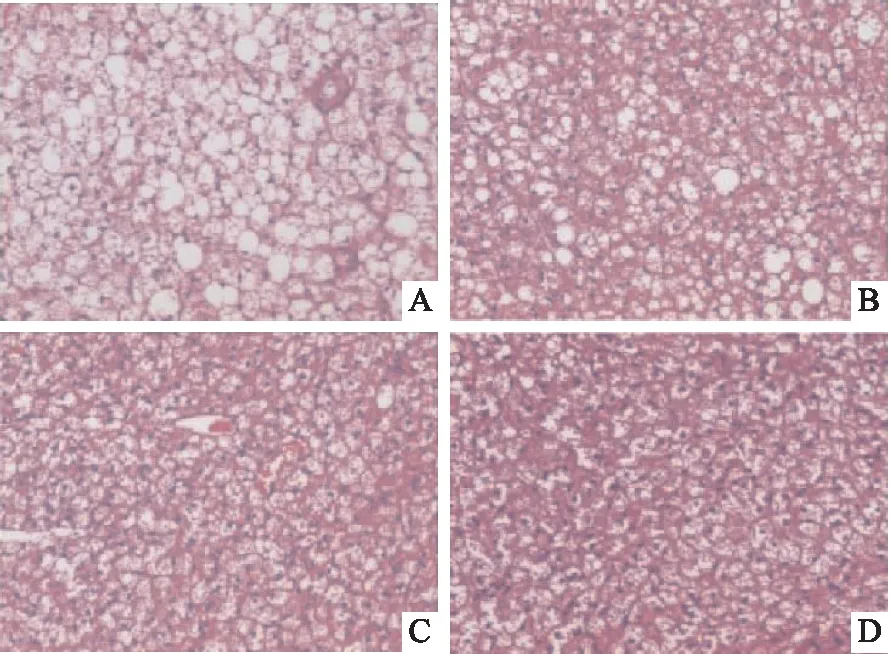
图1 各组大鼠肩胛棕色脂肪组织细胞形态 HE染色 ×200A:对照组;B:低氧组;C:低温组;D:低温低氧组

图2 各组大鼠肾周白色脂肪组织细胞形态 HE染色 ×200A:对照组;B:低氧组;C:低温组;D:低温低氧组
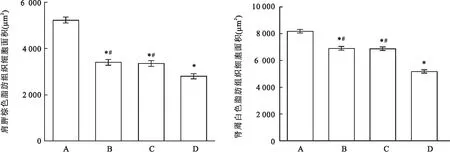
图3 各组大鼠脂肪面积比较A:对照组;B:低氧组;C:低温组;D:低温低氧组;与对照组比较:*P<0.05;与低温低氧组比较:#P<0.05
2.3 大鼠脂肪组织PPAR-γ2、PRDM16、UCP-1基因表达与对照组相比,低氧组、低温组、低温低氧组大鼠肩胛棕色脂肪组织PPAR-γ2、PRDM16、UCP-1基因表达均升高(F=378.495、102.061、322.443,P<0.05),肾周白色脂肪组织PPAR-γ2基因表达降低(F=4.555,P<0.05)、PRDM16、UCP-1基因表达均升高(F=24.387、163.660,P<0.05)。与低温低氧组相比,低氧组、低温组大鼠肩胛棕色脂肪组织PPAR-γ2、PRDM16、UCP-1基因表达均更低;低氧组、低温组大鼠肾周白色组织PPAR-γ2基因表达更高,PRDM16、UCP-1基因表达更低(P<0.05)。见图4、5。

图4 大鼠肩胛棕色脂肪组织PPAR-γ2、PRDM16、UCP-1基因表达A:对照组;B:低氧组;C:低温组;D:低温低氧组;与对照组比较:*P<0.05;与低温低氧组比较:#P<0.05
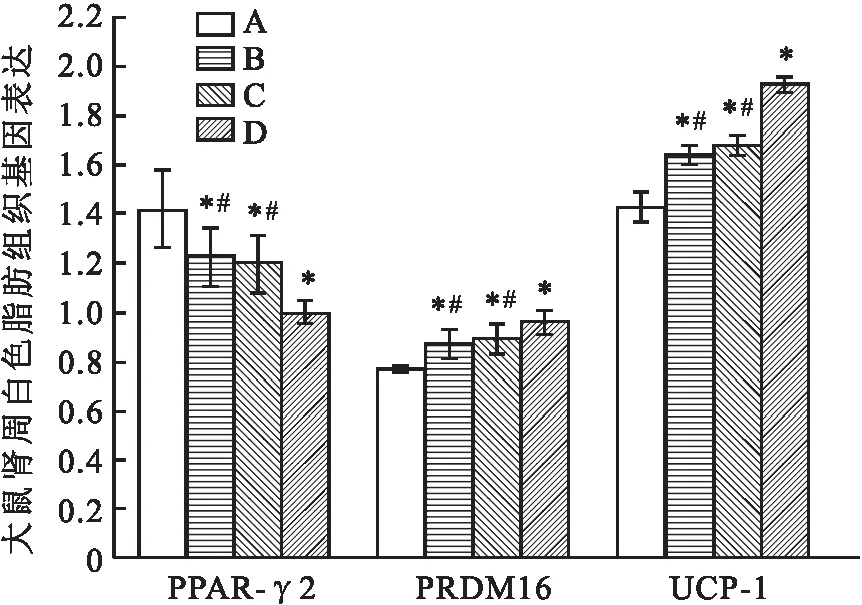
图5 大鼠肾周白色脂肪组织PPAR-γ2、PRDM16、UCP-1基因表达A:对照组;B:低氧组;C:低温组;D:低温低氧组;与对照组比较:*P<0.05;与低温低氧组比较:#P<0.05
2.4 大鼠脂肪组织UCP-1蛋白表达与对照组相比,低氧组、低温组、低温低氧组大鼠肩胛棕色脂肪组织与肾周白色脂肪组织UCP-1蛋白表达均升高(P<0.05);与低温低氧组相比,低氧组、低温组大鼠肩胛棕色脂肪组织与肾周白色脂肪组织UCP-1蛋白表达均降低(P<0.05),见图6~10。
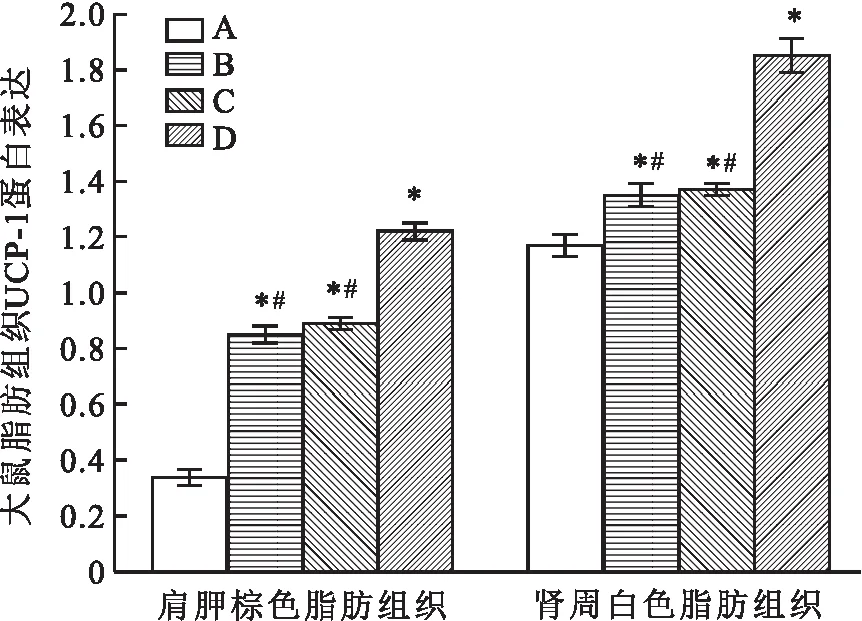
图6 大鼠脂肪组织UCP-1蛋白表达A:对照组;B:低氧组;C:低温组;D:低温低氧组;与对照组比较:*P<0.05;与低温低氧组比较:#P<0.05

图7 大鼠肩胛棕色脂肪组织UCP-1蛋白表达

图8 大鼠肾周白色脂肪组织UCP-1蛋白表达
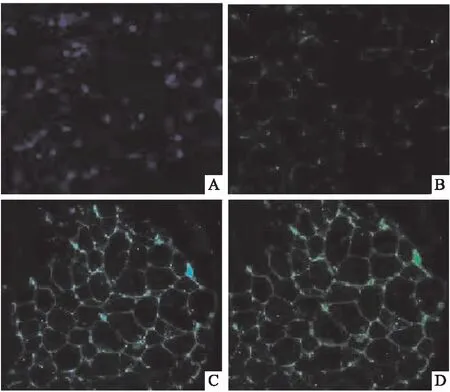
图9 大鼠肩胛棕色脂肪组织UCP-1免疫荧光染色A:对照组;B:低氧组;C:低温组;D:低温低氧组;绿色荧光:UCP-1蛋白;蓝色荧光:DAPI
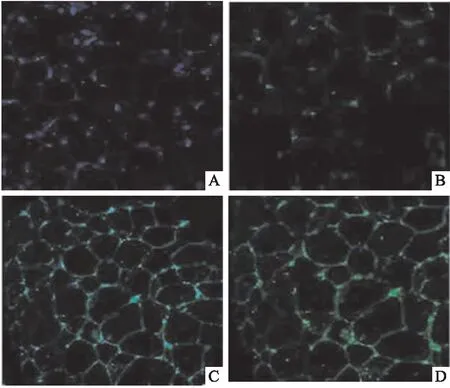
图10 大鼠肾周白色脂肪组织UCP-1免疫荧光染色A:对照组;B:低氧组;C:低温组;D:低温低氧组;绿色荧光:UCP-1蛋白;蓝色荧光:DAPI
3 讨论
肥胖是目前威胁人类健康的重大问题,对于如何减控体质量成为目前研究热点及难点。低氧环境下的体质量减轻是近年发现的一个新的生理现象。研究发现,世居高原的藏族群体除体质量较轻、体型较匀称外,经筛查该群体EGLN1基因和与脂代谢密切相关的PPARA基因表达也明显降低[5]。本研究通过高脂喂食构建肥胖大鼠模型,结果显示,与对照组相比,低氧组、低温组、低温低氧组大鼠体质量、体脂均降低,且低温低氧组大鼠体质量、体脂低于低氧组、低温组,探究了低氧/冷暴露对肥胖大鼠模型白色脂肪棕色化的影响机制。
对于短期的高山跋涉和低氧训练减重等机制的研究结果虽然不一致,但都显示出了短期低氧暴露对减重和脂代谢的促进作用。有研究报道高山跋涉[6]和低氧训练[7]过程中体质量降低主要由体脂率降低所致。国内格日力 等[8]的研究显示平原人暴露在海拔3.5 km以上高原环境后体质量将降低,且与常氧环境比较,自然高原环境和人工模拟氧暴露更易致体质量和体脂含量下降,减脂效果更好。有研究者通过免疫组化揭示了白色脂肪与棕色脂肪生理活动的差异,白色脂肪的主要功能是将体内多余的能量以三酰甘油的形式储存起来,可以消耗能量热,调节体温[9-10]。调控体内白色脂肪与棕色脂肪的含量与比例可消耗机体多余的能量并促进局部甚或全身的脂肪消耗。 与白色脂肪棕色化、棕色脂肪代谢主要相关的经典基因有脂形成基因PPAR-γ2、解偶联蛋白UCP-1、脂肪分化的辅激活基因PRDM16等。在脂肪组织内,基因PRDM16可与PPAR-γ2结合使UCP1高表达,观察特定环境下三种基因的不同表达,可推断出白色脂肪棕色化及棕色脂肪内脂代谢的动态变化过程。
PPAR-γ是一种配体激活的转录因子,参与多种代谢过程中的基因调控,PPAR-γ活化能增加胰岛素敏感脂肪细胞数量,促进线粒体生成,增加UCP-1表达,在脂肪组织分化中起着重要作用[11-13]。UCP-1是棕色脂肪组织发挥产热活性最重要的分子。UCP-1对机体维持体温非常重要,尤其是在啮齿类动物、新生儿和成年人群体,且其水平与肥胖相关的产热功能密切相关,是棕色脂肪细胞形成和活性评价的一个重要指标[14-15]。PRDM16可看作是棕色脂肪分化的辅激活因子,可调控PPARα、CtBP、PGC-1α、PPAR-γ等的转录活性,诱导棕色脂肪特有基因的表达,同时使白色脂肪的基因关闭。PPAR-γ是PRDM16的受体,一些人体研究[16]显示,人体白色脂肪分化为棕色脂肪主要依赖PRDM16。PRDM16的表达又会促进白色脂肪中UCP1的表达,即白色脂肪棕色化,从而促进向棕色脂肪的分化[17]。所以PRDM16通过调控PPAR-γ并激活相关转录功能可刺激棕色脂肪细胞的形成,在促进脂肪细胞分化过程中发挥重要作用。
该研究显示短期低氧或寒冷环境下肥胖小鼠体脂率均降低, 白色脂肪组织中的基因PPAR-γ2表达下调、PRDM16与UCP-1表达上调,考虑为低氧或寒冷可能促进了PPAR-γ2与PRDM16的结合,并抑制了前体细胞向白色脂肪细胞的转化。在棕色脂肪组织中PPAR-γ2与 PRDM16的表达上调,而UCP-1表达上调差异更显著,表明棕色脂肪细胞形成明显增加,棕色脂肪组织代谢加快,产热活性加大,低氧/冷暴露环境加深加快了这一过程。
综上所述,低氧/冷暴露可通过调控脂肪内PPAR-γ2、PRDM16通路使UCP-1高表达,诱导白色脂肪棕色化并影响大鼠体质量。

