肌肽对链脲佐菌素诱导的糖尿病小鼠肾脏铁死亡和炎症的影响
张 崧,刘雪琪,姜 玲,吴永贵
糖尿病肾病是糖尿病常见的微血管并发症,也是导致终末期肾病(end stage renal disease, ESRD)的主要原因之一[1-2]。其特征是蛋白尿及肾功能的进行性减退,延缓其进展仍然是一个全球性难题。肌肽(carnosine,CAR)是一种由β-丙氨酸和L-组氨酸组成的水溶性二肽,天然存在于骨骼肌、大脑和心脏中。CAR在体内广泛分布,且具有多种生物学活性如抗炎、抗氧化应激、抑制RAS系统活性、抑制AGEs及ALEs和缓冲生理酸碱度[3]。课题组前期研究[4]表明CAR可以通过抑制焦亡减轻糖尿病肾病中的足细胞损伤。近期研究[5-6]表明铁死亡在糖尿病肾病发生发展中起关键作用,通过上调核因子E2相关因子2(nuclear factor E2 related factor 2, NRF2)可以抑制铁死亡,从而延缓糖尿病肾病进展[7]。该研究旨在探讨CAR对链脲佐菌素(streptozotocin, STZ)诱导的糖尿病小鼠肾脏铁死亡和炎症的影响。
1 材料与方法
1.1 实验动物及分组本实验使用STZ诱导C57BL/6J(约6~8周龄)小鼠构建1型糖尿病小鼠模型,正常雄性C57BL/6J小鼠作为对照。雄性C57BL/6J小鼠(约6~8周龄)购自安徽医科大学实验动物中心,生产许可证号:SCXK(皖)2017-001,使用许可证号:SYXK(皖)2017-006,并在安徽医科大学动物中心SPF级动物房饲养。实验小鼠在标准条件下的笼子中进行饲养,并在恒温(22±2)℃、湿度为60% 、光暗周期为12 h/12 h的房间中,可以自由获取食物和水。禁食12 h后,根据小鼠体质量,给予小鼠腹腔注射50 mg/kg的STZ,连续5 d。在1周后取小鼠尾静脉血,用血糖仪测量血糖,高于16.7 mmol/L则造模成功为糖尿病模型。所有小鼠被随机分为5组(每组6~8只):正常对照(NC)组、肌肽(CAR)组、STZ模型(STZ)组、STZ模型+肌肽(STZ+CAR)组、STZ模型+铁死亡抑制剂组(STZ+Fer-1组)。根据每笼小鼠体质量,称计算好的量的CAR粉末于EP管中,给药前估算好每笼老鼠每天饮用水总量,将称好的CAR粉末溶于饮用水中。CAR组和STZ+CAR组小鼠均同样给药,CAR给药浓度为1 g/kg。每日给药共16周,并且每天测量每笼小鼠的饮水量和体质量。将Fer-1粉末溶解在DMSO中,用生理盐水稀释,使DMSO的最终浓度为1%,根据每只小鼠体质量计算注射量,Fer-1溶液每天经腹腔注射给药,浓度为5 mg/kg,共给药16周。实验动物均经过安徽医科大学动物研究伦理委员会批准(编号:LLSC20170487)。
1.2 主要仪器石蜡包埋机、石蜡切片机和冰冻切片机购自德国Lecia公司;多功能酶标仪购自美国PE公司;BX 50光学显微镜购自日本OLYPUS公司;电泳仪和湿转仪购自美国伯乐公司;荧光显影系统Li-Cor/Odyssey购自美国LI-COR Biosciences公司;NanoDrop 2000超微量分光光度计购自上海Theromo公司;透射电镜(JEM 1400)购自日本电子公司。
1.3 方法
1.3.1一般生化指标的检测 称量并记录小鼠的体质量。剪去小鼠尾尖,采小鼠尾尖血通过血糖仪测量小鼠血糖。小鼠灌胃CAR 16周后,吸入5%异氟醚麻醉小鼠,用剪刀剪去小鼠眼球周围的胡子,以免影响取血。用弯镊子摘取小鼠右侧眼球进行眼球取血,同时左手轻轻按压小鼠心脏,将血收集在标记好的EP管中,约700 μl。将收集好的小鼠血液放置在室温静置2 h,然后放入离心机离心20 min,转速为2 000 r/min,收集血清样本,按照说明书检测血清CRE和BUN水平。取出小鼠肾脏组织,用纱布吸干组织表明多余水分,称量肾脏的质量并计算肾质量与体质量的比值。进行动物实验前,先在SPF动物房绑好代谢笼,将每只小鼠放入,给予食物和水,24 h后,收集每只小鼠的尿液,离心机离心尽可能去除尿液里的粪便,记录尿量,按照说明书步骤检测小鼠24 h尿白蛋白含量。
1.3.2肾脏组织病理形态学观察 肾脏组织用4%多聚甲醛固定,脱水后包埋在石蜡中,切成4 μm厚切片,按照说明书进行苏木精-伊红(hematoxylin and eosin, HE)染色和糖原染色(periodic acid-schiff, PAS)染色。
1.3.3肾脏组织电镜观察 将肾脏组织切成2 mm ×2 mm大小,先依次放置于3%戊二醛和1%锇酸中进行固定处理,用丙酮对其脱水,最后用环氧树脂对组织进行包埋。定位,制作超薄切片。用醋酸铀和枸橼酸铅对切片进行双重染色。然后在透射电镜下观察肾脏细胞线粒体形态和结构并拍照。
1.3.4免疫荧光染色 石蜡切片于烘箱中70 ℃加热至蜡融化,依次浸泡于二甲苯和梯度乙醇中。滴加内源性过氧化氢酶阻断剂覆盖组织,室温静置20 min。使用枸橼酸盐进行微波加热修复抗原。随后10%山羊血清在37 ℃封闭1 h。使用活性氧(reactive oxygen species, ROS)检测试剂盒检测小鼠肾脏ROS,并在显微镜下观察载玻片并拍照。使用Image J分析图片,计算阳性面积百分比。
1.3.5Real-time PCR实验 使用TRIzol试剂从肾组织中提取总RNA。使用NanoDrop 2000分光光度计评估RNA的浓度和纯度。将RNA逆转录成cDNA并进行扩增。PCR循环条件如下:95 ℃、1 min,95 ℃、15 s,60 ℃、15 s,72 ℃、45 s,共40个循环。采用SYBR®Green RT-PCR检测白细胞介素(interleukin,IL)-1β、肿瘤坏死因子-α(tumor necrosis factor, TNF-α)、单核细胞趋化蛋白1(monocyte chemoattractant protein-1, MCP-1)、IL-6、β-actin 的mRNA水平。以2-ΔΔCt法分析测定基因表达水平。引物序列见表1。

表1 实时定量PCR目的基因引物序列
1.3.6Western blot实验 取适量肾脏组织,加入裂解液(RIPA ∶PMSF=100 ∶1)提取蛋白,并进行BCA蛋白定量分析。蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,随后将蛋白转移至硝酸纤维素膜上。配制1×快速封闭液,封闭15~30 min。随后将膜分别放入抗β-actin(1 ∶5 000)、抗GPX4(1 ∶500)和抗ACSL4(1 ∶1 000)一抗中4 ℃孵育过夜。用TBST洗膜3次,每次10 min。加入HRP标记的山羊抗兔/小鼠IgG二抗(1 ∶5 000)孵育50 min。TBST洗膜3次,使用化学发光系统曝光条带。使用Image J测量条带的灰度值。
1.3.7MDA、GSH和Fe2+含量测定 每组均切除肾组织(50 mg),置于冷生理盐水中。用振动均质器将肾组织均质。离心10 min后收集上清液,测定细胞和组织的GSH、MDA和铁浓度。按照说明书操作,将工作试剂和样品添加到96孔板中进行分析。
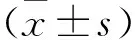
2 结果
2.1 CAR对小鼠一般指标的影响与NC组相比,STZ组小鼠肾质量/体质量(P<0.01)和血糖(P<0.001)升高;与STZ组相比,STZ+CAR组肾质量/体质量和血糖无明显变化。与NC组相比,STZ组CRE、BUN上升(P<0.001);与STZ组相比,STZ+CAR组和STZ+Fer-1组CRE(P<0.001,P<0.01)、BUN(P<0.01)水平下降。见表2。
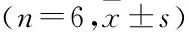
表2 CAR对STZ小鼠一般指标的影响
2.2 CAR对小鼠肾组织病理形态的影响HE染色结果显示,NC组小鼠肾小管形态正常,无扩张,无明显炎症细胞浸润,细胞形态清晰,而STZ组小鼠肾小管明显扩张、大量炎症细胞浸润。与STZ组相比,STZ+CAR组小鼠肾小管扩张明显改善、炎症细胞浸润减少,见图1A,差异有统计学意义(P<0.01)。PAS染色结果显示,STZ组小鼠糖原沉积明显,肾小管扩张,而STZ+CAR组小鼠肾脏糖原沉积减少,肾小管扩张改善,见图1B,差异有统计学意义(P<0.01)。
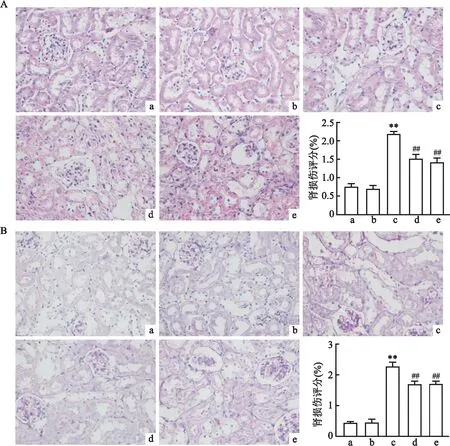
图1 CAR对STZ小鼠肾脏组织病理改变的影响 ×400A:HE染色各组肾脏病理损伤图片观察及其直方图分析;B:PAS染色观察CAR对STZ小鼠肾脏组织糖原沉积的影响及其直方图分析;a:NC组;b:CAR组;c:STZ组;d:STZ+CAR组;e:STZ+Fer-1组;与NC组比较:**P<0.01;与STZ组比较:##P<0.01
2.3 CAR对小鼠肾组织炎症的影响Real-time PCR检测显示,与NC组相比,CAR组肾脏组织中IL-1β、IL-6、MCP-1和TNF-α mRNA表达差异无统计学意义,而STZ组中的表达均升高(P<0.001,P<0.01,P<0.001,P<0.01);与STZ组相比,STZ+CAR 组IL-1β、IL-6、MCP-1和TNF-α的mRNA表达下降(P<0.01,P<0.01,P<0.01,P<0.05)。结果表明STZ小鼠肾脏组织炎症反应增加,CAR可以减轻STZ小鼠肾脏炎症反应。见图2。
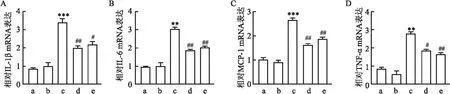
图2 Real-time PCR法检测CAR对STZ小鼠肾脏组织IL-1β、IL-6、MCP-1和TNF-α表达的影响A: Real-time PCR法检测小鼠肾脏组织中IL-1β的表达;B:Real-time PCR法检测小鼠肾脏组织中IL-6的表达;C:Real-time PCR法检测小鼠肾脏组织中MCP-1的表达;D:Real-time PCR法检测小鼠肾脏组织中TNF-α的表达;a:NC组;b:CAR组;c:STZ组;d:STZ+CAR 组;e:STZ+Fer-1组;与NC组比较:**P<0.01,***P<0.001;与STZ组比较:#P<0.05,##P<0.01
2.4 CAR对小鼠肾组织ROS的影响免疫荧光检测结果显示,与NC组相比,CAR组肾脏组织ROS表达差异无统计学意义,STZ组小鼠肾脏中ROS水平升高(P<0.001);与STZ比较,STZ+CAR组和STZ+Fer-1组ROS水平下降(P<0.01)。见图3。

图3 免疫荧光法检测CAR对STZ小鼠肾脏组织ROS表达的影响 ×400A:NC组;B:CAR组;C:STZ组;D:STZ+CAR组;E:STZ+Fer-1组;与NC组比较:***P<0.001;与STZ组比较:##P<0.01
2.5 CAR对小鼠肾脏线粒体形态的影响透射电镜检测小鼠肾脏线粒体形态,与NC组相比,STZ小鼠线粒体肿胀,膜密度增加,线粒体脊减少或缺失,然而,STZ+CAR组和STZ+Fer-1组小鼠线粒体肿胀减轻,膜密度降低,线粒体脊增加,说明STZ小鼠肾脏的线粒体发生了铁死亡样改变,CAR可以抑制STZ小鼠肾脏线粒体形态的改变。见图4。

图4 透射电镜检测CAR对STZ小鼠肾脏组织线粒体形态的影响 ×10 000A:NC组;B:CAR组;C:STZ组;D:STZ+CAR组;E:STZ+Fer-1组
2.6 CAR对STZ诱导的小鼠肾脏铁死亡的影响Western blot检测各组肾脏组织GPX4以及ACSL4蛋白水平的表达,与NC组相比,NC+CAR组肾脏组织GPX4和ACSL4表达差异无统计学意义,STZ组肾脏组织GPX4的表达下降(P<0.001),ACSL4表达升高(P<0.01);与STZ组相比,STZ+CAR组和STZ+Fer-1组肾脏组织GPX4表达升高,ACSL4表达下降,差异有统计学意义(P<0.01)。MDA、GSH和Fe2+检测结果显示,与NC组相比,STZ组肾脏组织MDA和Fe2+含量表达升高,GSH含量表达下降(P<0.001);与STZ组相比,STZ+CAR组和STZ+Fer-1组肾脏组织GSH含量表达升高,MDA和Fe2+含量表达下降,差异有统计学意义(P<0.01)。上述结果提示STZ小鼠肾脏组织发生了铁死亡,而CAR抑制了糖尿病肾病的铁死亡。见图5。
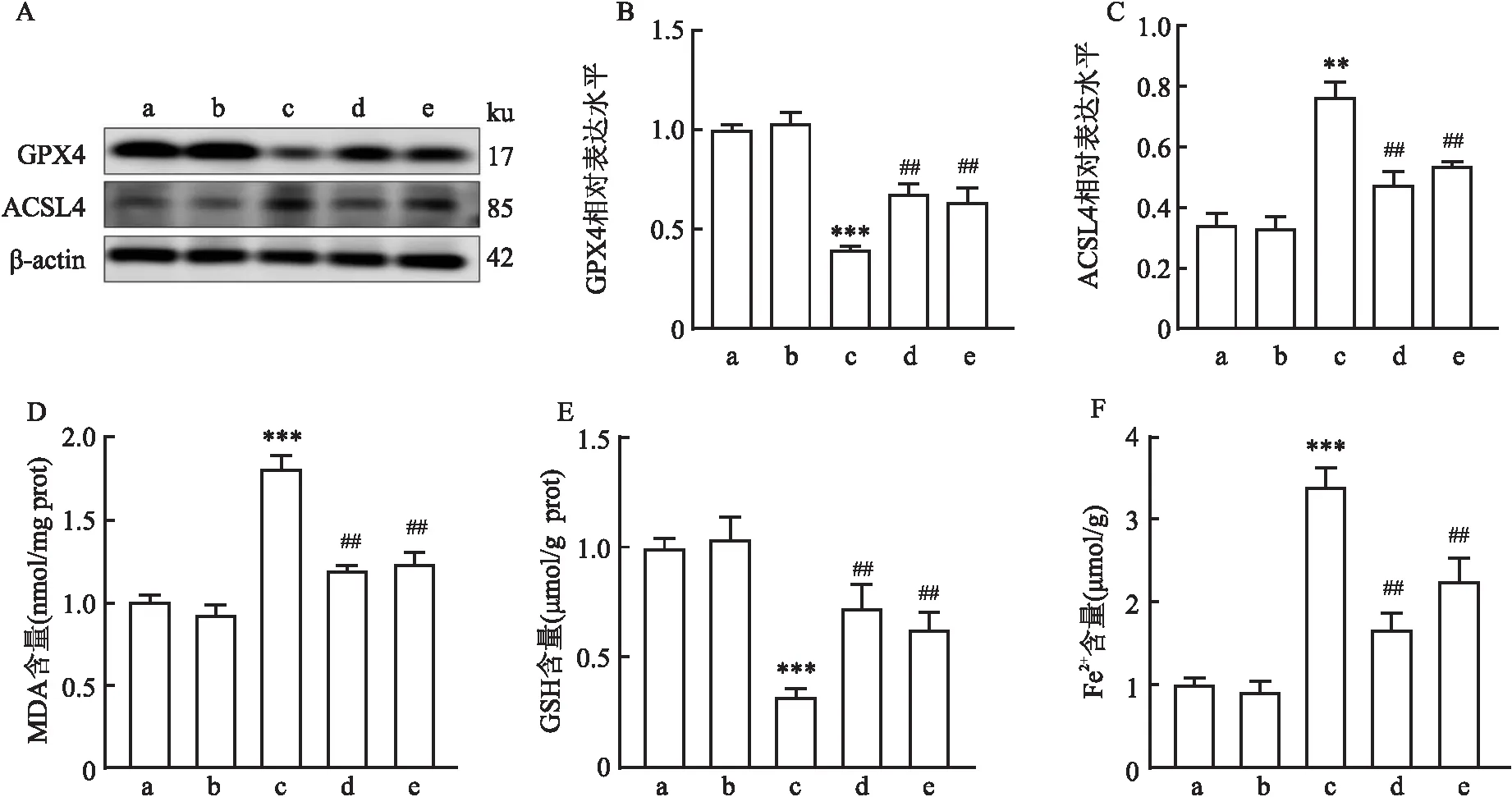
图5 小鼠肾脏组织GPX4和ACSL4蛋白水平表达及MDA、GSH和Fe2+含量测定A~C:Western blot法检测CAR对STZ小鼠肾脏组织GPX4和ACSL4蛋白水平表达灰带图及直方图;D:小鼠肾脏MDA含量;E:小鼠肾脏GSH含量;F:小鼠肾脏Fe2+含量;a:NC组;b:CAR组;c:STZ组;d:STZ+CAR组;e:STZ+Fer-1组;与NC组比较:**P<0.01,***P<0.001;与STZ组比较:##P<0.01
3 讨论
糖尿病肾病的发病机制复杂,既往对糖尿病肾病的研究主要集中在自噬、凋亡、纤维化等,糖尿病肾病仍缺乏有效的治疗,因此,寻找新的机制及新的干预靶点十分重要。糖尿病肾病在临床上是以蛋白尿和肾功能的进行性失代偿为特征。研究[2-3,8]表明汉黄芩素通过抑制PI3K/Akt/NF-κB信号通路来改善糖尿病肾病中的肾小管上皮细胞损伤,小檗碱抑制JAK2/STAT3信号通路缓解高糖诱导的足细胞EMT和凋亡。
铁死亡是一种新型的Fe2+依赖的细胞调节性死亡,其主要特征是铁超载和细胞内ROS的持续积累,导致细胞内脂质氢过氧化物的致命堆积。谷胱甘肽过氧化物酶4(GPX4)是导致铁死亡的关键酶,细胞内谷胱甘肽(GSH)消耗或GPX4失活可诱导铁死亡[9]。铁死亡与许多生理和病理过程有关,包括癌症、神经退行性疾病、器官缺血再灌注损伤和肾功能衰竭[10]。越来越多的研究[11]表明铁死亡可能是糖尿病肾病的治疗靶点,铁死亡可能通过HIF-1α/HO-1通路引起肾小管损伤。
CAR作为天然的二肽,在体内广泛分布,且具有多种生物学活性,如抗炎、抗氧化应激、抑制RAS系统活性、抑制AGEs及ALEs和缓冲生理酸碱度等[12]。CAR具有较强的抗氧化能力,能清除氧化应激条件下细胞膜中过度脂肪酸氧化产生的ROS和α,β-不饱和醛。该研究表明,CAR治疗后糖尿病小鼠的CRE和BUN下降,然而CAR不改变STZ小鼠血糖,表明CAR不是通过降低血糖来发挥保护肾脏的作用。此外,CAR还能改善肾脏组织的病理损伤。进一步研究表明,CAR能够降低糖尿病小鼠肾脏炎症细胞因子(IL-1β、IL-6、MCP-1、TNF-α)的水平。透射电镜结果也显示,CAR改善了STZ小鼠肾脏线粒体的肿胀,膜密度增加,线粒体脊减少或缺失。同时,该研究结果显示,STZ小鼠肾脏组织GPX4表达下降、ACSL4表达升高,CAR处理后逆转了这些改变。这些结果说明CAR对STZ小鼠肾脏损伤具有抗炎和抗铁死亡作用。
据报道,CAR可以通过降低脂质过氧化来改善低氧诱导的心肌损伤[13],CAR可通过抑制焦亡改善糖尿病肾病中足细胞的损伤[4]。该研究评估了CAR对铁死亡的影响,结果证实了CAR可以抑制STZ小鼠肾脏中铁死亡的激活。
综上所述,该研究表明CAR抑制了STZ诱导的糖尿病小鼠肾脏组织的铁死亡和炎症。同时,CAR治疗后明显改善了STZ小鼠的肾功能和肾脏病理损伤。因此,CAR在糖尿病性肾损伤的治疗上有潜在的可能性。该研究仅从体内实验初步探讨CAR对糖尿病性肾损伤具有保护作用,但CAR调控铁死亡具体机制尚不明确,有待进一步探讨。

