LC-MS/MS同时测定22种胆汁酸在孕鼠血清、肝脏、羊水和胎盘中的应用
赵 凡,张 伦,叶 露,张佳怡,余 芸,黄倩倩,王建青
胆汁酸由胆固醇在肝细胞中代谢而来,是胆汁的主要脂质成分,胆汁酸在生物体内能够乳化脂肪、促进脂肪和胆固醇的吸收[1-2]。肝脏中主要合成的初级胆汁酸包括人的胆酸(cholic acid,CA)和鹅去氧胆酸(chenodeoxycholic acid,CDCA)以及啮齿动物的α-鼠胆酸(α-muricholic acid,α-MCA)和β-鼠胆酸(β-muricholic acid,β-MCA),其中CA与CDCA进入肠道后,在肠道菌群的作用下形成去氧胆酸(deoxycholic acid,DCA)和石胆酸(lithocholic acid,LCA)等次级胆汁酸[3-4]。 以上游离的胆汁酸可以与甘氨酸和牛磺酸结合形成相应的结合型胆汁酸。其中大部分胆汁酸通过肝肠循环途径在回肠末端重吸收返回肝脏,剩余少量胆汁酸进入全身循环和随粪便排除[4]。
胆汁酸在细胞中过度积累会对细胞产生毒性,肝细胞中胆汁酸的累积最终将导致肝细胞损伤[5]。不同胆汁酸的生理功能差异较大,有研究[6]报道,LCA的毒性相对较大。测定孕鼠妊娠期体内胆汁酸含量变化,了解妊娠期孕鼠体内胆汁酸的分布情况,运用于妊娠期间孕妇体内胆汁酸紊乱相关疾病的预防具有重要意义。该实验建立LC-MS/MS检测孕鼠血清、肝脏、羊水和胎盘样本中的胆汁酸谱的方法,以期为后续生物样本测定提供参考。
1 材料与方法
1.1 材料
1.1.1动物 癌症研究所(institute of cancer research,ICR)小鼠(8周龄SPF级,雄性36~38 g,20只;雌性27~29 g,40只)购自浙江维通利华实验动物科技有限公司,动物生产许可证号:SCXK(浙)2019-0001。在适宜环境(温度20~25 ℃,湿度50%±5%)饲养7 d。本研究所使用的动物实验均已通过安徽医科大学动物伦理委员会审查并批准(编号:20200523)。
1.1.2仪器 AB Sciex Triple Quad 4500型三重四级杆串联质谱仪(购自美国AB公司);1200系列高效液相色谱仪(购自美国Agilent公司);Analyst1.4.2 数据处理系统、1524R高速冷冻离心机和6K低速离心机(购自珠海黑马医学仪器公司);电子天平(型号:XS105DU,购自上海MettlerToledo公司);超纯水仪(型号:Synergy,购自美国Milli-pore公司);涡旋振荡器(购自美国VortexCenie公司);Bioprep-24R生物样品均质机(购自杭州奥盛仪器有限公司)。
1.1.3药品与试剂 CA(纯度 ≥ 98%,批号:SLCC7722)、LCA(纯度 ≥ 95%,批号:BCBW1723)、CDCA(纯度≥ 97% ,批号:MKBS2816V)、牛磺脱氧胆酸(taurodeoxycholate acid,TDCA,纯度 ≥ 95%,批号:SLBX3488)、牛磺胆酸(taurocholic acid,TCA,纯度≥ 95%,批号:SLCM1787)、甘氨鹅去氧胆酸(glycine chenodeoxycholic acid,GCDCA,纯度 ≥ 97%,批号:SLCD4748)、甘氨熊去氧胆酸(glycine ursodeoxycholic acid,GUDCA,纯度 ≥ 96% ,批号:BCBS9852V) 、熊去氧胆酸(ursodeoxycholic acid,UDCA,纯度 ≥ 99% ,批号:SLBT3485) 、甘氨胆酸(glycocholic acid,GCA,纯度 ≥ 97% ,批号:SLBR1284V)、牛磺熊去氧胆酸(tauroursodeoxycholic acid,TUDCA,纯度 ≥ 98%,批号:13190318)、牛磺鹅去氧胆酸(taurochenodesoxycholic acid,TCDCA,纯度 ≥ 98%,批号:SLCJ5790)和甘氨去氧胆酸(glycine deoxycholic acid,GDCA,纯度 ≥ 97%,批号:BCCG0654),以上药品购自美国西格玛奥德里奇贸易有限公司。牛磺猪去氧胆酸(taurine hyodeoxycholic acid,THDCA,纯度 ≥ 98%,批号:B16A10K94146)、猪去氧胆酸(hyodeoxycholic acid,HDCA,纯度 ≥ 98%,批号:J24GB152684)、牛磺石胆酸(taurine cholic acid,TLCA,纯度 ≥ 97%,批号:D11GS171051)、甘氨猪去氧胆酸(glycine hyodeoxycholic acid,GHDCA,纯度 ≥ 98%,批号:Y23N9K75826)、甘氨石胆酸(glycine cholic acid,GLCA,纯度 ≥ 98%,批号:B29J11K119775)、DCA(纯度 ≥ 98.5%,批号:BCCG6672)、α-MCA(纯度 ≥ 95%,批号:J14HS178006)和去氢胆酸(dehydrocholic acid,DHCA,纯度 ≥ 98.5%,批号:S30J9I64022),以上药品购自上海源叶生物科技有限公司。牛磺-β-鼠胆酸(taurine-β-muricholic acid,T-β-MCA,纯度 ≥ 98%,批号:700244P-1MG-D-010)、β-鼠胆酸(β-MCA,纯度 ≥ 98%,批号:700233P-1MG-C-010)和牛磺-α-鼠胆酸(taurine-α-muricholic acid,T-α-MCA,纯度 ≥ 98%,批号:700243P-1MG-B-010),以上药品购自美国Avanti® Polar Lipids公司。200目粉末状活性炭、高效液相色谱级水、乙醇、冰乙酸、甲醇和乙酸铵,均购自上海麦克林生化科技有限公司。
1.2 方法
1.2.1动物处理 小鼠在适宜环境中饲养7 d,第8天21时将该批小鼠按照2只雄性和4只雌性小鼠的比例进行合笼,次日7时检查阴道栓,共20只雌鼠检查出阴道栓。将有阴道栓的雌性小鼠定为妊娠第0天[(gestational day,GD)0],从中随机抽取7只孕鼠,饲养至GD16进行剖杀,收集母血、母肝、羊水和胎盘。
1.2.2色谱条件 色谱柱:Phenomenex Gemini 3 μm NX-C18 110A (100 mm × 2.0 mm);流动相:A相为含有0.1%冰乙酸的4 mmol/L乙酸铵溶液,B相为甲醇;柱温为40 ℃;流速为0.4 ml/min;进样量为10 μl。梯度洗脱程序见表1。
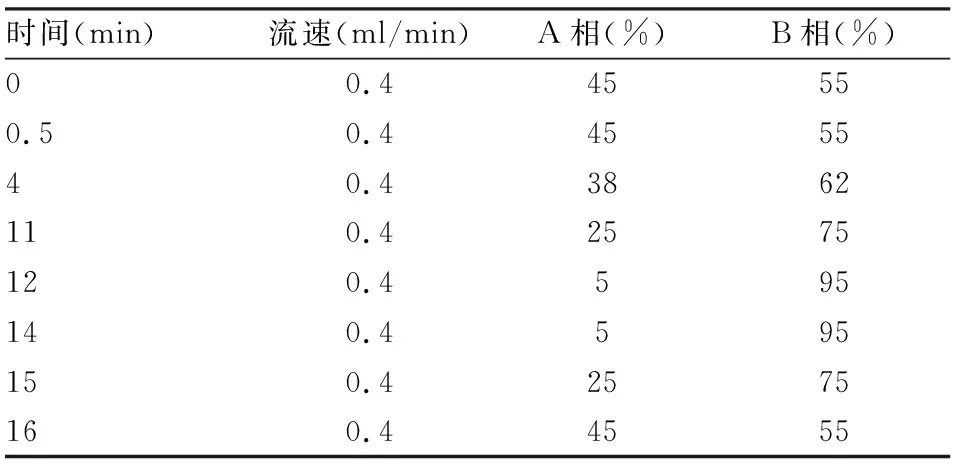
表1 样品分析的洗脱条件
1.2.3质谱条件 电喷雾离子源,负离子检测,扫描方式为多反应监测(multiple reaction monitoring,MRM),电喷雾电压:4 200 V;碰撞气:4 psi;气帘气:30 psi;雾化气:50 psi;辅助气:50 psi;离子源温度:500 ℃。22种胆汁酸及内标质谱优化参数见表2。
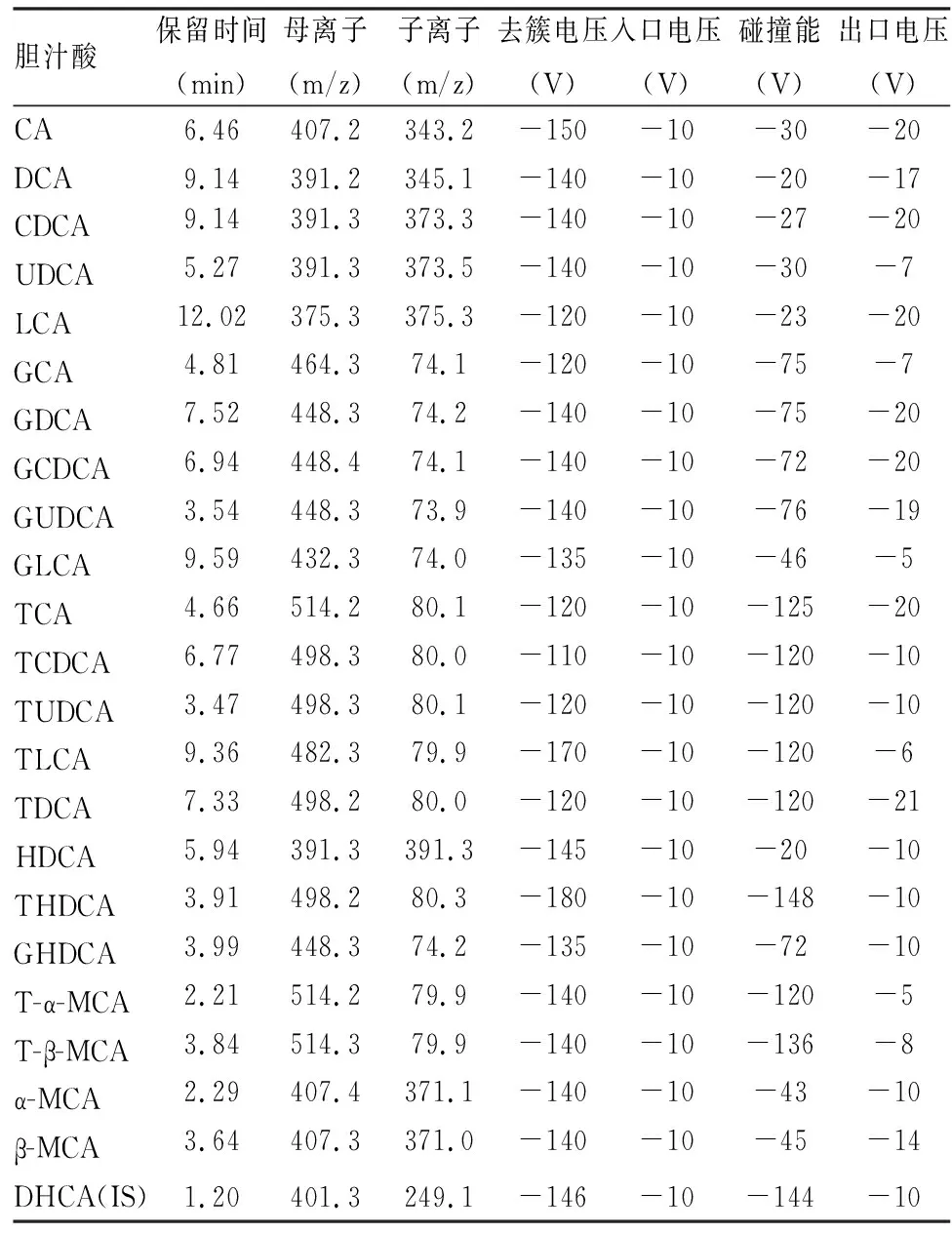
表2 22种胆汁酸及内标质谱优化参数
1.3 样品前处理
1.3.1血清和羊水的处理 血清和羊水各吸取50 μl,加入250 μl甲醇和200 ng/ml的内标溶液50 μl 后,涡旋混匀1 min,于-20 ℃放置20 min,在4 ℃低温离心机中以10 200 r/min,将上清液转移至新的1.5 ml离心管中,氮气吹干;用50 μl 甲醇:水溶液(1 ∶1,V/V)溶解干燥沉淀,在4 ℃低温离心机中以10 200 r/min,取上清液进行分析。
1.3.2肝脏和胎盘的处理 取肝脏和胎盘组织各100 mg,加入装有1 ml 75%乙醇的1.5 ml离心管内,随后进行组织匀浆,先置于50 ℃水浴2 h后,在4 ℃低温离心机中以7 900 r/min,取上清液50 μl 置于1.5 ml离心管中,加入200 ng/ml的内标溶液50 μl ,涡旋混匀1 min,在4 ℃低温离心机中以10 200 r/min,将上清液转移至新的1.5 ml离心管中,氮气吹干;用50 μl 甲醇:水溶液(1 ∶1,V/V)溶解干燥沉淀,在4 ℃低温离心机中以10 200 r/min,取上清液进行分析。
1.3.3空白基质的制备 分别取孕鼠血清、羊水、肝脏和胎盘的匀浆液,配制成活性炭浓度0.1 g/ml匀浆混悬液,震荡涡旋1 h,在4 ℃低温离心机中以11 600 r/min,取上清液备用。
1.3.4胆汁酸储备液和内标溶液及系列工作液的配制 分别取22种胆汁酸组分标准品约10 mg,精密称定,在10 ml容量瓶中用50%甲醇水溶液定容至10 ml,得到1 mg/ml的各胆汁酸溶液。随后将22种胆汁酸组分混匀后定容至10 ml,得到各胆汁酸浓度为10 000 ng/ml的胆汁酸储备液,最终将胆汁酸储备液用空白基质稀释成2.5、5、10、25、50、100、250、500、1 000、2 500、5 000 ng/ml的混合对照品曲线系列工作液,冷藏保存。
取内标对照品约10 mg,精密称定,用50%甲醇水溶液定容至10 ml,充分混匀得到浓度为1 mg/ml的内标混合液,随后用50%甲醇水溶液稀释成200 ng/ml的内标工作液,冷藏备用。
2 结果
2.1 方法学考察
2.1.1专属性 孕鼠空白基质、孕鼠空白基质加入胆汁酸标准品和内标对照品工作液的色谱图分别见图1。
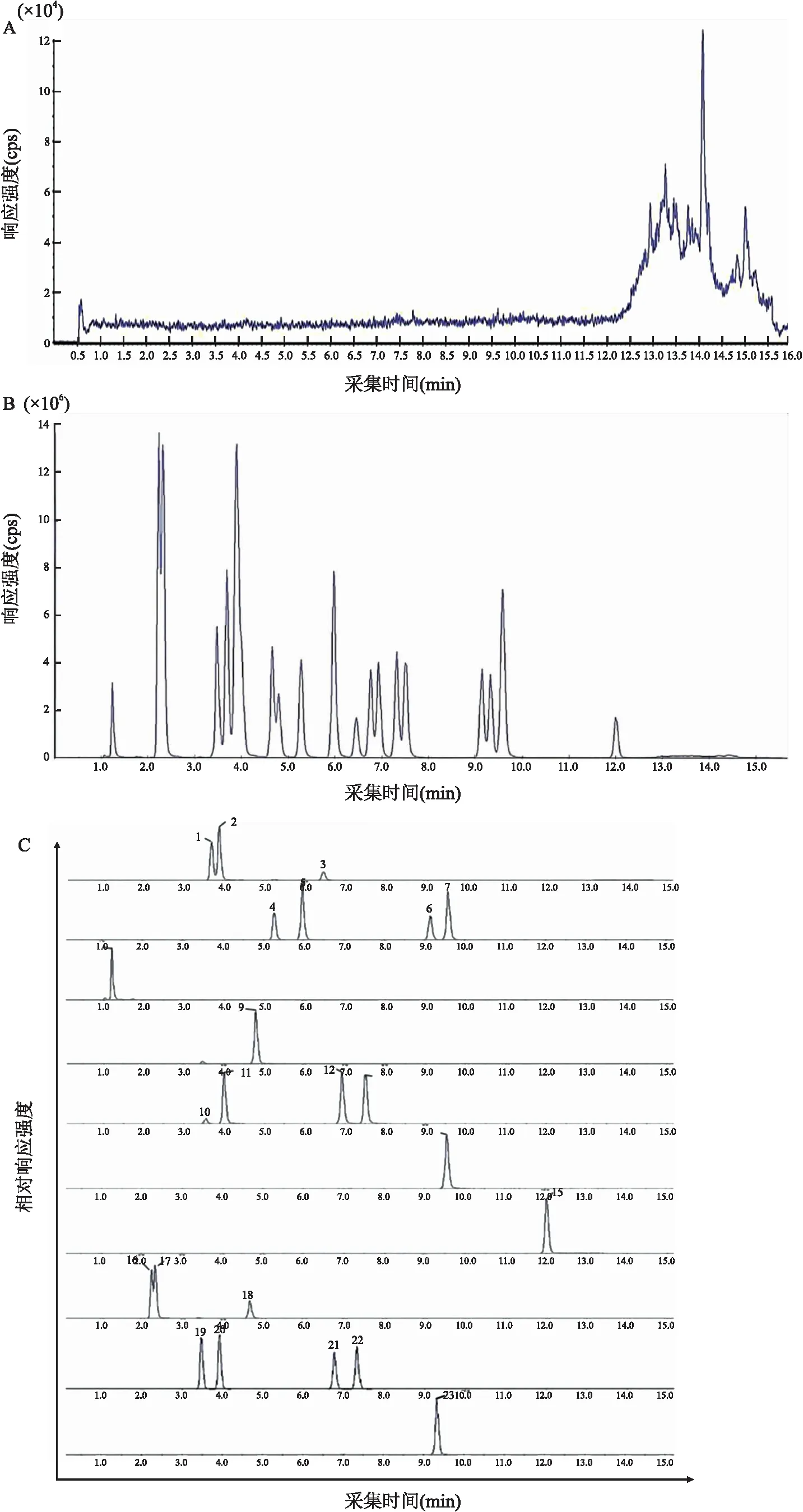
图1 22种胆汁酸和内标LC-MS/MS色谱图A:空白基质;B:空白基质加胆汁酸混标及内标品;C:胆汁酸混标色谱图;1:α-MCA;2:β-MCA;3:CA;4:UDCA;5:THDCA;6:CDCA;7:DCA;8:DHCA;9:GCA;10:GUDCA;11:GHDCA;12:GCDCA;13:GDCA;14:GLCA;15:LCA;16:T-α-MCA;17:T-β-MCA;18:TCA;19:TUDCA;20:HDCA;21:TCDCA;22:TDCA;23:TLCA
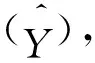
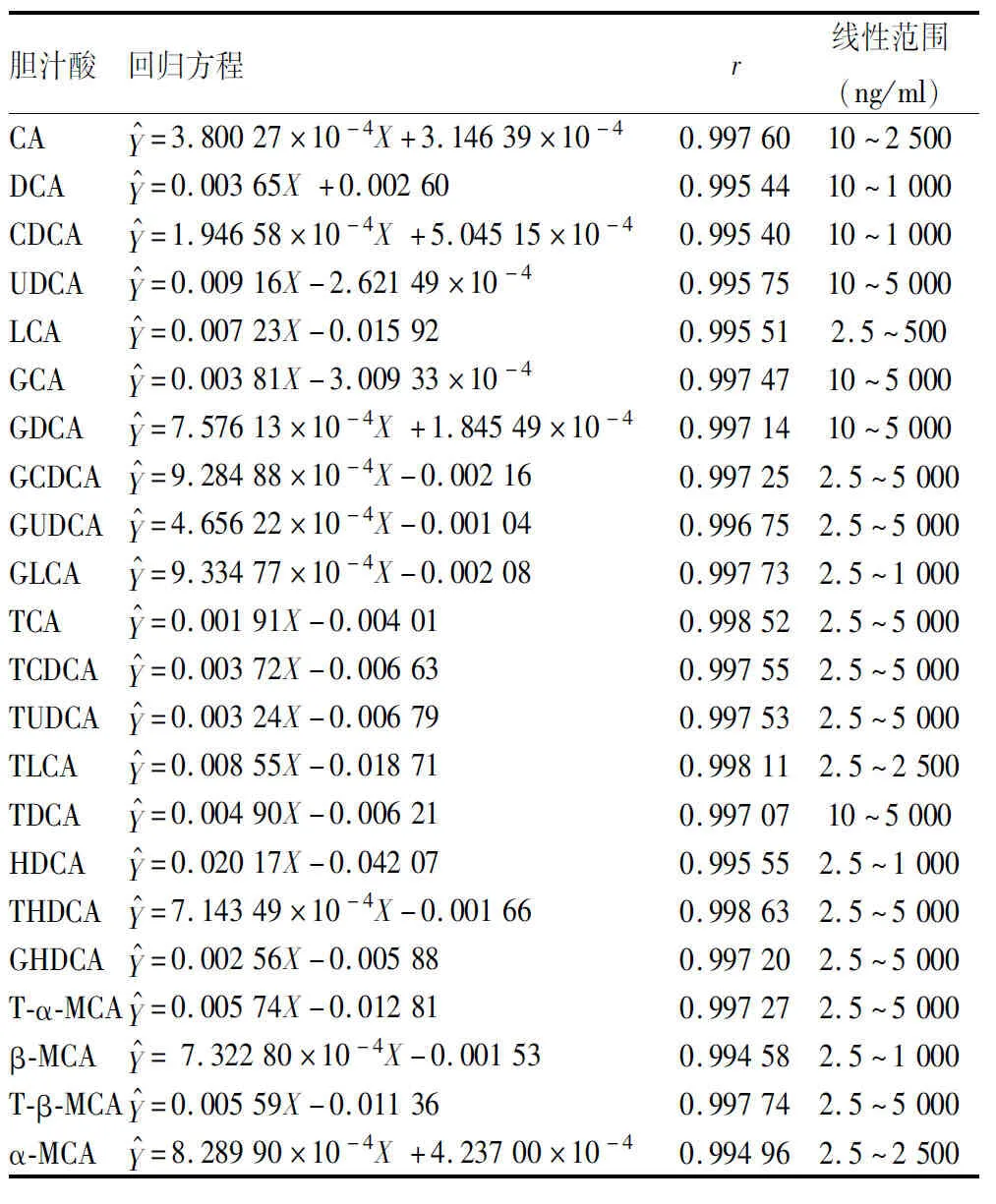
表3 22种胆汁酸线性范围、回归方程以及相关系数
2.1.3准确度与精密度 取胆汁酸混合储备液制备10、50、500 ng/ml 3种浓度的质控样品,每种浓度平行5份,连续进样3 d,计算准确度和精密度,结果见表4。血清样本中各胆汁酸的准确度在89%~106%,日间和日内精密度RSD在0.5%~7.4%,结果符合要求。
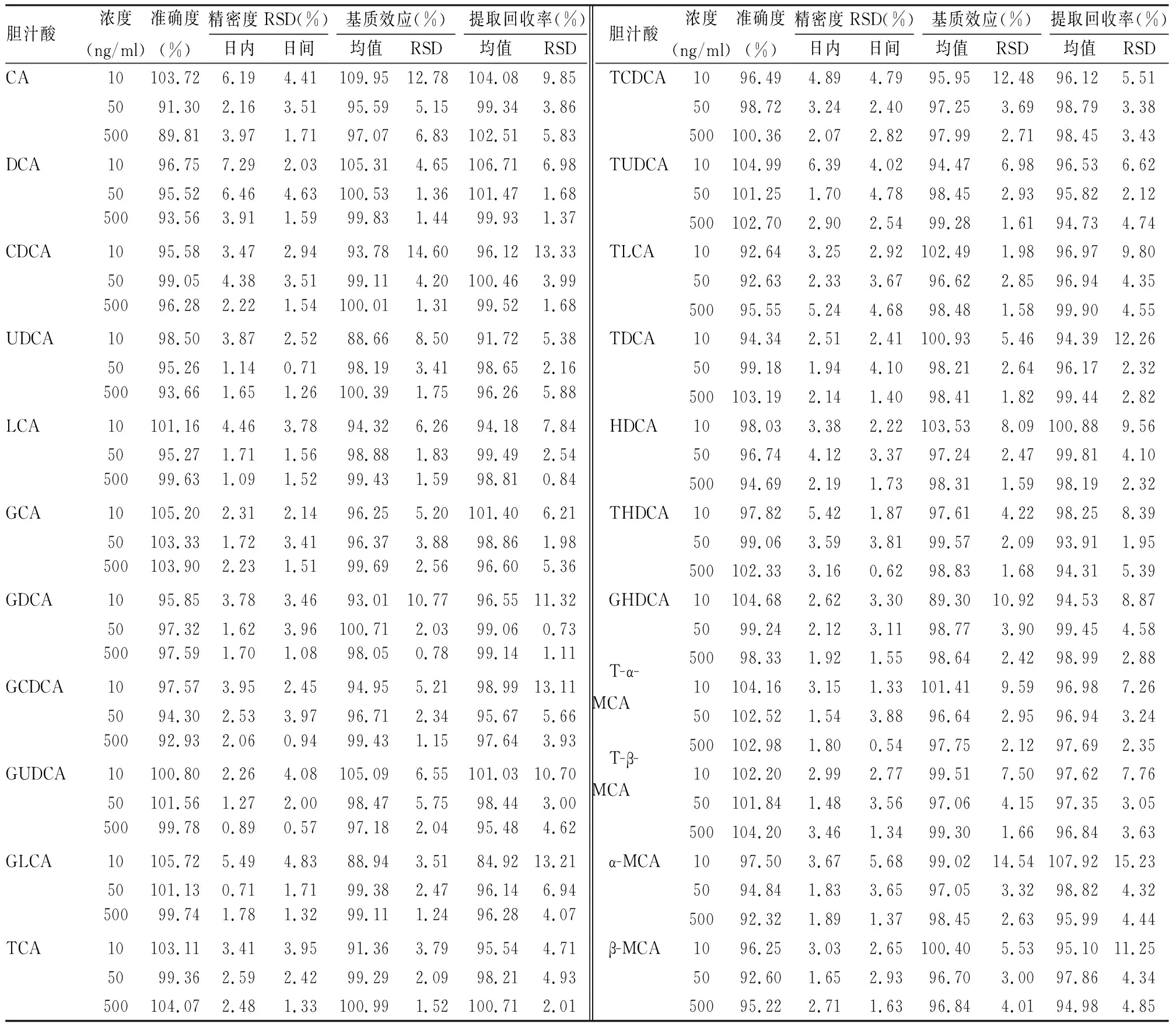
表4 血浆质控样品中各胆汁酸的准确度、精密度、基质效应以及提取回收率
2.1.4基质效应与提取回收率 配制3种标准样品(A1、A2、A3),每种样品配制3个浓度(10、50、500 ng/ml)。A1是使用50%甲醇配制不含基质的混合对照品溶液;A2是使用空白基质氮吹干燥后,使用50%甲醇复溶配制的混合对照品溶液;A3是按照1.2.2项下处理的空白基质配制混合对照品溶液。分别进样,记录各胆汁酸和内标峰面积。A2/A1为质控浓度的基质效应,A3/A2为质控浓度的提取回收率,基质效应准确度在88%~110%,RSD在0.5%~15%,提取回收率在84%~108%,RSD在1%~15%,均符合要求,结果见表4。
2.1.5稳定性 配制样品基质低、中、高3种质控浓度样品,每个质控浓度样品平行制备5份,考察放置于自动进样器24 h、室温放置6 h后,-80 ℃反复冻融3次及-80 ℃冰箱中冷冻保存90 d后的稳定性,结果均稳定。
2.2 孕鼠血清、肝脏、羊水和胎盘的胆汁酸含量测定通过建立的LC-MS/MS方法测定7只孕鼠血清、肝脏、羊水和胎盘的胆汁酸成分。见表5,在母鼠血清胆汁酸成分含量较高的是CA、TCA和β-MCA;肝脏中胆汁酸成分含量较高的是TCA、T-β-MCA; 羊水胆汁酸成分含量较高的是TCA;胎盘中胆汁酸成分含量较高的是TCA。由于不同部位胆汁酸成分含量不同,部分胆汁酸低于仪器检测限而未能检测出来。
3 讨论
胆汁酸是人体内一种重要的内源性物质,而且其理化性质差异较大,存在多种同分异构体[7]。为了使各胆汁酸成分能够在短时间内有效分离,本研究经过多次重复性实验,发现流动相A相中以含有0.1% 冰乙酸的4 mmol/L乙酸铵水溶液分离效果最理想。国内关于孕鼠体内生物样本中胆汁酸成分的测定方法学未见报道。本实验主要使用蛋白沉淀法作为孕鼠血清和羊水的前处理方法,该方法简单快捷[8],对于孕鼠肝脏和胎盘,使用恒温水浴孵育的方法提取胆汁酸进行前处理[9]。对取得处理好的上清液,进行氮吹干燥后复溶上机检测,能够得到很好的检测效果。
本研究测定了孕鼠血清、肝脏、羊水和胎盘的22种胆汁酸成分,包含游离型和结合型在内的初级和次级胆汁酸。检测的结果表明,在孕鼠血清中,游离型胆汁酸含量最高的是CA,占比为29.43%,结合型胆汁酸含量最高为TCA,占比为20.16%。而在孕鼠肝脏、羊水、胎盘中含量最高的均为TCA,且占比均超过50%,并且发现胎盘中可检测的胆汁酸成分最少。在人体中,含量最高的初级胆汁酸有CA和CDCA,以及次级胆汁酸DCA、LCA和UDCA[10-11]。
临床上对于妊娠期肝病多以血清总胆汁酸水平含量作为诊断指标[12]。血清总胆汁酸对于妊娠期肝病的诊断特异性较差,这可能会给临床明确诊断妊娠期肝病带来一定难度,无法早期准确识别妊娠期肝病且易产生混淆和误诊,甚至会导致不良的围产期结局,包括不必要的医源性早产、剖宫产和意外的宫内胎儿死亡[13]。因此,依靠总胆汁酸对妊娠期肝病进行诊断和鉴别诊断具有明显的局限性,该研究使用孕鼠作为实验对象,模拟孕妇妊娠期,建立LC-MS/MS检测胆汁酸谱的方法学有利于妊娠期肝病诊断和治疗,具有重要的临床应用价值。

