核转录因子NFYB和NFYC促进红系终末分化
余东林,杨 希,阴佳滢,刘雪会,吕 湘
(中国医学科学院基础医学研究所 北京协和医学院基础学院 病理生理学系 医学分子生物学国家重点实验室,北京 100005)
红细胞是血液中含量极其丰富的细胞类型,具有携氧能力,对于维持生命至关重要。红系终末分化是产生成熟红细胞的前置步骤,依次经历原幼红(proerythroblast,ProE)、早幼红(basophilic erythro-blast,BasoE)、中幼红(polychromatophilic erythro-blast,PolyE)、晚幼红(orthochromatic erythroblast,OrthoE) 细胞阶段,经脱核产生网织红细胞,进一步在血循环中形成成熟红细胞[1]。红系相关转录因子对于促进红系终末分化成熟具有重要作用,如KLF1、FOXO3、E2F2、NFE2等,其表达异常或缺失导致红系终末分化受阻或抑制脱核引发贫血[2-4]。因此筛选红系终末分化的关键转录调控因子有助于寻找贫血的治疗靶点。
利用单细胞转录组图谱可精确刻画细胞分化轨迹和转录调控网络。近期发表的人与小鼠的红系单细胞转录组图谱可帮助揭示红系终末分化的转录调控机制[5]。SCENIC(single-cell regulatory network inference and clustering)分析是目前较为公认的分析转录因子的方法[6],优势在于在转录因子和靶点基因共表达分析的基础上结合Motif富集分析,从而更加可靠地预测出转录因子主导的基因调控网络。
本研究对人红系终末分化的单细胞转录组进行SCENIC分析,并对预测所得的核转录因子NFYB和NFYC进行验证,初步探究其在红系终末分化中的表达模式及调控作用。
1 材料与方法
1.1 材料
细胞培养基IMDM、DMEM、胎牛血清和HEPES(Gibco公司);实验所需质粒由暨南大学鞠振宇实验室惠赠;T4 DNA连接酶及T4 DNA连接酶缓冲液(BioLabs公司);感受态细胞DH5α(北京全式金生物技术有限公司);C57BL/6 小鼠(北京维通利华实验动物技术有限公司);EcoRⅠ/XhoⅠ内切酶(NEB 公司);反转录试剂盒(南京诺唯赞生物科技股份有限公司);胶回收试剂盒(Thermo Fisher Scientific公司);转染试剂p4000(北京兰博利德商贸有限公司); TER119磁珠(Miltenyi公司);TER119-PE抗体、CD71-APC抗体和FcR 封闭抗体(BD公司);Hoechst 33342和F-108(Sigma-Aldrich公司)。
1.2 方法
1.2.1 构建质粒:借助网站(http://splashrna.mskcc.org/)设计Nfyb和Nfyc的shRNA序列各3条,shLuc:5′-TTAATCAGAGACTTCAGGCGGT-3′,shNfyb-1:5′-TTTTGAACCATTTGTATCTTCA-3′,shNfyb-2:5′-TCTTCATGATCATTCATGCTGT-3′,shNfyb-3:5′-TCA CATAATGACTTCCTCCGAT-3′,shNfyc-1:5′-TTCA TAATCTTCTTAATACGAG-3′,shNfyc-2:5′-TAATCT TCTTAATACGAGCCAG-3′,shNfyc-3:5′-TTTCATA ATCTTCTTAATACGA-3′。合成相应序列后退火合成双链DNA,与酶切后的SFFV-GFP-miR30 载体质粒连接,测序验证插入序列的准确性。
1.2.2 包装病毒:将HEK-293T细胞培养于含10%胎牛血清的DMEM培养基。加入转染试剂P4000、病毒包装质粒psPAX2、pMD2.G和相应的干扰质粒后48、72 h分别收集培养基,过滤后超高速离心得到病毒沉淀,用胎肝增殖培养基重悬保存于-80℃冰箱备用。
1.2.3 小鼠胎肝细胞体外红系分化: 取小鼠E14.5的胎肝,使用1 mL注射器将肝脏吹成单细胞悬液,磁珠分选获得TER119阴性细胞,增殖培养3 d,分化培养3 d[7]。
1.2.4 感染病毒:在体外培养的小鼠胎肝细胞增殖期第1天向细胞中加入F-108和HEPES,颠倒混匀后分孔,分别加入相应的慢病毒,24 h后换液。
1.2.5 荧光激活细胞分选技术分选与检测:小鼠胎肝TER119阴性细胞体外诱导红系分化3 d,取1×107个细胞加入0.5 μL FcR抗体封闭,4 ℃ 15 min,加入TER119-PE 1 μL和CD71-APC(稀释5倍)1 μL,4 ℃ 30 min。使用索尼MA900流式细胞分选仪收集红系终末分化各个时期的(R2~R5)细胞。对基因干扰和对照组细胞,在上述抗体孵育后继续加入Hoechst进行核染色,使用MA900检测红系分化效果和脱核率,FlowJo软件分析结果。
1.2.6 RT-qPCR检测mRNA: 使用Trizol提取RNA,反转录得到cDNA后进行qPCR检测。Nfyb:正向引物5′-GCCTCCCAGCTAGGGATTTC-3′,反向引物5′-TTCCTGTTTGAGGTATGGCATTT-3′。 Nfyc:正向引物5′- TGAAACCTCCAAAGCGCCA-3′,反向引物5′- GTGGTCTGACCCTGCTGAG-3′。 Actin:正向引物5′-CCTTCCTTCTTGGGTATGGAATC-3′,反向引物5′-AGCACTGTGTTGGCATAGAGGT-3′。 Hbb:正向引物5′-CCAGCCTCAGTGAGCTCCACT-3′,反向引物5′- GGCCCAGCACAATCACGAT-3′。
1.3 统计学分析

1.4 生物信息分析
1.4.1 Bulk转录组分析:GEO数据库下载人类和小鼠的红系终末分化各个时期的bulk转录组数据集(GSE53983),使用cutadapt和trimmomatic软件去除接头和低质量序列,通过hisat2软件分别比对到人类基因组hg19和小鼠基因组mm10,得到sam文件,并使用samtools软件压缩为bam文件,使用featureCounts软件得到基因表达矩阵,最后使用R软件进行后续分析。
1.4.2 单细胞转录组分析:GEO数据库下载数据集(GSE150774),使用Seurat包分别处理3个人类骨髓细胞的单细胞转录组表达矩阵,经过无监督细胞聚类,归一化,降维分析等处理后合并。使用rSuperCT包预测细胞类型,只保留红细胞,并使用DoubletFinder包去除doublet,最终保留9 277个细胞用于后续的分析。使用monocle3包进行拟时序分析,从而确定分化的时序关系。
1.4.3 SCENIC分析: 使用SCENIC包用于预测基因调控网络。GENIE3包分析转录因子和靶基因的共表达情况;RcisTarget包进行Motif分析,将不具有共同Motif的靶基因删除,留下的靶基因与转录因子作为一个调节单元,即regulon;AUCell包计算每个regulon在每个细胞的活性打分。
1.4.4 代码可用性:代码已经上传于GitHub(https://github.com/yudonglin506311858/nfyb_project)。
2 结果
2.1 人骨髓红系细胞单细胞转录组图谱分析提示NFYB及NFYC因子参与红系终末分化调控
利用人类骨髓红系终末分化细胞的单细胞转录组数据集(GSE150774)[8],使用Seurat包和monocle3包进行分析,确定分化阶段ProE/BasoE、 Early-PolyE、 Late-PolyE、 Early-OrthoE和 Late-OrthoE(图1A~B)。使用SCENIC预测调控网络单元(regulon)[6]。根据regulon在每个细胞亚群的特异性分数进行排序(图1C~D),NFY转录因子复合物的两个亚基NFYB和NFYC均被预测为红系终末分化早期的调控因子且特异性较高,其regulon活性和RNA表达水平在红系分化较早期的ProE/BasoE和 Early-PolyE中最高(图1E~F)。
2.2 Nfyb和Nfyc在人和小鼠红系终末分化不同时期的表达情况
进一步利用bulk转录组[9]分析Nfyb和Nfyc在红系终末分化各个时期的表达情况。人骨髓细胞红系终末分化早期高表达NFYB和NFYC(图2A),进入OrthoE后显著下降;而在小鼠骨髓红系细胞的表达模式稍有不同(图2B),Nfyb在PolyE时期有更高的表达,Nfyc则在OrthoE表达显著降低。对小鼠胎肝细胞进行体外红系诱导分化,可通过CD71与TER119信号强度将细胞分为R1-R5的5个渐次成熟的细胞群(图2C),Nfyb和Nfyc在终末分化较早期的R3-R4表达上调,随后表达下降(图2D),与小鼠骨髓的转录组数据表现一致。
2.3 敲低Nfyb和Nfyc抑制血红蛋白基因的表达
利用小鼠胎肝体外红系分化体系进行Nfyb和Nfyc的功能研究。两个基因各3条特异性shRNA序列均可在RNA水平显著降低Nfyb或Nfyc的表达(图3A~B)。进一步通过qPCR技术检测红系终末关键的血红蛋白Hbb基因表达,靶向两个基因的3条shRNA序列均可显著下调Hbb的RNA表达水平,提示抑制Nfyb和Nfyc可影响红系终末分化(图3C~D)。
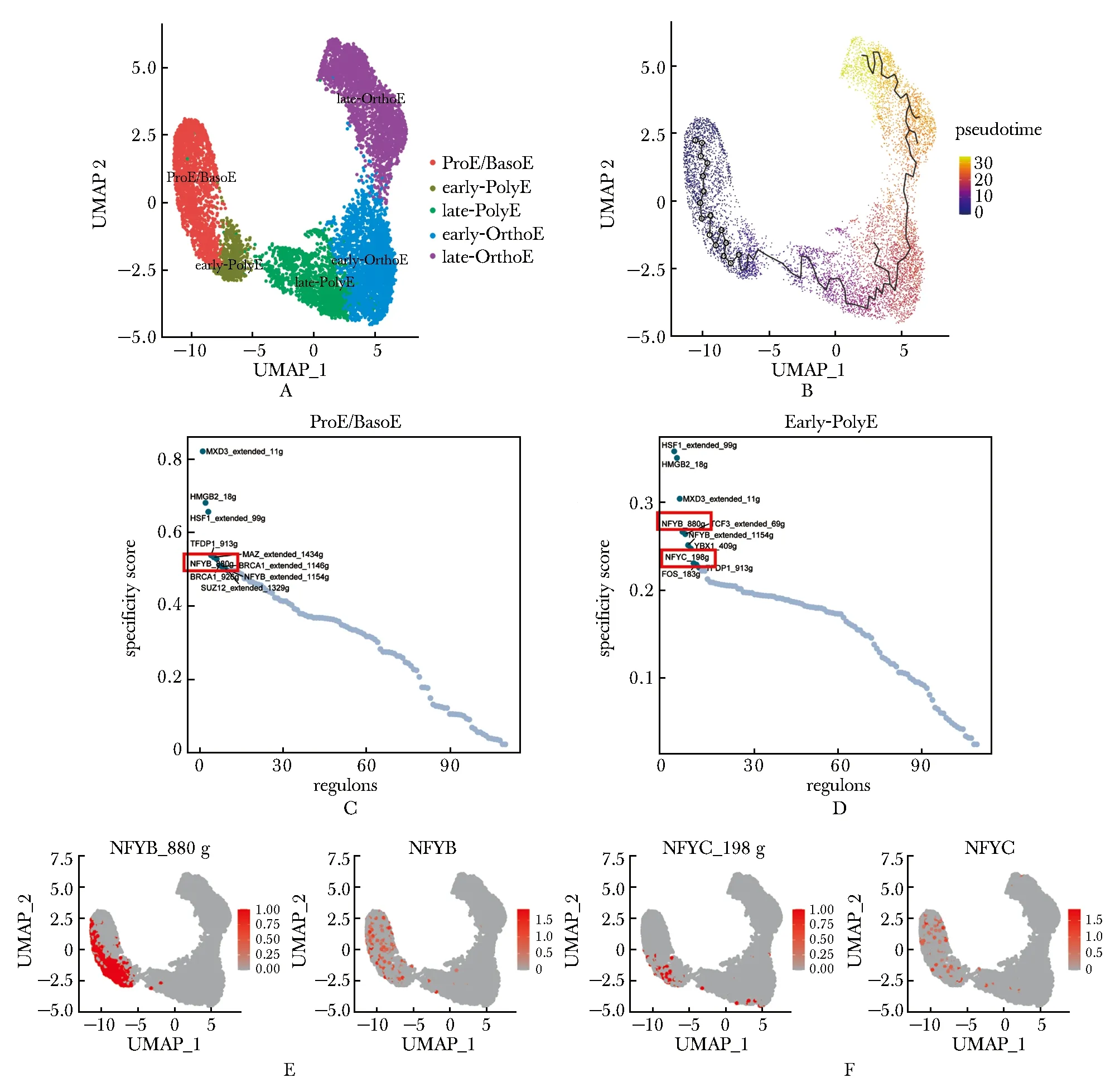
A.UMAP projection of human terminal erythropoiesis, cell types colored by different colors; B.pseudo-time analysis; C,D.regulon specificity score of different regulons in “ProE/BasoE” and “Early-PolyE” cells; E,F.activation (left) and expression (right) of NFYB (E) and NFYC (F) were indicated by red color
2.4 敲低Nfyb和Nfyc抑制红系终末分化及脱核
敲低Nfyb和Nfyc后,流式细胞分析显示红系分化较早期R3和R4比例增加,晚期R5比例显著下降(图4A~B),且红细胞脱核率显著降低(图4A,C),说明抑制Nfyb和Nfyc使红系终末分化阻滞在较早期。
3 讨论
本研究主要基于红系终末分化单细胞转录组数据进行转录调控因子预测,并结合bulk转录组和功能实验初步探究了转录因子NFYB和NFYC在红系终末分化中的表达及作用。结果表明NFYB和NFYC在人与小鼠红系终末分化较早期的BasoE和PolyE高表达,分别敲低后使红系终末分化阻滞在早期,表明NFYB和NFYC是红系终末分化早期的调控因子。
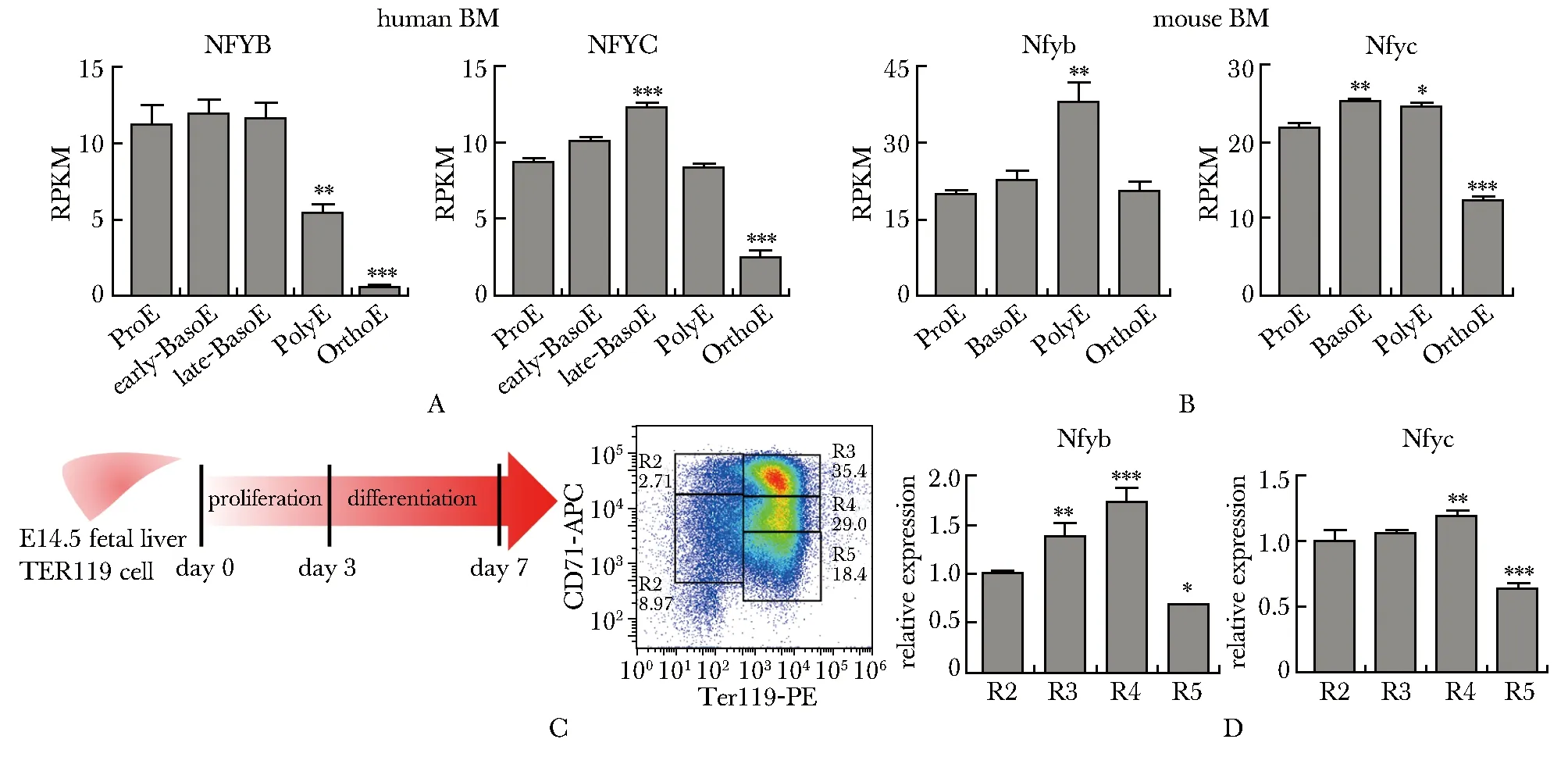
A,B.expression levels of NFYB and NFYC in human (A) and mouse (B) terminal erythropoiesis were identified in published bulk transcriptional sequencing data(GSE53983); C.flowchart of mouse fetal liver in vitro erythroid differentiation and the soring of cells at different maturation stages (R1-R5) by flow cytometry;D.expression levels of NFYB and NFYC at different stages of terminal erythroid differentiation of mouse fetal liver; *P<0.05, **P<0.01, ***P<0.001 compared with ProE or R2
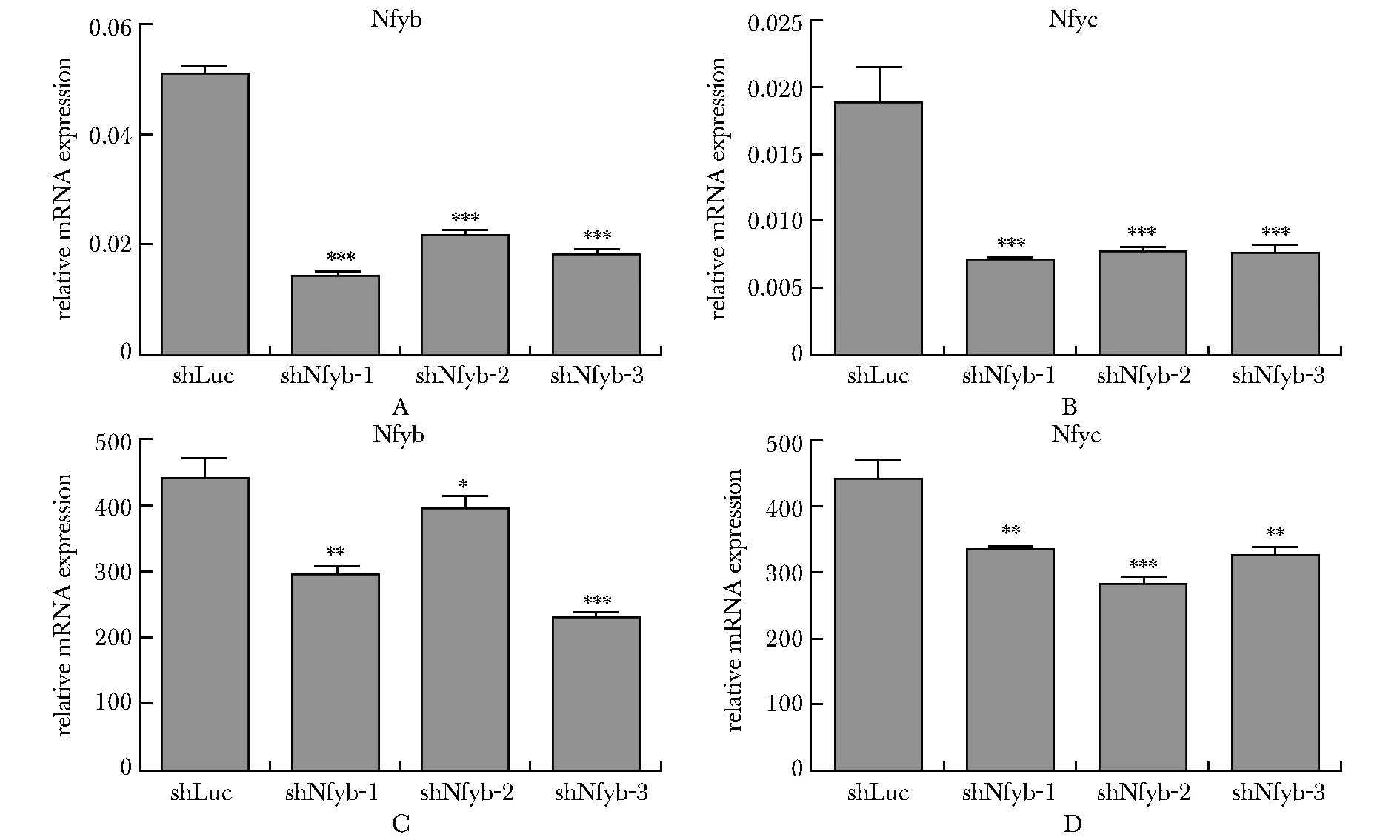
A,B.knockdown efficiency of Nfyb and Nfyc;C,D.RT-qPCR detection of hemoglobin gene (Hbb) expression level;*P<0.05, **P<0.01, ***P<0.001 compared with shLuc group
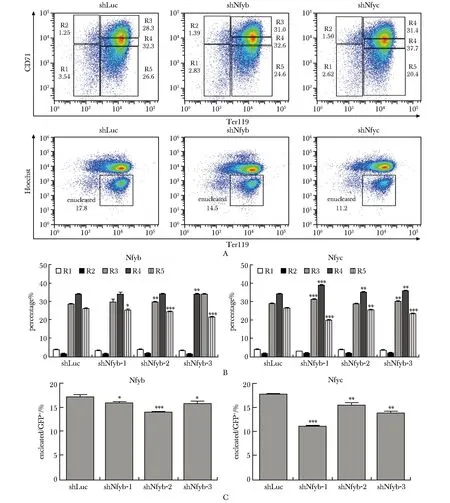
A.representative flow cytometry plots showing the effects of Nfyb and Nfyc knockdown on erythroid differentiation and enucleation; B.knockdown of Nfyb and Nfyc blocked erythroid terminal differentiation; C.knockdown of Nfyb and Nfyc decreased enucleation rate; *P<0.05, **P<0.01, ***P<0.001 compared with shLuc group
NF-Y复合物由NFYA、NFYB和NFYC组成,其中NFYA识别启动子中CCAAT 框的序列,NFYB和NFYC形成类核小体结构[10],招募 TATA 盒结合蛋白(TBP)和RNA聚合酶II到启动子[11]。NF-Y通过直接结合CCAAT 框激活γ-珠蛋白[12],参与珠蛋白的转录[13]。此外,NF-Y是造血干细胞增殖和存活所必需的[14],还具有调节线粒体活性的功能[15]。关于NF-Y在红系终末分化中调控的分子机制尚有待进一步研究。

