转录因子Ikzf1促进小鼠胎肝来源红系细胞终末分化
王佳鑫,余东林,杨 希,刘雪会,吕 湘
中国医学科学院基础医学研究所 北京协和医学院基础学院 病理生理学系 医学分子生物学国家重点实验室,北京 100005
成熟的哺乳动物红细胞是无核的。红系造血在祖细胞阶段具有正常的细胞核,进入终末分化后经历原始红细胞(proerythroblast, ProE)、早幼红细胞(basophilic erythroblast, BasoE)、中幼红细胞(polychromatophilic erythroblast, PolyE)以及晚幼红细胞(orthochromatic erythroblast, OrthoE)时期,细胞核固缩并最终被排出[1]。
Ikzf1编码含6个锌指结构的转录因子IKAROS,是锌指 DNA 结合蛋白家族成员,与染色质重塑相关,对造血系统的发育至关重要。IKAROS参与染色质重塑复合物SWI/SNF 相关蛋白复合物(PYR 复合物)的DNA结合,其含量与PYR复合物形成具有剂量效应[2]。IKAROS缺失小鼠存在淋巴细胞、干细胞和多种造血细胞缺陷,包括贫血和巨核细胞异常。其缺失还可引起珠蛋白基因簇γ 到 β发育开关的转换延迟[3]。但Ikzf1在红系终末分化过程中的作用尚不十分清楚。
SCENIC(single-cell regulatory network inference and clustering)分析可基于单细胞转录组数据预测转录因子[4]。本研究使用SCENIC分析对人和小鼠骨髓红系细胞单细胞转录组进行数据挖掘,并在小鼠胎肝体外分化系统中验证预测所得转录因子Ikzf1基因是否调控红系终末分化。
1 材料与方法
1.1 材料
1.1.1 细胞:人胚肾上皮细胞系HEK-293T(ATCC细胞库);原代小鼠胎肝Ter119阴性细胞取自C57BL/6J孕鼠(北京维通利华实验动物技术有限公司)E13.5胎肝,通过Ter119磁珠阴性分选获得。
1.1.2 试剂:地塞米松、β-巯基乙醇、全转铁蛋白(holo-transferrin)、MTG和胆固醇(Sigma-Aldrich公司); 培养基IMDM (Iscove’s Modified Dulbecco’s Medium)和DMEM(Dulbecco’s Modified Eagle Medium)(Servicebio公司);SCF和IGF-1(Stem cell公司);EPO和IL-3(Peprotech公司);胎牛血清(fetal bovine serum, FBS)、L-谷氨酰胺(L-glutamine)和PFHM-Ⅱ(Gibco公司);重组人胰素(翎圣公司);Ter119磁珠(BD公司);F108和青霉素-链霉素(Invitrogen公司);胶回收试剂盒(赛默飞世尔公司);T4 DNA连接酶及缓冲液、EcoRⅠ、XhoⅠ内切酶(New England Biolabs公司);感受态细胞DH5α(北京擎科生物科技股份有限公司);线性PEI转染试剂 (北京兰博利德高新技术企业);Trizol reagent(Life Technologies)、反转录试剂盒和SYBR Green PCR Mix(南京诺唯赞生物科技公司)。
1.1.3 流式抗体及染料:抗小鼠 CD16、CD32 抗体封闭剂、Hoechst 33342和Ter119-PE(Sigma-Aldrich公司),CD71-APC(BD公司)。
1.2 方法
1.2.1 质粒的构建:利用 SplashRNA(http://splashrna.mskcc.org)设计两条Ikzf1的shRNA序列,序列信息见表1。序列前后加上保护碱基和酶切位点,由上海生工公司合成,梯度退火得到各自相应双链DNA。SFFV-GFP-miR30 载体质粒经酶切后与双链DNA连接。使用DH5α 感受态细胞于LB培养基(含氨苄)中转化后37 ℃过夜孵育,次日挑取各3个单克隆进行测序,确定构建成功的质粒。
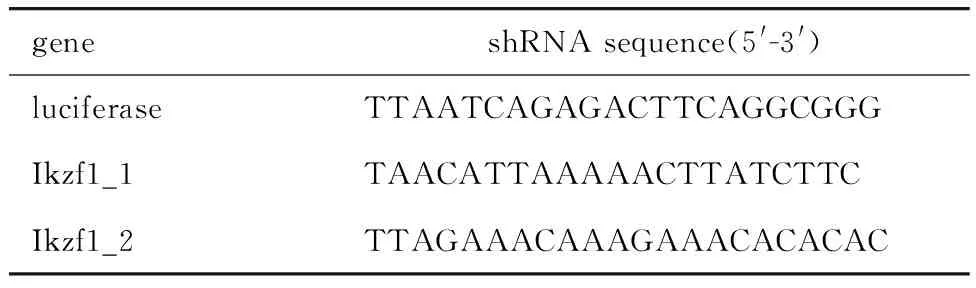
表1 小鼠Ikzf1基因及对照干扰序列Table 1 shRNA sequences for control luciferase and mouse Ikzf1 gene
1.2.2 病毒的包装:将HEK-293T于含10% FBS的DMEM培养基,恒温37 ℃,5% CO2细胞培养箱中培养。配制500 μL的病毒包装质粒体系(psPAX2 7.5 μg、pMD2G 3.5 μg、相应的干扰质粒10 μg、转染试剂P4000 20 μL和0.9%氯化钠溶液), 混匀后室温静置15 min。将其加入培养至70%-80% 汇合的HEK-293T细胞。48 h和72 h后各收集一次培养基(病毒上清),以4 ℃ 3 000×g的条件离心10 min后用0.45 μm滤膜过滤掉细胞沉淀。然后通过4 ℃ 50 000×g离心滤液4 h得到病毒沉淀,用胎肝增殖培养基重悬后冻存于-80 ℃备用。
1.2.3 小鼠Ter119阴性胎肝细胞的体外红系分化:取新鲜或冻存的小鼠胎肝Ter119阴性细胞,用胎肝增殖培养基重悬培养。24 h后加入5% HEPES、5% F108和相应病毒悬液感染胎肝细胞,增殖培养3 d后换分化培养基培养4 d,收集细胞用于检测[5],培养基配方见表2。

表2 胎肝增殖和分化培养基配方Table 2 Fetal liver proliferation and differentiation medium formulation
1.2.4 流式荧光激活细胞的分选与分析:收集106个上述胎肝体外分化细胞加入0.5 μL FcR于4 ℃封闭15 min。加入抗鼠Ter119-PE、CD71-APC抗体,4 ℃避光孵育30 min。4 ℃ 500×g离心5 min,PBS洗涤一次后,加入 Hoechst 33342染料室温染色10 min。使用SONY MA900全自动流式分选仪进行流式数据采集,分析体外红系分化和脱核效率,数据分析使用Flow JoV10软件。其余细胞收集洗涤后上机分选GFP阳性细胞约50万个,用于干扰效率检测。另将诱导体外红系分化第4天的胎肝细胞按CD71与Ter119信号强度分为R1-R5 5个不同成熟度的红系终末分化细胞群分别分选收集,用于检测Ikzf1基因表达。
1.2.5 RT-qPCR检测mRNA:上述收取的R1-R5和GFP阳性细胞,分别使用Trizol提取RNA,检测浓度和质量合格后使用反转录试剂盒将RNA反转录成cDNA。使用SYBR Green法进行实时荧光定量PCR分析(扩增条件:95 ℃ 5 min, 95 ℃ 10 s, 60 ℃ 30 s, 72 ℃ 30 s, 40个循环,72 ℃ 5 min),检测Ikzf1基因在mRNA水平的表达情况。引物序列见表3。
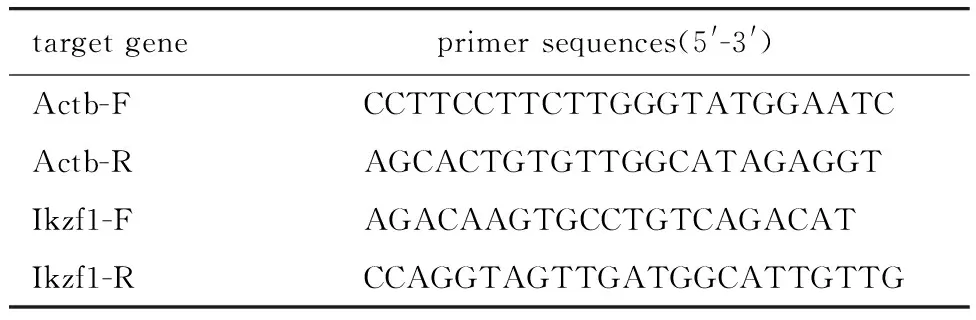
表3 RT-qPCR引物序列Table 3 Primer sequences for RT-qPCR
1.2.6 生物信息分析: 在GEO数据库获取小鼠和人红系终末分化过程中各个阶段的bulk转录组数据集(GSE53983)[6],对数据进行清洗后,通过hisat2软件分别比对到小鼠基因组mm10和人类基因组hg19获取sam文件,经samtools压缩为bam文件,最后通过featureCounts软件获得基因表达矩阵。
单细胞转录组分析:从GEO数据库下载人血细胞单细胞转录组数据集GSE149938[8],选择其中的红系细胞亚群数据。并从下述链接(https://nicheview.shiny.embl.de/)下载处理好的小鼠骨髓单细胞转录组数据NicheData10x.rda,提取其中的红系细胞[7],使用Seurat包,经过标准化,归一以及降维和聚类等分析后,使用SCENIC包预测转录因子。
1.3 统计学分析

2 结果
2.1 单细胞转录组分析提示 Ikzf1参与红系终末分化调控
利用Seurat处理并提取人血细胞和小鼠骨髓单细胞转录组数据集(GSE149938和GSE122467)中的红系细胞群体(图1A,B)。SCENIC预测分别得到人和小鼠红系细胞潜在调控因子(regulon)314个和202个,包括158个人与小鼠共有,156个人类特异的和44个小鼠特异的调控因子(图1C)。其中Ikzf1作为人与小鼠数据共同预测到红系调控因子,其regulon活性和RNA表达水平在人与小鼠红系细胞中均较高(图1D,E)。
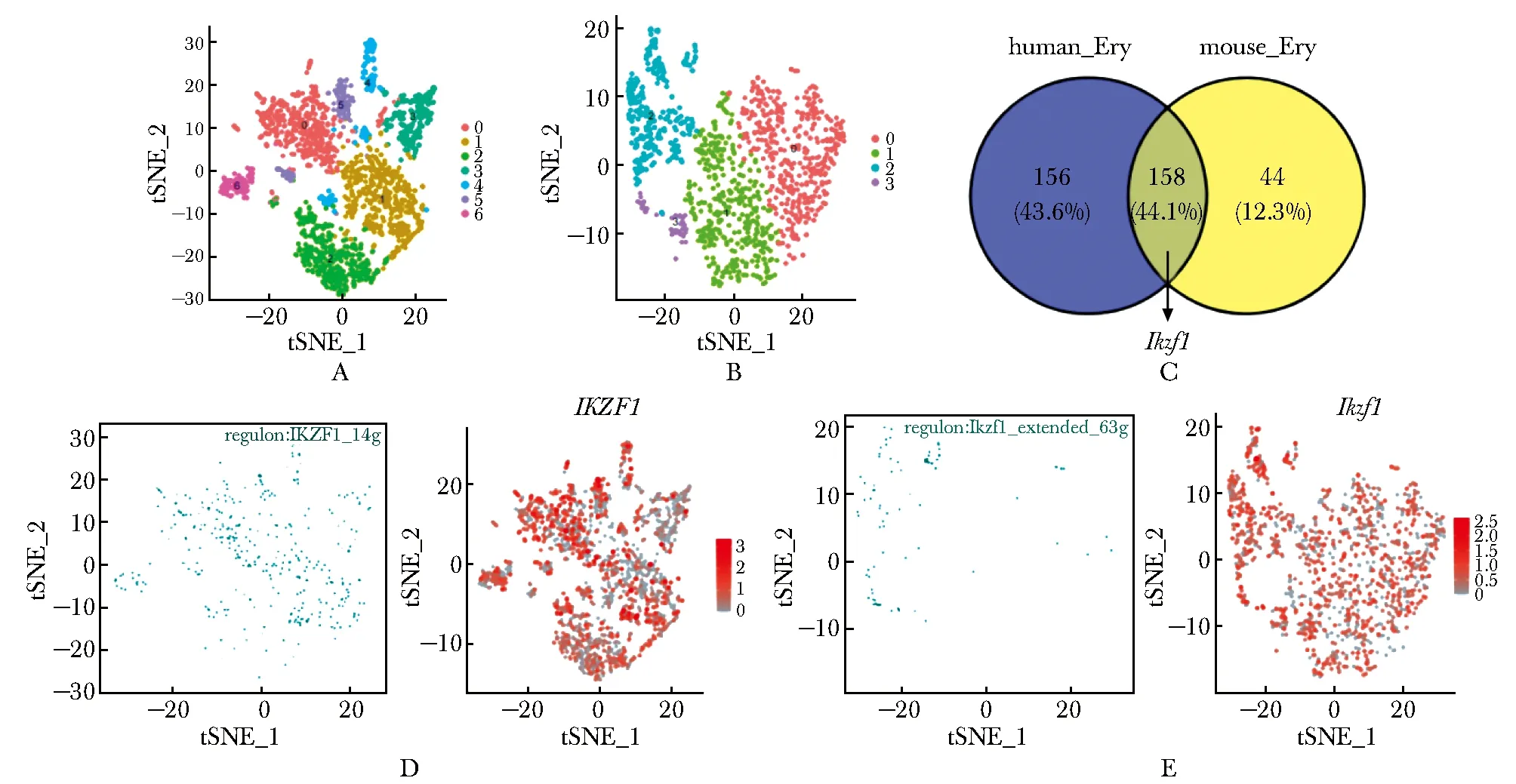
A,B.t-SNE projection of human (A) and mouse (B) bone marrow erythroid cells from two publicly available datasets (human GSE149938, mouse GSE122467), subclusters were shown in different colors; C.Venn diagram represented SCENIC predicted transcription factors using the datasets shown in A and B; D, E.regulon activity (left) and RNA expression (right) of Ikzf1 in human (D) and mouse (E) erythroid cells.图1 人和小鼠骨髓红系单细胞转录组SCENIC分析共同提示 Ikzf1参与调控红系终末分化Fig 1 SCENIC analysis for the single cell transcriptome of human and mouse bone marrow erythroid cells suggested the involvement of Ikzf1 in terminal erythroid differentiation
2.2 Ikzf1在人和小鼠红系终末分化早期富集
转录组数据集(GSE53983)分析提示IKZF1在人早幼红细胞BasoE,尤其是BasoE晚期(late-BasoE)表达水平最高, 而后逐渐下调(图2A)。小鼠Ikzf1基因也在红系终末分化早期高表达,但在原红细胞ProE中表达水平最高(图2B)。进一步在小鼠胎肝细胞体外红系分化体系中验证,利用红系终末分化标志Ter119与CD71的荧光信号强度判断细胞分化成熟度,共分为5个细胞群(R1~R5),RT-qPCR分析显示Ikzf1在终末分化早期的R2~R3(即原红和早幼红细胞)有较高表达,随后表达水平开始下降(图2C),与小鼠的骨髓转录组数据一致。
2.3 敲低Ikzf1抑制小鼠胎肝来源红系细胞终末分化及脱核
与对照组相比,两条shRNA干扰序列均显著降低Ikzf1的mRNA表达水平(图3A)。在分化第4天时流式细胞分析检测红系分化效率和细胞脱核率。与对照组相比,敲低Ikzf1抑制红系终末分化进程,主要表现为早幼红细胞R3增多,中幼红R4减少(图3B),无核红细胞(Ter119+Hoechst-)的比例即脱核率显著降低(图3C)。
3 讨论
本研究利用人和小鼠骨髓红系单细胞转录组的数据预测转录调控因子,并结合已发表的bulk转录组数据和功能实验初步研究了转录因子Ikzf1在红系终末分化过程中的表达变化及功能。 结果显示Ikzf1在红系终末分化早期的原红和早幼红细胞阶段表达较高,敲低Ikzf1表达导致小鼠胎肝细胞体外红系分化阻滞在早幼红时期,同时细胞脱核受阻,提示Ikzf1参与调控红系终末分化。
早期在敲除鼠中的研究工作发现IKAROS缺失会引起多系造血细胞生成障碍,其中红系祖细胞BFU-E和CFU-E的比例大幅下降[8]。IKAROS敲除鼠可成活但存在贫血和明显的脾脏红系造血代偿,骨髓中原红和早幼红细胞比例有所增加[4]。有趣的是,仅影响其DNA结合能力的IkarosPlastic点突变反而导致胚胎纯合致死,伴随更明显的贫血表型以及早幼红至晚幼红细胞的数量大幅减少,脱核率也显著降低[9]。此外,近年临床研究发现IKZF1基因点突变与先天性纯红细胞再生障碍性贫血(Diamond-Blackfan anemia, DBA)的发生有关[9],支持IKZF1在红系终末分化中发挥重要作用[10]。本研究利用小鼠胎肝体外红系分化体系,观察到敲低Ikzf1后红系终末分化受到抑制,且脱核率降低显著,为Ikzf1参与红系终末分化提供了更为直接的证据。
在分子水平上,IKAROS可通过与靶位点直接结合,募集SWI/SNF和 NURD 复合物发挥激活或抑制基因转录的功能,影响包括CD71 转铁蛋白受体、EKLF在内的多个红系基因表达[3]。在IkarosPlastic纯合突变鼠胎肝原红细胞中观察到c-Kit表达的明显下降[9]。Ikzf1调控红系终末分化和脱核过程的下游靶基因和具体作用机制仍需进一步探究。

