microRNA- 144~451基因簇促进红系分化
刘晓玲,王 芳,赵华路,余 佳
(中国医学科学院 基础医学研究所 医学分子生物学国家重点实验室, 北京 100005)
研究论文
microRNA- 144~451基因簇促进红系分化
刘晓玲,王 芳,赵华路,余 佳*
(中国医学科学院 基础医学研究所 医学分子生物学国家重点实验室, 北京 100005)
目的探索microRNA- 144~451基因簇在红系分化过程中的功能及调控机制。方法用real-time PCR法检测microRNA- 144和microRNA- 451的表达;用ChIP结合real-time PCR的方法检测GATA-1和EKLF在microRNA- 144~451基因簇上游的结合及调控;使用microRNA- 144和microRNA- 451模拟物转染K562细胞,并用联苯胺染色和real-time PCR方法检测K562细胞向红系分化;用Western blot方法检测红系分化抑制因子GATA- 2表达。结果microRNA- 144和microRNA- 451在K562细胞红系分化过程中呈现表达逐渐上升趋势;转录因子GATA- 1和EKLF可以结合在microRNA- 144~451基因簇并激活microRNA- 144或microRNA- 451的表达;在K562细胞中过表达microRNA- 144或microRNA- 451均可促进hemin诱导的红系分化;另一方面,microRNA- 144和microRNA- 451可以通过抑制GATA- 2的表达促进细胞向红系分化。结论microRNA- 144~451基因簇在红系分化过程中受到GATA- 1和EKLF的激活调控,同时通过抑制GATA- 2的表达促进红系发育成熟。
microRNA- 144;microRNA- 451;GATA- 1;EKLF;GATA- 2
造血发生是贯穿人一生的生命活动,正常人体血细胞维持数量和功能相对恒定,即衰老、死亡的细胞不断地被新生的细胞所取代。一个正常成年人每天约有1011~1012个新的血细胞生成,同样也有相近数量的血细胞衰老死亡[1- 2]。红系分化是骨髓多能干细胞经历一系列细胞增殖和分化事件最终产生成熟红细胞的过程,其中涉及复杂而精密的基因表达调控。microRNA(miRNA)是在真核生物中发现的一类具有调控功能的内源性小分子非编码RNA。目前研究已充分证实miRNA能通过抑制蛋白质编码基因的表达,参与众多的生物学过程,包括细胞增殖、凋亡、细胞分化和发育等。microRNA- 144~451(miR- 144~451)是一个高度保守且在红系造血发育中特异表达的miRNA基因簇。已有研究发现,该基因簇成员miR- 451在模式生物斑马鱼和小鼠的红细胞发育中发挥重要的调控作用[3- 5]。但是,关于整个miR- 144~451基因簇在人体红系发育中的功能和机制还未见报道。本研究初步探索miR- 144~451基因簇在造血红系发育中的功能和作用机制,为进一步研究miRNA的生物学特性以及在造血发生中的作用奠定基础。
1 材料与方法
1.1 材料
胎牛血清和DMEM培养基(Gibco公司),RNA提取试剂盒Trizol、反转录试剂盒和pcDNA3.1表达质粒(Invitrogen公司),实时定量PCR试剂盒(TaKaRa公司),EZ-ChIP kit (Millipore公司),GATA- 1抗体 (ab11963,Abcam公司), EKLF抗体 (sc- 14034,Santa Cruz公司), miRNA模拟物(mimics)、小干扰RNA(siRNA)分子和转染试剂Dharmacon FECT1(Dharmacon公司),细胞系:人慢性髓系白血病细胞K562(基础医学研究所医学分子生物学国家重点实验室保存)。
1.2 方法
1.2.1 细胞培养及转染:参照文献[6]。
1.2.2 实时定量PCR:按照说明书,用Trizol提取总RNA,紫外分光光度计测定RNA纯度和浓度。mRNA反转录采用oligo(dT18)为引物合成第一链cDNA。用SYBR® Premix Ex TaqTMkit试剂盒完成real-time PCR。mRNA定量检测采用内源性的GAPDH作为内参,miRNA定量检测采用内源性的U6 snRNA作为内参。has-miR- 144成熟序列:5′-U ACAGUAUAGAUGAUGUACU-3′,反转录引物:5′-GT CGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGA TACGACAGTACA-3′,上游引物:5′-GGCCGCGTAC AGTATAGATGA-3′,下游引物:5′-GTGCAGGGTCCG AGGT-3′; has-miR- 451成熟序列:5′-AAACCGUU ACCAUUACUGAGUU-3′,反转录引物:5′-GTCGTA TCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACG ACAACTCA-3′,上游引物:5′-GGCGAAACCGTTACC ATTAC-3′,下游引物: 5′-GTGCAGGGTCCGAGGT-3′;U6 snRNA上游引物:5′-CTCGCTTCGGCAGCAC ATATACT-3′,下游引物:5′-ACGCTTCACGAATTTG CGTGTC-3′; CD235a上游引物:5′-ACAACTTGCCC ATCATTTCTCTG-3′,下游引物:5′-ACAACTTGCCC ATCATTTCTCTG-3′; Gamma-globin上游引物:5′-GCAGCTTGTCACAGTGCAGTTC-3′,下游引物:5′-TGGCAAGAAGGTGCTGACTTC-3′; GAPDH上游引物:5′-TCAACGACCACTTTGTCAAGCTCA-3′,下游引物:5′-GCTGGTGGTCCAGGGGTCTTACT-3′; EKLF基序#1上游引物:5′-AAGGTTCAGGGAGGAAGTG CTT-3′,下游引物:5′-TGAAGGATCTTGTGAGGCAG GT-3′; EKLF基序#2上游引物:5′-TTGAGGGAC AGATCCT-3′,下游引物:5′-AATGATGCAGAAGGTT CC-3′; GATA- 1 基序#1上游引物:5′-AATTCTCTG TCTCAGCCTCCTGA-3′,下游引物:5′-GGTGTATCA CGAGGTCTGGAGTT-3′; GATA- 1 基序#2上游引物:5′-AGGAAGAGTATTAACTGCC-3′,下游引物:5′-AAGGCCTCTGCTGTTTAG-3′; GATA- 1 基序#3上游引物:5′-GCCATGCTTCCTGTGCC-3′,下游引物:5′-CCGGACTAGTACATCATC-3′。
1.2.3 ChIP:K562 细胞用hemin诱导48 h后,参照EZ-ChIP kit 试剂盒说明书完成ChIP。并用定量PCR检测。
1.2.4 联苯胺染色: 参照文献[6]。
1.2.5 Western blot:细胞用预冷的PBS洗2次,加入RIPA 细胞裂解液, 冰浴30 min,4 ℃ 10 000 r/min离心10 min,收集上清,BCA法测定蛋白浓度。取25 g细胞总蛋白进行SDS-PAGE电泳,转膜后,5%脱脂奶粉封闭,1∶500稀释的抗GATA- 1和GATA-2, 4 ℃孵育过夜,TBST洗膜后加二抗辣根过氧化物酶标记的IgG,37 ℃温育2 h,洗膜后加入ECL试剂,在X线片上曝光,显影,定影。抗体洗脱液洗脱后,进行第二次杂交,使用抗GAPDH抗体,操作同上。
2 结果
2.1 miR- 144~451基因簇在K562细胞红系分化过程中的表达检测
在诱导分化过程中,miR- 144(图1A)和miR- 451(图1B)都呈现逐渐上升的趋势。
2.2 转录因子GATA- 1和EKLF结合于miR- 144~451基因簇上游并激活其表达
预测红系分化重要转录因子GATA- 1和EKLF分别与miR- 144~451基因簇上游的3个和2个保守位点相结合(图2A)。结果证明GATA- 1和EKLF均能够与上述位点发生结合(图2B)。在K562细胞中过表达GATA- 1或EKLF能够激活miR- 144和miR- 451的表达(P<0.05);相反地,抑制内源性GATA- 1或EKLF表达时则使miR- 144和miR- 451的水平显著降低(P<0.05)(图2C)。
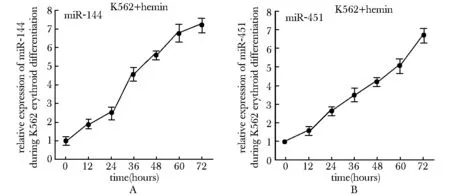
A.expression level of miR- 144 during erythroid differentiation of K562 cells; B.expression level of miR- 451 during erythroid differentiation of K562 cells
图1 Real-time PCR检测miR- 144和miR- 451在K562细胞红系分化过程中的表达
Fig 1 Expression level of miR- 144 and miR- 451 during erythroid differentiation of K562 cells detected by real-time PCR

A.the representation of GATA- 1 and EKLF binding sites upstream of miR- 144~451 gene cluster; B.ChIP-PCR results of GATA- 1 and EKLF in K562 cells; C.expression level of miR- 144 and miR- 451 in K562 cells either with GATA- 1/ EKLF overexpression or inhibition;*P<0.05 compared with pcDNA3.1 or si-control group
图2 GATA- 1和EKLF在miR- 144~451基因簇上游的结合及调控
Fig 2 The occupancy and regulation of GATA- 1 and EKLF upstream of miR- 144~451 gene cluster
2.3 过表达miR- 144~451促进K562细胞红系分化标记基因的表达
miR- 144或miR- 451可分别实现20倍或30倍的过表达效果(P<0.01)(图3A)。联苯胺染色显示过表达miR- 144或miR- 451的K562与对照相比,联苯胺阳性细胞比例显著增加(24、48、72 h均P<0.05)(图3B,C)。另一方面,real-time PCR检测也显示,过表达miR- 144或miR- 451的K562细胞与对照相比,gamma-globin(24、48、72 h,均P<0.05)和CD235a(24和72 h,均P<0.05)的表达水平显著升高(图3D)。
2.4 miR- 144~451通过抑制GATA- 2的表达抑制K562细胞向红系分化
过表达miR- 144或miR- 451可以显著抑制K562细胞内源性GATA- 2的表达(P<0.05),但其对GATA- 2 mRNA的影响并不大(图4)。
3 讨论
红细胞是人类和其他脊椎动物血液中一种重要的血液细胞,血液中的红细胞过少或过多都会造成疾病,但调节红细胞生成的详细分子机制仍未阐明。miR- 144~451基因簇定位于人体的17号染色体,已有研究指出,miR- 451在小鼠和斑马鱼的成熟红细胞内大量存在,miR- 451基因敲除的小鼠几乎没有成熟红细胞的产生[3- 5]。但关于完整miR- 144~451基因簇及其在人红系发育中的功能还未见报道。本研究结果发现,miR- 144~451基因簇的两个成员miR- 144和miR- 451均在K562细胞红系分化过程呈现逐渐上升趋势。同时,在miR- 144~451基因簇上游鉴定了红系分化重要转录因子GATA- 1和EKLF的保守结合位点,并通过表达检测证实了GATA- 1和EKLF可以激活miR- 144和miR- 451的表达。后续的功能试验也证实在K562细胞中过表达miR- 144或miR- 451后,表现为促进其向红系的分化成熟。
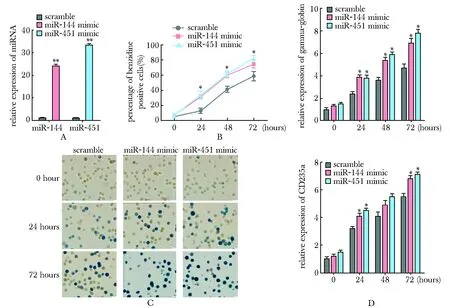
A.expression level of miR- 144 and miR- 451 in K562 cells treated with scramble or miRNA mimic; B.percentage of benzidine-positive cells in K562 cells treated with scramble or miRNA mimic; C.representative benzidine staining in K562 cells treated with scramble or miRNA mimic(×400); D.expression level of gamma-globin and CD235a in K562 cells treated with Scramble or miRNA mimic;*P<0.05,**P<0.01 compared with control group
图3 过表达miR- 144或miR- 451对K562细胞红系分化的影响
Fig 3 The influence of over-expression of miR- 144 or miR- 451 on erythroid differentiation of K562 cells

A.Western blot of GATA- 2 in K562 cells treated with scramble or miRNA mimic; B.real-time of GATA- 2 mRNA in K562 cells treated with scramble or miRNA mimic; *P<0.05 compared with control group图4 miR- 144和miR- 451在K562细胞中抑制GATA- 2的表达Fig 4 Inhibition of GATA- 2 by miR- 144 and miR- 451 in K562 cells
GATA- 2 与GATA- 1同属于GATA转录因子家族,其中GATA- 1是正常红系定向造血的关键,在红系细胞中高表达[7];而GATA- 2则表达于造血干/祖细胞,在造血干细胞自我更新方面发挥着至关重要的作用[8]。已有研究证明,在造血干细胞向红系分化成熟过程中,细胞内GATA- 2的表达逐渐降低,因而过表达及活化GATA- 2可以抑制正常的造血红细胞分化[9]。本研究在K562细胞中,通过Western blot确定了miR- 144和miR- 451对GATA- 2的调控作用,提示miR- 144和miR- 451很可能通过抑制了GATA- 2的表达促进红系分化发育。该研究为进一步阐明miRNA 在造血红系分化中的调控机制提供新的线索,并为相关疾病的分子靶向治疗及预后评估提供新的思路。
[1] Kondo M, Wagers AJ, Manz MG,etal. Biology of hematopoietic stem cells and progenitors: implications for clinical application [J]. Annu Rev Immunol, 2003, 21:759- 806.
[2] Cullen SM, Mayle A, Rossi L,etal. Hematopoietic stem cell development: an epigenetic journey [J]. Curr Top Dev Biol, 2014, 107:39- 75.
[3] Rasmussen KD, Simmini S, Abreu-Goodger C,etal. The miR- 144/451 locus is required for erythroid homeostasis [J]. J Exp Med, 2010, 207:1351- 1358.
[4] Patrick DM, Zhang CC, Tao Y,etal. Defective erythroid differentiation in miR- 451 mutant mice mediated by 14- 3- 3zeta [J]. Genes Dev, 2010, 24:1614- 1619.
[5] Pase L, Layton JE, Kloosterman WP,etal. miR- 451 regulates zebrafish erythroid maturationinvivovia its target gata2 [J]. Blood, 2009,113:1794- 1804.
[6] 赵华路,卜雯婧,李玉霞,等. miR- 34a- 5p抑制K562细胞红系分化[J].基础医学与临床, 2015, 35: 167- 173.
[7] Harigae H. GATA transcription factors and hematological diseases [J]. Tohoku J Exp Med, 2006,210:1- 9.
[8] Kaneko H, Shimizu R, Yamamoto M. GATA factor switching during erythroid differentiation[J]. Curr Opin Hematol, 2010,17:163- 168.
[9] Ohneda K, Yamamoto M. Roles of hematopoietic transcription factors GATA- 1 and GATA- 2 in the development of red blood cell lineage [J]. Acta Haematol, 2002,108:237- 245.
MicroRNA- 144~451 gene cluster promotes erythroid differentiation
LIU Xiao-ling, WANG Fang, ZHAO Hua-lu, YU Jia*
(State Key Laboratory of Medical Molecular Biology, Institute of Basic Medical Sciences, CAMS & PUMC, Beijing 100005,China)
Objective To study the roles of microRNA- 144~451 gene cluster during erythroid differentiation of K562 cells. Methods The expression of microRNA- 144 and microRNA- 451 during K562 erythroid differentiation was detected by quantitative RT-PCR. The occupancy and regulation of transcription factors GATA- 1 and EKLF on microRNA- 144~451 gene was investigated by chromatin immunoprecipitation (ChIP) and quantitative PCR. K562 cells were transfected with the microRNA- 144 or microRNA- 451 mimics, respectively. The effects of over-expression of microRNA- 144 or microRNA- 451 on erythroid differentiation were examined by benzidine staining and quantitative RT-PCR. Western blot was performed to detect the level of erythroid antagonist GATA- 2 upon miRNA over-expression. Results microRNA- 144 and microRNA- 451 were up-regulated during K562 erythroid differentiation. Erythroid transcription factors GATA- 1 and EKLF reside and activate microRNA- 144~451 gene expression. Over-expression of microRNA- 144 or microRNA- 451 in K562 cells accelerates its erythroid differentiation. GATA- 2 was inhibited by microRNA- 144 and microRNA- 451 in erythroid cells. Conclusions The microRNA- 144~451 gene cluster is activated by GATA- 1 and EKLF and then regulates erythroid differentiation of K562 cells via repressing GATA- 2.
microRNA- 144;microRNA- 451;GATA- 1;EKLF;GATA- 2
2015- 03- 19
2015- 04- 15
国家自然科学基金(31471227)
1001-6325(2015)06-0744-05
Q254
A
*通信作者(corresponding author):j-yu@ibms.pumc.edu.cn

