蕨菜多糖的提取、纯化、结构表征与抗氧化活性研究
刘 恒,张秀玲,李 坤,薄艳秋,李佳旭
(东北农业大学食品学院,黑龙江哈尔滨 150030)
蕨菜(Pteridium aquilinumvar.latiusculum),又名拳头菜、龙头菜,目前主要产于长江流域及以北地区[1]。蕨菜营养丰富、口感爽脆、药食两用,日常生活中经常食用可以起到降血压、缓解头晕失眠等症状的作用,还可以增强免疫能力,预防流感[2]。
蕨菜多糖是蕨菜的主要组成成分之一,多糖具有免疫调节[3-4]、抗肿瘤[5]、抗病毒[6]、抗氧化[7]、降血糖[8]及降血脂[9]等药理作用。近些年来对蕨菜中化学成分的研究主要集中在黄酮[10]、多酚[11]、甾醇[12]以及原蕨苷[13]等物质。而对蕨菜多糖研究较少,且对其系统性的分离纯化和结构表征,尤其是对其空间结构和糖苷键类型的研究较少。
近些年来,研究人员常用的多糖提取方法包括热水浸提法、酸(碱)提取法、酶解提取法、超声辅助提取法、微波辅助提取法等,也有将以上提到的两种提取方法结合用于提取多糖[14]。超声辅助提取法作为一种有效提取生物活性成分的方法,已经得到了研究人员广泛的研究。超声辅助提取利用溶剂中声空化的形成和不对称微泡的塌陷所产生的空化效应,释放出大量的能量,增强渗透和毛细效应,促进多糖向溶剂中的扩散,提高提取率[15]。比起传统的热水浸提法,超声辅助提取可以在更短的时间和更温和的条件下获得相同甚至更高的提取率[16]。Devshri 等[17]对比了超声辅助提取法与热水浸提法提取的夏块菌多糖,结果表明超声辅助提取的多糖最大产量为68.91%±1.54%,而热水浸提法的产量仅为28.36%±1.58%,且超声提取多糖表现出更显着的体外抗血糖活性。郝经文等[4]采取超声辅助提取法提取蕨菜多糖,获得了具有高抗癌活性的蕨菜多糖。因此,超声提取法可以有效提取,保持其生物活性。
本试验采用超声辅助提取的方法,对蕨菜多糖进行提取,并用Sevage 法、大孔树脂、透析法进行纯化,较为全面地测定了蕨菜多糖的理化性质,采用高碘酸氧化、碘-碘化钾试验、刚果红试验等方法对蕨菜多糖结构进行表征,测定了蕨菜多糖的体外抗氧化能力,对进一步开发利用蕨菜资源具有重要意义。
1 材料与方法
1.1 材料与仪器
蕨菜干 购自黑龙江省北安农垦天运山产品有限公司;透析袋(截留分子量2000 Da) 购自上海源叶生物科技有限公司;甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、N-乙酰-氨基葡萄糖、葡萄糖、N-乙酰-氨基半乳糖、半乳糖、木糖、阿拉伯糖、岩藻糖等单糖标准品 购自美国Sigma 公司;1,1-二苯基-2-苦基肼(DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS) 购自上海阿拉丁生化科技股份有限公司;刚果红染料 购自上海源叶生物科技有限公司;氯化亚铁 购自天津市富宇精细化工研究所。
LGJ-1A-50 真空冷冻干燥机 北京亚泰科隆仪器技术有限公司;Tu-1810 紫外分光光度计 北京普析通用仪器有限公司;IR-Tracer-100 岛津傅里叶变换红外光谱仪、LC-20AD 岛津高效液相色谱仪、LC 20 AT 岛津单泵高效液相色谱仪 日本岛津公司;INFINITE M200 PRO 多功能酶标仪 帝肯(上海)贸易有限公司;S450 小型粉碎机 购自浙江永康市红太阳机电有限公司;GS-100A 多功能超声波清洗仪 购自深圳歌能清洗设备有限公司。
1.2 实验方法
1.2.1 蕨菜多糖的提取及纯化 参考华智锐等[18]的方法以及前期试验工作。用粉碎机将干燥的蕨菜粉碎,过80 目筛,收集粉末,用石油醚浸泡24 h。将预处理好的蕨菜粉按料液比1:40 的比例加水混合,25 ℃,540 W 超声提取45 min。超声后离心收集上清液浓缩。加入3 倍体积的乙醇,在4 ℃下醇沉12 h。然后将沉淀复溶,加入Sevage 溶液(氯仿:正丁醇=4:1)除蛋白,重复至无沉淀,旋蒸去除残留的有机溶剂。采用湿装法将D-101 大孔树脂进行灌柱,用约5 倍体积的双蒸馏水进行渗透清洗。用0、20%、40%、60%、80%和100%体积的乙醇溶液、洗脱速率3 BV/h 分步洗脱大孔树脂纯化蕨菜多糖,并将洗脱液旋转蒸发、冷冻干燥。D-101 大孔树脂过滤,去离子水透析24 h,-10~-50 ℃冻干。
1.2.2 化学成分测定 蕨菜多糖的总糖含量采用苯酚-硫酸法[9],以不同浓度葡萄糖溶液为标准品,制作标准曲线,可得标准曲线y=0.0053x+0.7443(R2=0.9974)。将1 mL 1.0 mg/mL 蕨菜多糖溶液与浓硫酸和苯酚溶液混合,在490 nm 处测定吸光度,带入标准曲线计算含量。
蛋白质含量采用考马斯亮蓝法[19],配制不同浓度的牛血清血蛋白制作标准曲线,得到标准曲线y=0.0132x+0.2784(R2=0.9997)。将1 mL 1.0 mg/mL蕨菜多糖溶液与5 mL 考马斯亮蓝溶液混合,静置5 min 后在595 nm 处测定吸光度,带入标准曲线计算含量。
总酚含量采用福林-酚比色法[20],配制不同浓度的没食子酸溶液,制作标准曲线,得到标准曲线y=5.3929x+0.0486(R2=0.993)。加入0.5 mL Folin-酚试剂、1.5 mL 15%碳酸钠溶液,75 ℃水浴15 min,测定760 nm 处吸光度,带入标准曲线计算含量。
黄酮含量采用分光光度计法[21],配制不同浓度的芦丁标准品溶液,制作标准曲线,得到标准曲线y=0.763x+0.03(R2=0.993)。加入1 mL 50 g/L NaNO2溶液,混匀后静置6 min;再加入1 mL 10% Al(NO3)3溶液,同样静置6 min;最后加入10 mL 100 g/L NaOH 溶液,静置15 min,在510 nm 处测定吸光度,带入标准曲线计算含量。
硫酸根含量采用氯化钡-明胶法[22],加入0.2 mL 1.0 mg/mL 蕨菜多糖溶液,然后加三氯乙酸3.8 mL和氯化钡溶液l mL 混匀,静置25 min 后于360 nm测定吸光度。
糖醛酸含量采用间羟基联苯比色法[23],取样品5 mg 置100 mL 容量瓶加水溶解定容至刻度。取溶液1.00 mL 于10 mL 试管,置冰水浴中,加入四硼酸钠/硫酸溶液6 mL,待全部加完后,用旋涡混合器混匀,沸水浴中加热5 min,在冰水浴中冷却后用微量加样枪加入1.5 mg/mL 间羟基联苯溶液100 μL,混匀后振摇5 min,525 nm 处测定吸光度。
1.2.3 单糖组成测定 采用岛津单泵高效液相色谱仪测定单糖组成。精密称取甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、N-乙酰-氨基葡萄糖、葡萄糖、N-乙酰-氨基半乳糖、半乳糖、木糖、阿拉伯糖、岩藻糖对照品适量,加水溶解稀释至每1 mL 中各含50 μg 的混合对照溶液。精密称取蕨菜多糖约3.0 mg 至10 mL 安培瓶中,加入3.0 mL 2 mol/L 三氟乙酸(TFA)于10 mL 安瓿瓶中,封管,120 ℃酸解4 h。取出后加入甲醇,氮吹至TFA 挥发完全,加3.0 mL 水复溶。精确吸取250 μL 样品溶液到5 mL EP 管中,加入250 μL 0.6 mol/L NaOH,500 μL 0.4 mol/L 1-苯基-3-甲基-5-吡唑啉酮(PMP)-甲醇,70 ℃反应1 h。于冷水中冷却10 min;加入500 μL 0.3 mol/L HCl 中和,再加入1 mL 氯仿漩涡1 min,3000 r/min 离心10 min,取上清液,分液漏斗萃取3 次。取上清液用于HPLC。
色谱条件:仪器:岛津LC-20AD。色谱柱:Xtimate C18(4.6×200 mm,5 μm)。柱温:30 ℃。流速:1.0 mL/min。检测波长:250 nm。进样量:20 μL。流动相:0.05 mol/L 磷酸二氢钾溶液(用氢氧化钠溶液调pH 为6.70):乙腈=83:17。
1.2.4 蕨菜多糖分子量分布测定 采用岛津LC-20AD 高效液相色谱仪测定蕨菜多糖的分子量。使用5 种分子量的葡聚糖(Mw 分别为6300、22000、49400、334000、642000 Da)进行液相色谱分析。以保留时间(TR)为横坐标,葡聚糖标准品的分子量的对数(lg Mw)为纵坐标作标准曲线,标准曲线的回归方程为y=-0.6092x+13.747(R2=0.9772)。将蕨菜多糖配制成2 mg/mL 的溶液,通过0.22 μm 微孔膜后以同样的条件进行高效液相色谱分析。
1.2.5 傅里叶红外光谱分析 准确称取多糖样品1.0 mg,干燥的KBr 150.0 mg 研磨混合均匀,在压片机上用5~10×104KPa 压力压成透明薄片,用KBr 片做空白。利用红外光谱仪进行扫描,测定多糖样品的红外透过率,扫描范围:400~4000 cm-1,分辨率:4 cm-1。
1.2.6 紫外光谱分析 将1.0 mg/mL 蕨菜多糖溶液在200~400 nm 波段下进行紫外光谱扫描,观察光谱中260 nm 和280 nm 有无吸收峰,检测蕨菜多糖有无杂质。
1.2.7 高碘酸氧化试验 在多糖的不同糖苷键类型中,1 mol 的非还原端或(1→6)位糖苷键被2 mol 高碘酸氧化并生成1 mol 甲酸,1 mol 的(1→2)、(1→4)位糖苷键被高碘酸氧化时,只消耗1 mol 高碘酸,不会生成甲酸,(1→3)位糖苷键则不能被高碘酸氧化。因此,测定高碘酸氧化过程中消耗的高碘酸钠含量和生成的甲酸含量,可以计算得出不同糖苷键类型占比。
参考赵楚华[24]的试验方法有适当修改。称取0.6419 g 高碘酸钠,去离子水定容至100 mL 容量瓶,制得NaIO4标准溶液。准确吸取NaIO4标准溶液0、0.5、1.0、1.5、2.0、4.0 mL 置于试管中,去离子水补足至4 mL,混匀。再分别吸取100 μL,去离子水定容至25 mL 容量瓶,混匀后室温静置5 min,测定223 nm 处的吸光度。以吸光度值为y 轴,NaIO4浓度为x 轴,绘制NaIO4标准曲线,NaIO4标准曲线的回归方程为:y=0.0196x+0.5934(R2=0.9975),表明高碘酸钠浓度在0~4 mmol/L 之间有良好的线性关系。
称取20 mg 蕨菜多糖样品,置于25 mL 容量瓶中,加入15 mL NaIO4标准溶液,去离子水定容,涡旋混匀,置于4 ℃冰箱中反应。每隔一段时间后,吸取100 μL 反应溶液,置于25 mL 棕色容量瓶中,定容。测定223 nm 处的吸光度值,直至吸光度值稳定不变,再向其加入1.5 mL 的乙二醇,终止反应。根据制作的NaIO4标准曲线,计算蕨菜多糖消耗的NaIO4摩尔量。吸光度不变后,取一定体积反应液,采用碱滴定法定量出反应生成的甲酸。
1.2.8 刚果红试验 刚果红可与三股螺旋构象的多糖形成络合物,而络合物的最大吸收波长同刚果红相比会发生红移。而在NaOH 的浓度超过阈值的情况下,络合物结构被破坏,最大吸收波长发生明显下降。因此,根据最大吸收波长的红移和降低情况,可以判断多糖中是否具有三螺旋结构。
参考杨艳敏等[25]的试验方法适当修改。配置1 mg/mL 的蕨菜多糖溶液,将1 mL 多糖溶液与2.5 mL 的800 μmol/L 刚果红溶液(0.02787 g 溶于50 mL)以及0.5 mL 蒸馏水涡旋混匀,然后加入4 mL不同浓度(0、0.1、0.2、0.3、0.4、0.5、0.6、0.7 mol/L)的NaOH 溶液,得到最终浓度为0~0.35 mol/L。然后在200~800 nm 波长下观察最大吸收波长的变化。
1.2.9 碘-碘化钾反应 取2 mL 多糖样品溶液与1.5 mL 碘试剂(含0.02% I2的0.2% KI)混匀,用紫外可见光光度计在300~800 nm 范围内进行波谱扫描[26],确定蕨菜多糖的支链化程度。
1.2.10 抗氧化能力分析
1.2.10.1 DPPH 自由基清除能力 配制质量浓度分别为0.5、1.0、1.5、2.0、2.5 mg/mL 的蕨菜多糖溶液,分别吸取1 mL 蕨菜多糖溶液加入到1 mL 浓度为200 μmol/L 的DPPH-乙醇溶液中。混合均匀后在25 ℃下反应25 min。吸取200 μL 至96 孔板中,在517 nm 处测定吸光度。记录加入蕨菜多糖的吸光度为A1,以无水乙醇代替DPPH 的吸光度为A2,以蒸馏水代替蕨菜多糖溶液的吸光度为A0。按式(1)计算DPPH 自由基清除率[27]。
1.2.10.2 ABTS+自由基清除能力 将7 mmol/L ABTS溶液和2.45 mmol/L 过硫酸钾溶液等体积混合,制成ABTS 母液。室温避光贮藏12~16 h 后,加入无水乙醇稀释,调整到734 nm 处的吸光值为0.7 左右,待用。配制质量浓度分别为0.5、1.0、1.5、2.0、2.5 mg/mL 的蕨菜多糖溶液,吸取100 μL 蕨菜多糖溶液至96 孔板,再加入100 μL 稀释之后的ABTS工作液混合,37 ℃避光条件震荡反应6 min,测定其于734 nm 处吸光值。记录加入蕨菜多糖的吸光度为A1,以无水乙醇代替ABTS 的吸光度为A2,以蒸馏水代替蕨菜多糖溶液的吸光度为A0。按式(2)计算ABTS 自由基清除率[28]。
1.2.10.3 FRAP 还原能力 将乙酸盐缓冲液(0.3 mol/L,pH3.6),TPTZ-盐酸溶液(10 mmol/L)和三氯化铁溶液(20 mmol/L)按10:1:1 均匀混合,制成FRAP 工作溶液,避光贮藏,使用前于37 ℃水浴锅中预热。配制质量浓度分别为0.5、1.0、1.5、2.0、2.5 mg/mL 的蕨菜多糖溶液,吸取100 μL 蕨菜多糖溶液,加入1.2 mL FRAP 工作液,混合均匀于37 ℃下避光孵育4 min。反应结束后,于593 nm 处测定其吸光值。以甲醇为空白对照,Trolox 为标准品以绘制标准曲线,标准曲线回归方程为y=3.5455x+0.087,R²=0.9967[29]。
1.3 数据处理
采用Excel2013 进行统计分析,所有试验数据表示为3 次重复试验的平均值±标准误差;通过IBM SPSS Statistics 22.0 进行单因素分析(ANOVA);采用Origin 2021 软件作图。
2 结果与分析
2.1 蕨菜多糖成分分析
表1是蕨菜多糖的成分组成。由表可知,蕨菜粗多糖的提取率为8.91%,纯化后的总糖含量约为76.95%,未检测到蛋白质成分,少量的总酚(1.03%)和黄酮(1.90%)物质。此外,蕨菜多糖还含有29.26%的糖醛酸成分。

表1 蕨菜多糖成分分析Table 1 Analysis of polysaccharide composition of bracken
2.2 单糖组成
对单糖标准品和蕨菜多糖分别进行分析,结果如图1、2 所示。图1 显示在此条件下单糖标准品分离完全,色谱图结果可信。蕨菜多糖的高效液相色谱如图2 所示。对比图1 可得,蕨菜多糖主要由甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖10 种单糖组成,其摩尔百分比如表2 所示,为9.92:5.34:1.98:11.22:9.66:5.33:19.90:11.43:4.88:20.29。可以看到蕨菜多糖样品中含量最多的单糖为岩藻糖和半乳糖,分别为20.29 mol%和19.90 mol%,其次则是木糖和葡萄糖醛酸,鼠李糖含量最少,为1.98 mol%。在甘露糖和核糖中间出现了一个峰,但未找到与之对应的单糖对照,推测可能为与单糖分子量相近的代谢产物。在居先艳[30]的研究中,发现蕨菜多糖由7 种单糖组成。而在本试验中发现蕨菜多糖由10 种单糖组成,最主要的差别在于本试验中发现蕨菜多糖的单糖组成中含有葡萄糖醛酸与半乳糖醛酸,这可能是蕨菜原料的产地和提取方式不同所导致的[31]。

表2 蕨菜多糖的单糖摩尔比Table 2 Monosaccharide molar ratio of bracken polysaccharide
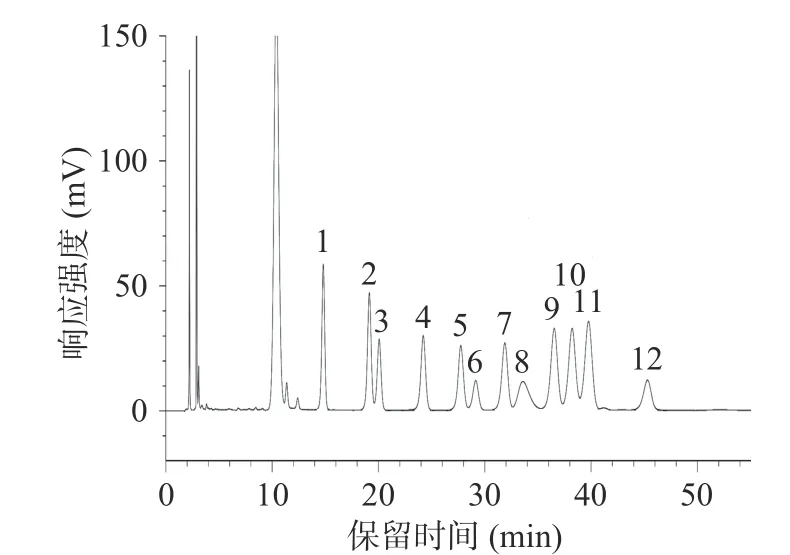
图1 混合标准溶液的HPLC 图Fig.1 HPLC profile of the mixed standard solution
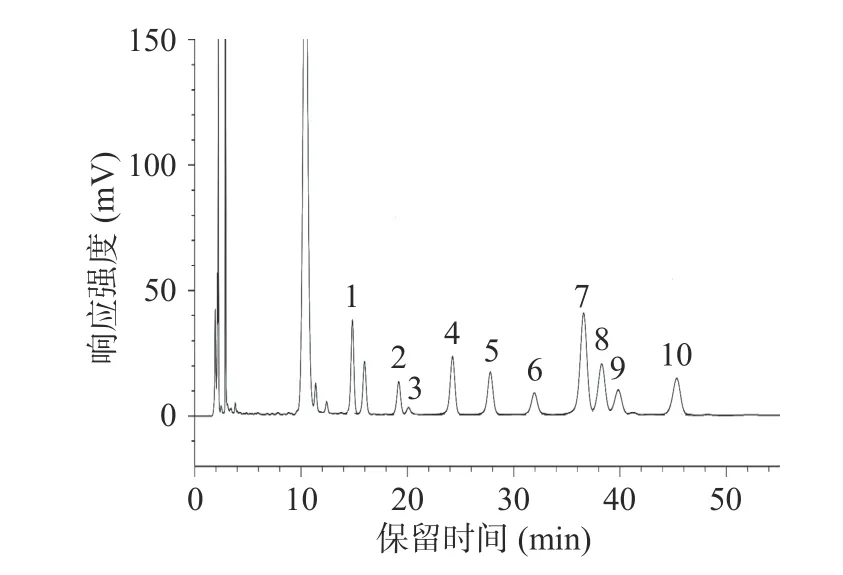
图2 蕨菜多糖溶液的HPLC 图Fig.2 HPLC chart of bracken polysaccharide solution
2.3 多糖分子量分布
对蕨菜多糖样品进行高效液相色谱测定,结果如图3 所示,由结果可得蕨菜多糖只有一个最大吸收峰,保留时间为15.556 min。代入回归方程,可知蕨菜多糖的Mw 约为1.86×104Da。
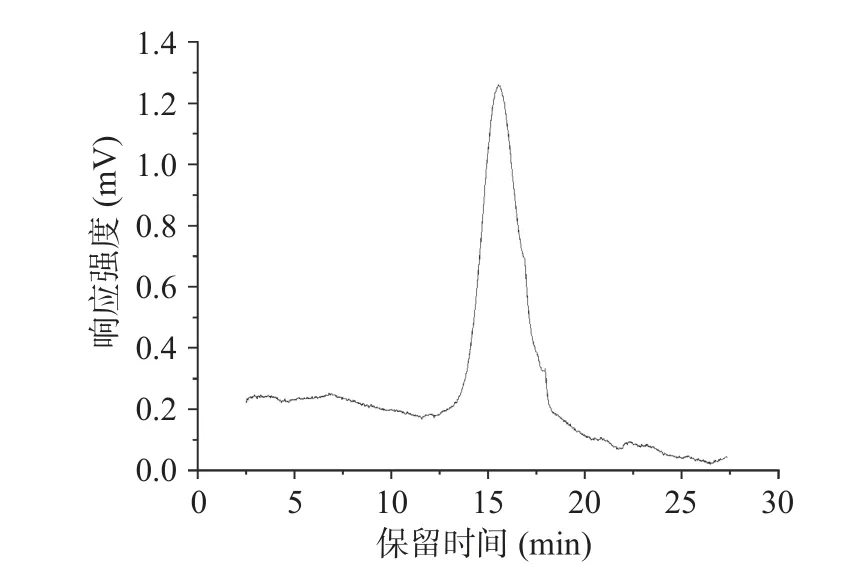
图3 蕨菜多糖溶液的液相色谱图Fig.3 Liquid chromatogram of bracken polysaccharide solution
2.4 红外光谱
图4为蕨菜多糖的傅里叶红外光谱图。由图分析可知,3396.64 cm-1处有一吸收峰,为O-H 的伸缩振动;2922.16 cm-1处的吸收峰为饱和的C-H 伸缩振动;在1643.35、1442.75 和1404.18 cm-1处的几个吸收峰是羰基C=O(-COOH)的伸缩振动,这表明蕨菜多糖中含有糖醛酸,为酸性多糖[32],与化学成分测定的结果相符。在1000~1200 cm-1范围内的吸收峰则显示了C-O-C 和C-O-H 键的存在,这是吡喃糖的特征峰[33]。另外,在806.25 cm-1处的吸收峰是α-吡喃糖的标志,以及619.15 cm-1附近有吸收峰说明含有一定量的β-吡喃糖[34]。由红外光谱可得,蕨菜多糖含有多糖典型的吸收峰,并含有较高的糖醛酸。
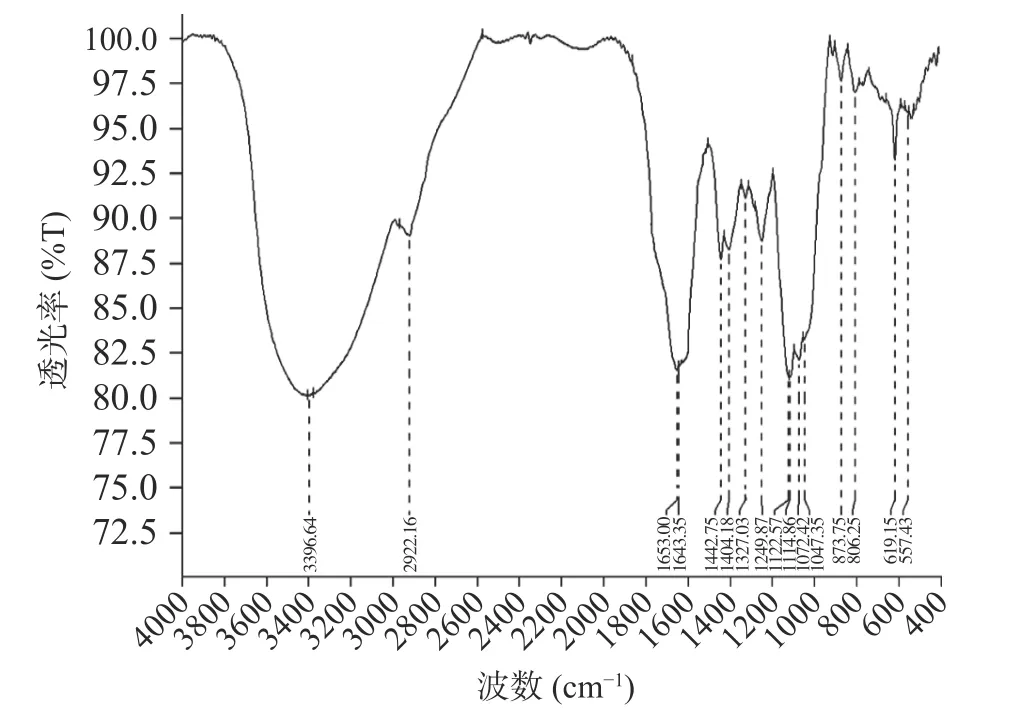
图4 蕨菜多糖的红外光谱图Fig.4 Infrared spectrum of bracken polysaccharide
2.5 紫外光谱
由图5 可以看出,蕨菜多糖在波长260 和280 nm处均无特征峰,表明蕨菜多糖不含核酸和氨基酸成分。
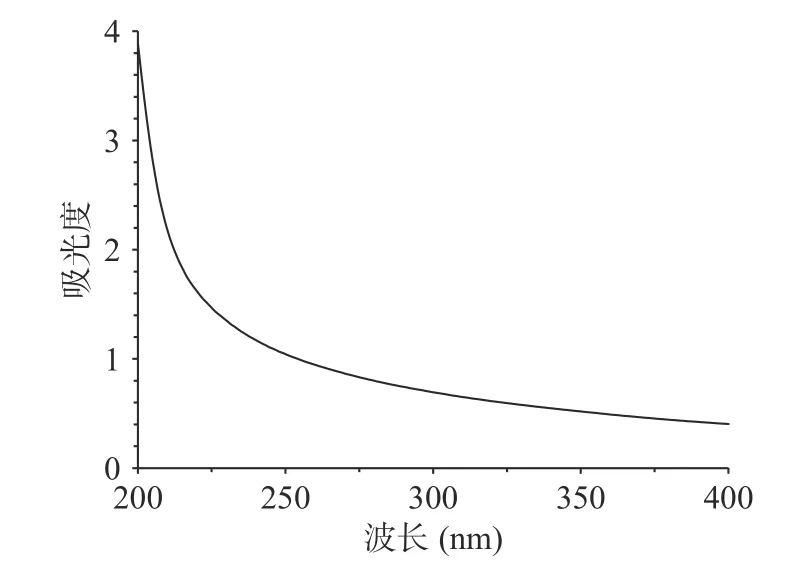
图5 蕨菜多糖的紫外吸收光谱Fig.5 UV absorption spectrum of bracken polysaccharide
2.6 高碘酸氧化
在约72 h 开始,223 nm 下的吸光度开始平稳,说明蕨菜多糖中的糖苷键与高碘酸已经反应完全。带入标准曲线与酸碱滴定的结果,如表3 所示,1 mol 己糖当量的蕨菜多糖消耗了1.34 mol 的NaIO4并产生了0.4806 mol 甲酸。计算可得蕨菜多糖中含有37.88%的非还原端或(1→6)位糖苷键,含48.06%的(1→2)、(1→4)位糖苷键,以及14.06%(1→3)位糖苷键。

表3 高碘酸氧化结果Table 3 The results of periodic acid oxidation
2.7 刚果红试验
蕨菜多糖与刚果红在氢氧化钠溶液中最大波长吸收的变化如图6 所示。在0~0.35 mol/L 的NaOH浓度范围内,加入刚果红染料后的蕨菜多糖溶液最大吸收波长随着NaOH 浓度增加并未发生明显红移,表明蕨菜多糖不存在三股螺旋构象。有研究表明,只有多糖的分子量大于9×104Da,才能形成三螺旋结构[35]。而试验得出,蕨菜多糖的分子量约为1.86×104Da,并且没有三螺旋结构,为上述研究提供了部分佐证。
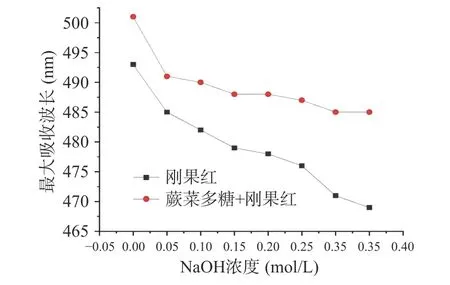
图6 蕨菜多糖与刚果红在不同NaOH 浓度下的最大吸收波长Fig.6 The maximum absorption wavelength of bracken polysaccharide and Congo red at different NaOH concentrations
2.8 碘-碘化钾反应
蕨菜多糖溶液与碘-碘化钾试剂混匀后进行紫外可见光谱扫描,如图7 所示,由图可见,蕨菜多糖与碘-碘化钾试剂的反应物最大吸收峰在349 nm 处,而在565 nm 处无最大吸收峰,说明蕨菜多糖具有复杂的链状结构,其侧链较长、支链较多[36]。
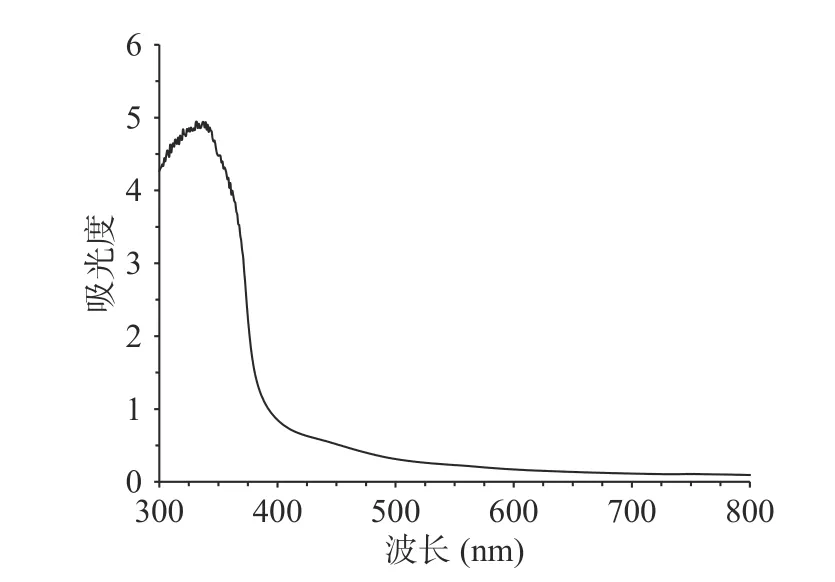
图7 蕨菜多糖的碘-碘化钾反应Fig.7 Iodine-potassium iodide reaction of bracken polysaccharide
2.9 体外抗氧化能力
本实验通过测定对DPPH 自由基清除能力、ABTS+自由基清除能力和FRAP 能力测定了蕨菜多糖的体外抗氧化能力,以Trolox 为阳性对照,结果如图8、图9、图10 所示,蕨菜多糖表现出较强的体外抗氧化能力。在0.5~2.5 mg/mL 浓度范围内,ABTS+自由基清除能力从28.46%增加到92.61%,在浓度达到1.5 mg/mL 时,ABTS+自由基清除能力接近Trolox 阳性对照,而DPPH 自由基清除能力从54.39%增加到70.72%,始终弱于阳性对照。蕨菜多糖的FRAP 能力以Trolox 当量表示,为40.15±1.40 mg/g。
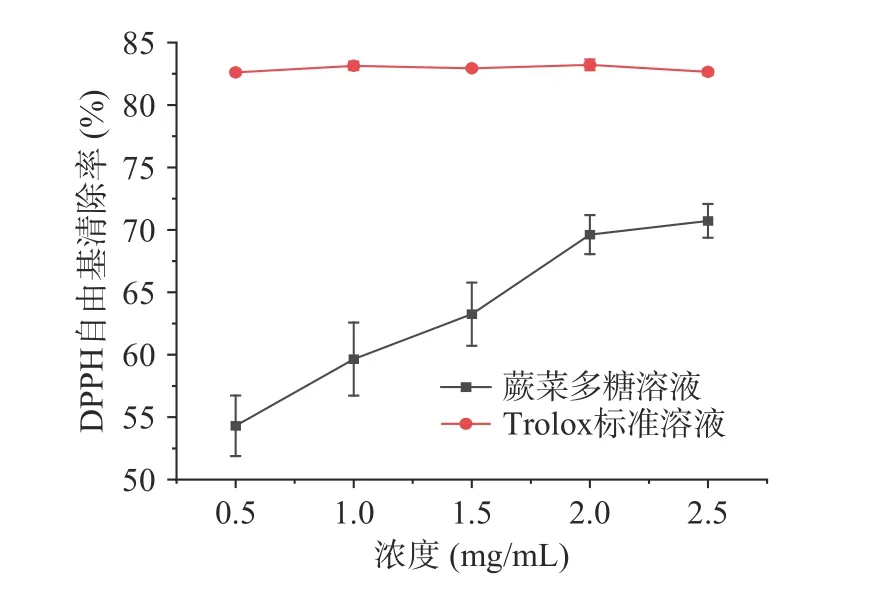
图8 蕨菜多糖对DPPH 自由基的清除率Fig.8 The scavenging rate of bracken polysaccharide on DPPH free radicals
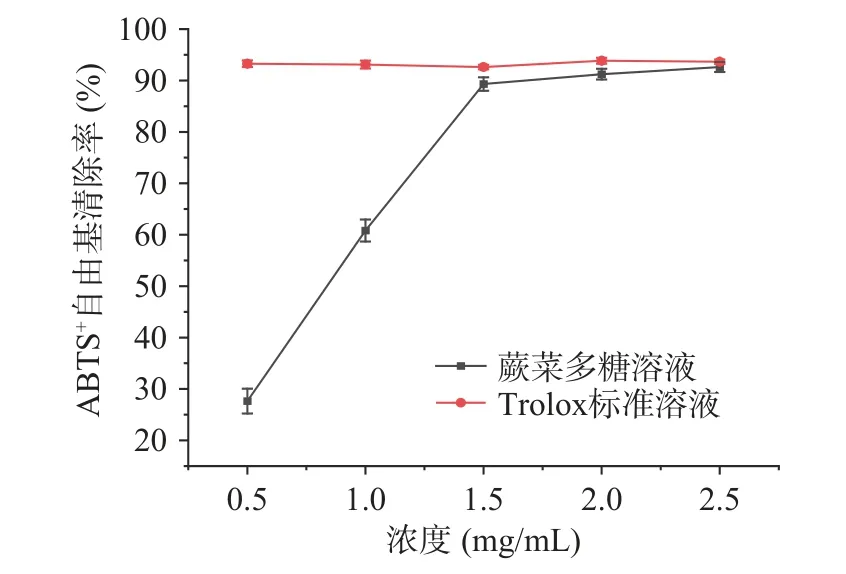
图9 蕨菜多糖对ABTS+自由基的清除能力Fig.9 The scavenging ability of bracken polysaccharide on ABTS+ free radicals
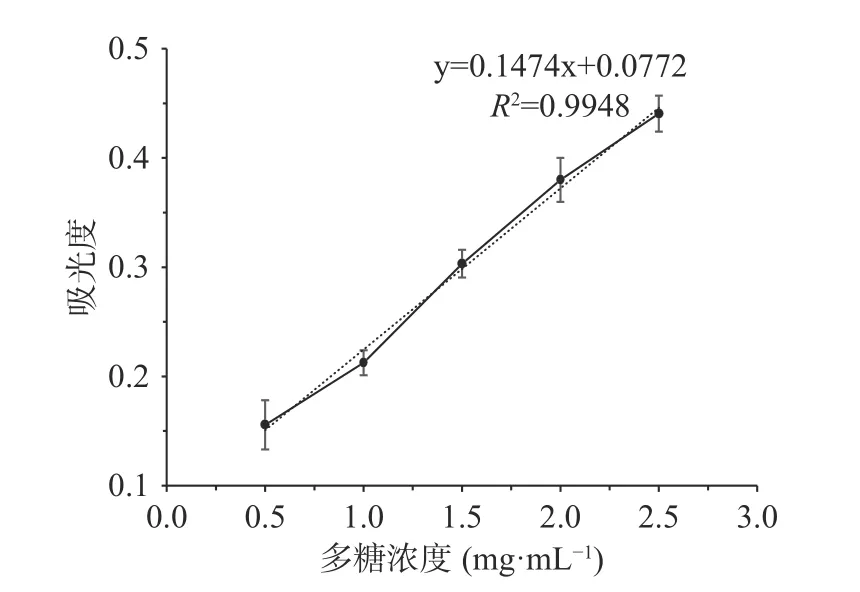
图10 蕨菜多糖的铁离子还原能力Fig.10 FRAP of bracken polysaccharide
3 结论
本试验对蕨菜多糖进行了分离纯化,并对其进行了结构表征和体外抗氧化能力进行了评价。结果表明,蕨菜多糖提取率为8.91%±0.26%,纯化率为76.95%±0.69%,含有少量黄酮(1.03%±0.09%)、多酚(1.90%±0.12%),含有糖醛酸(29.26%±2.64%);蕨菜多糖的Mw 约为1.86×104Da,主要由10 种单糖组成,分别是甘露糖(9.92 mol%)、核糖(5.34 mol%)、鼠李糖(1.98 mol%)、葡萄糖醛酸(11.22 mol%)、半乳糖醛酸(9.66 mol%)、葡萄糖(5.33 mol%)、半乳糖(19.90 mol%)、木糖(11.43 mol%)、阿拉伯糖(4.88 mol%)、岩藻糖(20.29 mol%);含有37.88%的非还原端或(1→6)位糖苷键以及48.06%的(1→2)、(1→2,6)、(1→4)或(1→4,6)位糖苷键;无三股螺旋构象;侧链较长、支链较多,链状结构复杂;蕨菜多糖表现出较强的体外抗氧化能力,当浓度为2.5 mg/mL时,对ABTS+自由基的清除能力最强,清除率可达到92.61%,同时对DPPH 自由基的清除率为70.72%。本文研究结果对蕨菜资源的进一步在医药和功能食品方向上的应用提供依据,也对蕨菜多糖的药理药性研究提供了理论基础。

