以不同嵌段比例mPEG-PLA 为载体制备番茄红素胶束及其对番茄红素各异构体的增溶控释作用研究
李传天,高 鹏,朱金芳, ,刘 婷,马雪红,孙秋菊,麦合丽娅·伊卜拉伊木,陈 丽
(1.新疆农业大学化学化工学院,新疆乌鲁木齐 830052;2.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
番茄红素(Lycopene,LYC)是一种类胡萝卜素,分子式为C40H56[1],相对分子质量为536.85,属于异戊二烯类不饱和烯烃化合物,在甲醇、乙醇等极性溶剂中几乎不溶,但溶于二氯甲烷、乙醚等非极性溶剂[2],其抗氧化活性是α-生育酚的10 倍[3]。LYC 还具有降血脂[4]、防癌抗癌[5]、提高机体免疫力[6]、保护心血管[7]等功能,因而被广泛应用于保健食品及医用药品中。
由于LYC 含有多个不饱和键,导致其具有多种几何异构体[8],而实际上能检测到的主要异构体包括全反式(All-E)和顺式异构体(5Z、9Z、13Z、15Z 等)。LYC 在自然界中主要以全反式构型存在,而人体组织中大部分为顺式构型[9]。LYC 稳定性很差,容易在光、氧、热、酸条件下被氧化降解[10]和发生顺反异构转化[11],进一步影响到LYC 产品的保存和生物利用度,这使其应用受到了很大的限制。研究表明,将LYC 包载于聚合物胶束中,可明显提高LYC 的水溶性、稳定性和生物利用度[10]。
聚合物胶束是指两亲性聚合物在水溶液中自组装形成的具有核壳结构的一种热力学稳定系统,其疏水内核可以装载难溶性药物,提高难溶性药物的水溶性,亲水外壳可保护胶束内部的药物分子不被外界吸附或降解[12]。聚乙二醇单甲醚-聚乳酸(mPEG-PLA)是一种具有良好生物相容性的两亲性聚合物,其中PEG 嵌段无毒、无刺激性,可有效延长被修饰物在体内的半衰期,其性能已得到了美国食品和药物管理局的认可[13];PLA 嵌段毒性低,可生物降解,在体内代谢为二氧化碳和水,不会在体内蓄积[14],近年来mPEGPLA 被广泛用作制备胶束载体。王丽等[15]制备柚皮素-mPEG-PLA 聚合物胶束,考察其体外释放行为,发现同时间点聚合物胶束累积释放度均高于原料,柚皮素-mPEG-PLA 聚合物胶束增加了柚皮素的释放量,改善了其生物利用度。mPEG-PLA 的嵌段组成比例和相对分子质量不同,其对难溶性物质的增溶控释作用也不同[16]。因此选择合适嵌段比例mPEGPLA 包载LYC,可以更好提升其水溶性和生物利用度。鉴于此,本研究以三种不同嵌段比例的mPEGPLA( mPEG45-PLA36、 mPEG114-PLA90、 mPEG114-PLA180)为载体,以脂溶性番茄红素为原料,制备番茄红素胶束(M-LYC),比较三种M-LYC中LYC 各异构体的载药量、包封率、粒径和Zeta 电位。同时测定MLYC 和LYC 原料在pH1.2、pH6.8、pH7.4 条件下各异构体的累积释放百分率,筛选最佳比例mPEG-PLA载体,以期增加LYC 水溶性并提高其生物利用度。
1 材料与方法
1.1 材料与仪器
全反式LYC 对照品(批号:039M4100V,纯度99.5%) Sigma 公司;番茄红素原料(纯度64.88%)
本实验室提取纯化;mPEG45-PLA36、mPEG114-PLA90、mPEG114-PLA180本实验室依据文献方法[17]合成;大豆磷脂 上海太伟药业有限公司;油酸聚乙二醇甘油酯(PEG-OA2) 上海源叶生物科技有限公司;乙腈、甲基叔丁基醚 色谱纯,阿拉丁试剂公司;丙酮 天津市致远化学试剂有限公司;二氯甲烷、磷酸二氢钾 天津永晟精细化工有限公司;氢氧化钠天津市光复科技发展有限公司;三氯甲烷 成都市科隆化学品有限公司;无水乙醚 国药集团化学试剂有限公司;无水乙醇 天津市鑫铂特化工有限公司;所有试剂如未特殊标明均为分析纯;水 蒸馏水。
LC-16 高效液相色谱仪(配有光电二极管阵列检测器和LabSolutions 色谱工作站) 岛津仪器(苏州)有限公司;YMC Carotenoid S-5(4.6 mm×250 mm,5 μm)色谱柱 日本YMC 公司;BSA-124S 型电子天平 赛多利斯科学仪器北京有限公司;90Plus PALS Zeta 电位及粒度分析仪 美国布鲁克海文仪器公司;XHF-DY 型高速分散器 宁波新芝生物科技股份有限公司;RE-52B 旋转蒸发仪 上海亚荣生化仪器厂;ZWF-200D 气浴恒温振荡器 上海智城分析仪器制造有限公司;TG16B 医用离心机 盐城市凯特实验仪器有限公司。
1.2 实验方法
1.2.1 M-LYC 的制备 M-LYC 的制备在本课题组之前研究的基础上稍加修改[10]。分别称取mPEG45-PLA36、mPEG114-PLA90、mPEG114-PLA180各50 mg,每份中加入LYC 原料5 mg,注射级大豆磷脂5 mg,溶于1 mL 二氯甲烷和2 mL 无水乙醚中,同时分别加入0.7 mL 无水乙醇,继续加入9 mL 蒸馏水,用高速剪切机13000 r/min 乳化1 min,迅速转移至旋转蒸发仪中,在35 ℃条件下旋转蒸发除尽有机溶剂,经0.22 μm 微孔滤膜过滤,制得mPEG45-PLA36-MLYC、 mPEG114-PLA90-M-LYC、 mPEG114-PLA180-M-LYC。
1.2.2 LYC 各异构体的含量测定及M-LYC 中LYC的包封率和载药量计算
1.2.2.1 色谱条件 色谱柱:YMC Carotenoid S-5(4.6 mm×250 mm,5 μm);流动相A:乙腈,B:甲基叔丁基醚;线性梯度洗脱:流动相B 在5 min 内由0%增加至40%,5~15 min 由40%增加至50%,15~25 min 由50%增加至60%,25~35 min 内由60%增加至65%,35~40 min 由65%减少至0%,40~45 min保持0%不变;流速:1 mL/min;检测波长:472 nm;PDA 检测器光谱收集范围:200~800 nm;进样量:20 μL;柱温:30 ℃。
1.2.2.2 用于含量测定的全反式LYC 标准曲线绘制
精密称取全反式LYC 对照品1 mg,用三氯甲烷溶解并定容至10 mL,摇匀,即得全反式LYC 对照品储备液。精密吸取一定量的全反式LYC 对照品储备液,置于10 mL 棕色容量瓶中,用丙酮定容,配制成浓度分别为0.52、1.04、1.73、2.08、3.46 和6.93 μg/mL的全反式LYC 对照品溶液,通过HPLC 测定,以对照品浓度为横坐标(x,μg/mL),以峰面积为纵坐标(y),得到标准曲线y=14518x+1370.5(R2=0.9991)。
1.2.2.3 LYC 原料供试液的配制 精密称取LYC原料5 mg,用三氯甲烷溶解,定容至10 mL。精密吸取上述溶液100 μL,置于10 mL 棕色容量瓶中,用丙酮定容,在13000 r/min 条件下离心15 min,即得。
1.2.2.4 M-LYC 供试液的配制 精密量取“1.2.1”项下M-LYC 溶液100 μL,置于10 mL 棕色容量瓶中,加入1 mL 三氯甲烷充分振摇以提取胶束中的LYC,用丙酮定容,在13000 r/min 条件下离心15 min 即得。
1.2.2.5 LYC 原料及M-LYC 中LYC 各异构体的鉴别
参照文献[18-19]的方法,从LYC 原料及M-LYC含量测定HPLC 图中提取各异构体在300~550 nm 特征区域的全波长光谱图,对LYC 各异构体进行定性鉴别,计算其在顺式特征吸收峰(360~362 nm)与最大吸收波长处主吸收峰(472 nm 左右)吸光度的比值,即Q 值。根据单峰保留时间、特征吸收峰位置及Q 值鉴定番茄红素各异构体。
1.2.2.6 LYC 原料及M-LYC 中LYC 各异构体含量的计算 通过标准曲线法计算全反式番茄红素的含量,采用峰面积归一化法计算LYC 各顺式异构体的含量[19-20],各异构体的含量总和为Total LYC 含量。M-LYC 中各异构体包封率和载药量的计算分别按公式(1)、(2)计算M-LYC 中各异构体及Total LYC的包封率(EE)和载药量(DL)。
式中:M1为胶束中测得的各异构体或Total LYC的量;M2为制备过程中加入的原料中含各异构体或Total LYC 的量;M3为制备过程中加入的载体材料、LYC 原料及大豆磷脂的总量。
1.2.3 番茄红素胶束粒径及Zeta 电位的测定 采用动态光散射纳米粒径分析仪测定番茄红素胶束的平均粒径、多分散指数(PDI)和Zeta 电位,测定温度为
25 ℃。
1.2.4 LYC 原料及M-LYC 中LYC 的体外释放度测定
1.2.4.1 不同释放介质的配制 a.含0.1% PEG-OA2的pH6.8 缓冲溶液的配制:按照《中国药典》(2020版)[21]配制pH6.8 的PBS 缓冲液。取250 μL PEGOA2,置于250 mL 容量瓶中,用pH6.8 的PBS 缓冲液定容,摇匀备用。b.含0.1% PEG-OA2的pH7.4 缓冲溶液的配制:按照《中国药典》(2020 版)[21]配制pH7.4 的PBS 缓冲液。取250 μL PEG-OA2,置于250 mL 容量瓶中,用pH7.4 的PBS 缓冲液定容,摇匀备用。c.含0.1% PEG-OA2的pH1.2 溶液的配制:按照《中国药典》(2020 版)[21]配制pH1.2 的PBS 缓冲液。取250 μL PEG-OA2,置于250 mL 容量瓶中,用pH1.2 的PBS 缓冲液定容,摇匀备用。
1.2.4.2 LYC 原料油溶液的配制 称取LYC 原料4 mg,用大豆油溶解并定容至10 mL,摇匀备用。
1.2.4.3 用于释放度测定的全反式LYC 标准曲线绘制 按照“1.2.2.2”的方法,配制浓度分别为0.17、0.35、0.52、0.69、1.04、1.73 μg/mL 的全反式LYC 对照品溶液,通过HPLC 测定,以对照品浓度为横坐标(x,μg/mL),以峰面积为纵坐标(y),得到标准曲线y=15342x+465.53(R2=0.9997)。
1.2.4.4 M-LYC 中LYC 的体外释放度测定 分别精密量取三种mPEG-PLA 材料制备的M-LYC(即mPEG45-PLA36-M-LYC, mPEG114-PLA90-M-LYC,mPEG114-PLA180-M-LYC)和LYC 原料油溶液各1 mL 注入透析袋(MWCO:8000~14000 Da)中,再置于10 mL 释放介质中,在37 ℃,100 r/min 条件下进行体外释放实验。分别于0.5、2、4、6、8、24、48、72 h,取出1 mL 释放液,同时补充1 mL 37 ℃预热的空白释放介质,用丙酮将取出的释放液稀释至一定倍数,在13000 r/min 条件下离心15 min。按“1.2.2”方法测定并计算释放介质中LYC 各异构体的含量,并按公式(3)计算每个时间点的累积释放率。
式中:Qn为第n 个取样点时LYC 的累积释放百分率;C0为LYC 的初始浓度;Cn为第n 个取样点时LYC 的浓度;V0为释放介质体积;V 为每次取样体积;Va为M-LYC 体积。
1.3 数据处理
2 结果与分析
2.1 LYC 各异构体的含量测定及M-LYC 中Total LYC的EE 和DL 计算
2.1.1 LYC 各异构体的鉴别 从全反式LYC 对照品、LYC 原料和M-LYC 的HPLC 色谱图(图1、图2 和图3)中提取各色谱峰最高点处的300~500 nm 波长光谱图,对LYC 各异构体进行定性鉴别。将HPLC色谱图中出现的四个峰按照出峰顺序命名为a、b、c、d 峰。由图1 可以看出,a、b、c、d 四个峰的光谱图在波长400~550 nm 区段的峰形与全反式番茄红素对照品光谱图(图4(5))基本相同,其特征为在472 nm左右均出现了“山字”峰形的主吸收峰,且在472 nm左右有最强吸收峰;图2 和图3 峰c 的光谱图与图4(5)相同,故判断峰c 为全反式LYC;图4(1)(2)(4)不仅在472 nm左右均出现了“山字”峰形的主吸收峰,且在360~362 nm 处均有一个明显的特征吸收峰,依据文献[22]可初步判断其为顺式LYC;通过计算得到峰a、b、d 的Q 值分别为0.53、0.22、0.10,与文献报道13Z、9Z、5Z 的Q 值(0.5、0.2、0.11)基本一致[18-19]。综合光谱图及Q 值结果可以判断HPLC色谱图上的a、b、c、d 峰分别为LYC 异构体13Z、9Z、All-E、5Z 的色谱峰。
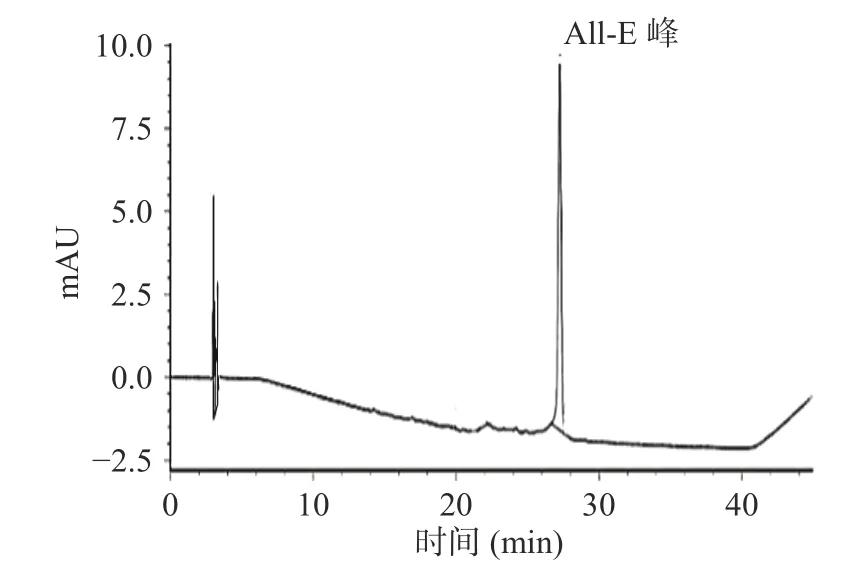
图1 全反式LYC 对照品的HPLC 图谱Fig.1 HPLC spectrum of all-trans LYC control

图2 LYC 原料的HPLC 图谱Fig.2 HPLC spectrum of LYC raw material

图3 M-LYC 的HPLC 图谱Fig.3 HPLC spectrum of M-LYC

图4 峰a(1),b(2),c(3),d(4)和全反式LYC 对照品(5)的光谱图Fig.4 Spectra of peaks a (1), b (2), c (3), d (4) and all-trans LYC control (5)
2.1.2 M-LYC 中LYC 含量测定及LYC 的EE 和DL计算 EE 和DL 是评价纳米胶束包封效果及质量的重要指标,本研究以此为评价指标之一,筛选合适的mPEG-PLA 嵌段比例,分别如表1、表2、表3 所示。在三种材料制备的M-LYC 中各LYC 异构体含量、EE 和DL 差异较大。一般来说,PLA 链分子量越大越易包封LYC[23],因此,mPEG114-PLA90-M-LYC 中各异构体及Total-LYC 的EE 均高于mPEG45-PLA36-M-LYC。但研究发现,拥有最长PLA 链的mPEG114-PLA180-M-LYC 的各异构体及Total-LYC 包封率却最低(23.62%),其原因为过长的PLA 链使其水溶性变差,易发生聚集而沉降,在用微孔滤膜过滤时部分被滤除[24]。综合三种胶束的EE 和DL 值,选择mPEG45-PLA36、mPEG114-PLA90作为包载LYC较佳的嵌段共聚物。另外,在三种胶束中,13Z 的包封率均最低,这可能是由于13Z 旋转障碍小,极易发生异构转化,故在胶束制备过程中发生了异构转化,导致包封率降低,Knockaert 等[25]也发现在一定温度下13Z 的异构转化程度在几种顺式异构体中最高。有研究表明[26]相比于13Z,9Z 需要在更高温度下才能发生异构转化,这是因为9Z 异构转化所需要的能量高于13Z,故三种胶束中9Z 的包封率均高于13Z。5Z 为常见的LYC 中最稳定的顺式异构体[27],在三种胶束中5Z的包封率均高于其他异构体,甚至高于Total-LYC。
表1 mPEG45-PLA36-M-LYC 中各异构体含量和Total-LYC 包封率及载药量(±SD,n=3)Table 1 Content of each isomer in mPEG45-PLA36-M-LYC and Total-LYC encapsulation rate and drug loadin g capacity(±SD, n=3)

表1 mPEG45-PLA36-M-LYC 中各异构体含量和Total-LYC 包封率及载药量(±SD,n=3)Table 1 Content of each isomer in mPEG45-PLA36-M-LYC and Total-LYC encapsulation rate and drug loadin g capacity(±SD, n=3)
?
表2 mPEG114-PLA90-M-LYC 中各异构体含量和Total-LYC 包封率及载药量(±SD,n=3)Table 2 Content of each isomer in mPEG114-PLA90-M-LYC and Total-LYC encapsulation rate and drug loading capacity(±SD, n=3)

表2 mPEG114-PLA90-M-LYC 中各异构体含量和Total-LYC 包封率及载药量(±SD,n=3)Table 2 Content of each isomer in mPEG114-PLA90-M-LYC and Total-LYC encapsulation rate and drug loading capacity(±SD, n=3)
?
表3 mPEG114-PLA180-M-LYC 中各异构体含量和Total-LYC 包封率及载药量(±SD,n=3)Table 3 Content of each isomer in mPEG114-PLA180-M-LYC and Total-LYC encapsulation rate and drug loading capacity(±SD, n=3)

表3 mPEG114-PLA180-M-LYC 中各异构体含量和Total-LYC 包封率及载药量(±SD,n=3)Table 3 Content of each isomer in mPEG114-PLA180-M-LYC and Total-LYC encapsulation rate and drug loading capacity(±SD, n=3)
?
2.2 番茄红素胶束的粒径及Zeta 电位分析
文献报道[28]胶束分子量的大小是影响胶束粒径的主要原因,胶束的分子量越小其粒径则越小。三种胶束的粒径、PDI、Zeta 电位值如表4 所示,可以看出分子量最小的mPEG45-PLA36-M-LYC 粒径最小(164.63 nm),分子量最大的mPEG114-PLA180-M-LYC的粒径最大(210.33 nm),该结果与文献报道[28]一致。三种胶束的PDI 均未超过0.17,说明三种胶束粒径分布均比较集中。一般Zeta 电位的绝对值越大,胶束粒子之间排斥性越强,越不易絮凝,体系越稳定[29],mPEG45-PLA36-M-LYC 的Zeta 电位绝对值最大(15.38 mV),说明其在三种胶束中稳定性最好。
表4 三种胶束的粒径、PDI、Zeta 电位值(±SD,n=3)Table 4 Particle size, PDI, and Zeta potential values of the three micelles (±SD, n=3)

表4 三种胶束的粒径、PDI、Zeta 电位值(±SD,n=3)Table 4 Particle size, PDI, and Zeta potential values of the three micelles (±SD, n=3)
注:同行不同小写字母表示差异显著(P<0.05),表5同。
?
2.3 LYC 原料及M-LYC 中LYC 的体外释放度测定
由于体内生物利用度与体外释放度具有正相关性,本实验以0.1% PEG-OA2的不同pH(1.2、6.8、7.4)溶液作为释放介质,考察LYC 原料和M-LYC 中LYC的体外释放行为。
实验结果显示(图5),LYC 原料在不同释放介质中均未检测到LYC 释放出来,其原因主要为LYC的脂溶性很强,在水性释放介质及体液中很难溶解释放。三种不同嵌段共聚物包载的M-LYC 在含0.1%PEG-OA2的pH1.2 释放介质中,均未检测到LYC 各异构体,分析其原因可能与LYC 在酸性介质中不稳定易被降解有关,这与朱金芳等[10]的研究相符。在含0.1% PEG-OA2的pH6.8 和pH7.4 的释放介质中,LYC原料及三种M-LYC 中Total LYC 的体外累积释放百分率见图5(1)和(2)。结果显示在含0.1% PEG-OA2的两种释放介质中,72 h 累积释放百分率最高的为mPEG45-PLA36-M-LYC,分别为42.35%(pH6.8)、60.82%(pH7.4),这是由于低分子量的mPEG 具有更高的亲水性,即含有mPEG45的胶束比含有mPEG114的胶束亲水性更强,水分子更易渗入胶束内部[30],此外,其粒径最小(164.63 nm),能够与水分子接触充分,因此可以通过溶胀机理释放更多的药物[31]。但在最初24 h,Total LYC 累积释放百分率最高的却为mPEG114-PLA90-M-LYC,分别是19.13%(pH6.8)、22.92%(pH7.4),这可能与其EE 和DL 最高有关。当药物包载量较高时,部分药物会进入疏水端边缘,甚至到疏水端与亲水端交界处,在载体材料溶胀的过程中,这部分药物更易扩散,进而很快地释放出来[32]。Musumeci 等[24]也发现高包封率会导致药物在初始阶段的快速释放。通过比较pH7.4 和pH6.8 条件下三种M-LYC 在72 h 的累积释放百分率发现,pH7.4 条件下的累积释放百分率均高于pH6.8,表明pH7.4 条件更有利于LYC 的释放。《中国药典》(2020 版)中规定药物在微粒制剂中0.5 h 的释放度不得超过40%[21],由图5(1)和(2)可知,三种M-LYC 中Total LYC 在含0.1% PEG-OA2不同pH 的释放介质中0.5 h 的累积释放百分率最高为4.30%,远小于40%,符合此标准规定,说明三种M-LYC 胶束均不存在突释现象。

图5 含0.1% PEG-OA2 的不同释放介质中三种M-LYC 及 LYC 原料中LYC 异构体的体外释放(±SD, n=3)Fig.5 In vitro release of LYC isomers from three M-LYC and LYC feedstocks in different release media containing 0.1% PEG-OA2(±SD, n=3)
在含0.1% PEG-OA2的pH6.8 和pH7.4 的释放介质中,三种M-LYC 中LYC 全反式和5Z 的体外累积释放百分率见图5(3)~(6)。13Z 和9Z 在释放液中均未检出,这可能因为其含量较少且易发生异构转化[25-26]。在含0.1% PEG-OA2的两种释放介质中,All-E 72 h 累积释放百分率比Total LYC 略高。mPEG45-PLA36-M-LYC、mPEG114-PLA90-M-LYC 中5Z 在24 h 后才在释放介质中被检测到,而mPEG114-PLA180-M-LYC 中5Z 在48 h 后才在释放介质中被检测到,这可能是由于5Z 在胶束中的含量较低,那么释放出来的量更低,导致仪器未检出,此外,5Z 拥有更强的疏水性,可能会与载体材料PLA 核心接触更紧密[33],不易释放。而经过72 h 后,5Z 在两种释放介质中的累积释放百分率均高于All-E,这可能是由于载体材料mPEG-PLA 在72 h 后已经充分溶胀,5Z 溶解在渗入胶束核心的溶液中,在浓度梯度的驱使下,穿过溶胀的载体材料释放出来[31],同时也可能与All-E 部分异构化为5Z 有关[11]。
表5 含0.1% PEG-OA2 的不同释放介质中三种M-LYC 及LYC 原料中 LYC 异构体的72 h 累积释放百分率(±SD,n=3)Table 5 Cumulative 72 h release percentages of LYC isomers from three M-LYC and LYC feedstocks in different release media containing 0.1% PEG-OA2 (±SD, n=3)
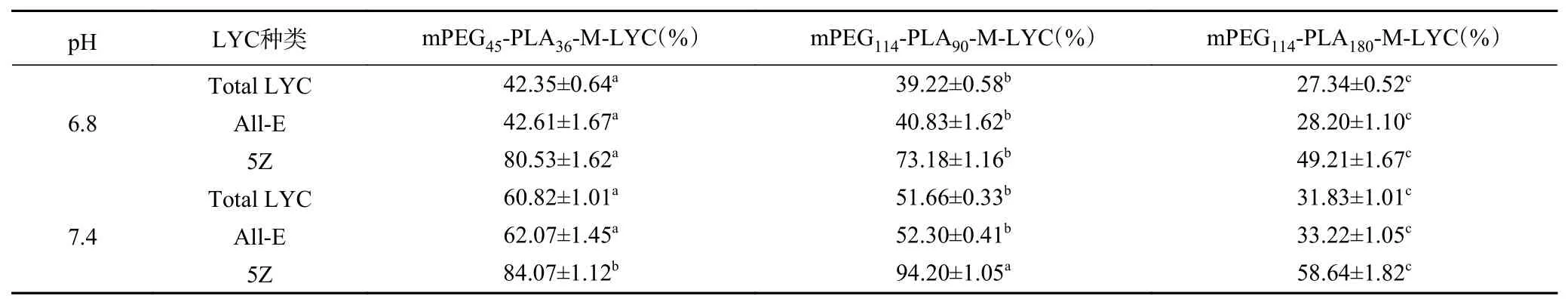
表5 含0.1% PEG-OA2 的不同释放介质中三种M-LYC 及LYC 原料中 LYC 异构体的72 h 累积释放百分率(±SD,n=3)Table 5 Cumulative 72 h release percentages of LYC isomers from three M-LYC and LYC feedstocks in different release media containing 0.1% PEG-OA2 (±SD, n=3)
?
3 讨论与结论
3.1 讨论
本研究采用了乳化-溶剂挥发法制备胶束,故乳化效果的好坏对其胶束的性质有直接的影响,mPEGPLA 既是M-LYC 的载体材料,又可作为非离子型乳化剂使用。但由于乳液中静电液滴排斥力不足,不能有效防止絮凝的发生,导致乳滴发生聚集。Aveyard等[23]研究发现其制备的仅有非离子表面活性剂的O/W 型乳液存在易于絮凝和分层等不稳定现象,在加入阴离子表面活性剂十八烷基硫酸钠或阳离子表面活性剂十八烷基三甲基溴化铵后可有效防止絮凝。因此本研究通过添加少量两性离子型乳化剂大豆磷脂来改善乳化效果,以提高乳液的稳定性。
载体材料的相对分子量大小、亲/疏水链段的比例及M-LYC 各异构体与载体材料的相互作用等因素均可造成三种M-LYC 中各异构体的包封率有所不同;同一载体材料制备的M-LYC 各异构体的包封率也有差异,这是由于在制备过程中溶剂、温度变化等因素可能使LYC 发生异构转化而导致各异构体的包封率产生差异,其包封率大小顺序为5Z>9Z>13Z。Yu 等[27]也发现LYC 易于发生异构转化,且在LYC 的顺式异构体中,5Z 比13Z 和9Z 具有更高的稳定性,相对不易发生异构转化。
LYC 是一种高度疏水性的物质,难溶于胃肠液中,因此人体对摄入的番茄红素利用率很低[34]。通过比较LYC 原料与M-LYC 的体外释放度,证明胶束可以提高LYC 的体外释放度,从而预测其有望提高LYC 的生物利用度,这与Zhao 等[35]的研究相符。同时也发现载体材料的相对分子量大小、亲/疏水链段的比例均会影响LYC 的释放,Sunoqrot 等[36]使用mPEG5K-PLA3K、mPEG5K-PLA7.8K为载体制备槲皮素胶束,结果发现两种胶束具有明显不同的释放速率。也有文献报道,在以不同mPEG-PLA 为载体包载生长激素时,PLA 链段的比例增加会降低生长激素的释放速率[37]。因此,选择合适嵌段比例的聚合物包载LYC 对于LYC 增溶控释作用的发挥至关重要。人体摄入M-LYC 后,通常以被动扩散、胞吞等方式被直接吸收,最后由血液转运到全身器官[38-39]。因此本实验测定了M-LYC 在模拟胃液、肠液、血液环境下(pH1.2、pH6.8、pH7.4)的体外释放度。结果显示三种M-LYC 在pH7.4 环境下更易释放,同时也发现在pH1.2 条件下释放液中未检出LYC,这可能与LYC 在强酸性条件下不稳定易被破坏有关[10],建议将来可将M-LYC 制成肠溶制剂以避免其被胃酸破坏。
3.2 结论
以三种不同嵌段比例的mPEG-PLA 共聚物为载体材料制备了M-LYC,并对番茄红素各异构体的理化性质及其增溶控释作用进行了研究,其中mPEG114-PLA90-M-LYC 中各异构体及Total-LYC 的EE 最高(71.73%),其次为mPEG45-PLA36-M-LYC(65.04%),三种胶束中各顺式异构体包封率大小顺序均为5Z>9Z>13Z;mPEG45-PLA36-M-LYC 粒径最小(164.63 nm)且Zeta 电位绝对值最大(-15.38 mV)。LYC 原料在不同释放介质中均未检测出释放,三种胶束在pH7.4 释放介质中的累积释放百分率均高于pH6.8,且mPEG45-PLA36-M-LYC 的Total LYC 在不同释放介质中72 h 累积释放百分率均最高;三种胶束中全反式番茄红素(All-E)72 h 累积释放百分率比Total LYC 略高,5Z 在初期无释放,经过72 h 后累积释放百分率高于All-E。mPEG45-PLA36-M-LYC表现出良好的增溶效果和体外释放特性,为番茄红素胶束进一步研究提供依据。

