钻地风三萜类化学成分及含量测定研究*
王飘,李思琪,王五兵,李昌芬,张意雪,易志恒,陈凌云
(1.云南中医药大学中药学院,昆明 650500;2.云南省高校外用给药系统与制剂技术研究重点实验室,昆明 650500;3.赛灵药业科技集团股份有限公司,云南玉溪 653100)
钻地风[RubusellipticusSmith.varobcordatus(Franch.) Focke]为蔷薇科悬钩子属植物栽秧泡的干燥根,又名黄锁莓根,彝医称之为“草老奢景”或“高斯诺”,意译为治腰酸腿痛药。产地主要分布于云南、贵州、广西和四川,多生长在海拔300~2700 m的山谷林中、山坡路边或河边灌丛中[1],始载于《滇南本草》,味酸,性温,走经络,舒筋活络,收涩止痢,用于治筋骨疼痛、慢性腹泻、久痢、带下及黄水疮。
钻地风中主要含有三萜类[2-3]及异黄酮类化合物[4],相关文献较少且年份久远。在《云南省中药材标准》(2005年版)及《贵州省中药材、民族药材质量标准》(2003年版)中有记载钻地风质量标准[5-6],前者鉴别项下采用钻地风对照药材作为对照进行薄层鉴别,后者仅对其进行显微鉴别,均难以评价钻地风内在质量。因此,需进一步探索钻地风的化学组成,以期寻找有效活性成分,进行含量比较选择合适的质控指标,为完善钻地风药材质量标准提供试验依据,有利于其资源更好开发及利用。
1 仪器与试药
Agilent 1100 高效液相色谱仪,配有DAD型检测器(美国 Agilent 公司);AvanceIII600 MHz超导磁共振仪(瑞士布鲁克公司);电子分析天平[奥豪斯仪器(常州)有限公司,感量:0.1 mg];AB265-S电子分析天平(瑞士梅特勒-托利多公司,感量:0.01 mg);SK2200HP超声仪(上海科导超声仪器有限公司);柱色谱硅胶(200~300目筛,青岛海洋化工厂);MCI小孔树脂(MCI-gel CHO-20P,日本三菱公司);LH-20羟丙基葡聚糖凝胶(Sephadex LH-20,Pharmacia公司);所用试剂均为分析纯或色谱纯,水为娃哈哈纯净水。
分离所用钻地风于2019年7月采集在罗平,其余钻地风购于药材市场,产地分别为峨山、曲靖、红河、普洱,经云南中医药大学钱子刚教授鉴定为钻地风RubusellipticusSmith.varobcordatus(Franch.) Focke的干燥根,标本保存于云南中医药大学中药学院 (F-201907125)。
2 方法与结果
2.1化学成分研究
2.1.1提取与分离 干燥的钻地风(1.5 kg)粉碎,用三氯甲烷-甲醇(1:1)混合溶剂常温浸提,减压浓缩得浸膏,加水混悬后依次用石油醚、乙酸乙酯各萃取3次,回收各部分溶剂。取乙酸乙酯部位经MCI柱层析,以20%,60%,80%甲醇溶液和丙酮溶液进行梯度洗脱。80%甲醇部位经硅胶柱层析,以石油醚-丙酮梯度洗脱,再经环己烷-丙酮(3.5:1~1:1)梯度洗脱得组分A1~6,其中A3经葡聚糖凝胶柱纯化,以三氯甲烷-甲醇(1:1)等度洗脱,重结晶得到化合物1(584 mg)。
其余组分剩余量较少,难以继续分离,因此另取干燥的钻地风5 kg,用三氯甲烷-甲醇(1:1)混合溶剂常温浸提2次,每次5 d,再用乙醇浸提2次,每次3 d,合并减压浓缩得浸膏。浸膏经大孔树脂层析,以水、30%、70%、100%甲醇及乙酸乙酯梯度洗,70%甲醇部位(95 g)经硅胶柱层析,以三氯甲烷-甲醇(12:1~6:1)梯度洗脱得组分B1~4。
组分B2经硅胶柱层析,以三氯甲烷-甲醇(8:1~6:1)梯度洗脱,再经三氯甲烷-乙酸乙酯(5:1~2:1)梯度洗脱得组分B2.1~2.4,其中B2.3重结晶得化合物3(2.251 g)。
组分B4经硅胶柱层析,以二氯甲烷-甲醇(10:1~4:1)进行梯度洗脱,再以三氯甲烷-甲醇梯度洗脱,得组分B4.1~4.3,其中B4.2经葡聚糖凝胶柱纯化,以三氯甲烷-甲醇(1:1)等度洗脱,重结晶得化合物2(118.3 mg)。
组分B4.1经制备HPLC(C18,205 nm,65%乙腈,3 mL·min-1)纯化得到化合物4(17.5 mg)、化合物5(16.1 mg)和化合物6(9.5 mg)。化合物1~5经液相面积归一化法计算纯度分别为99.0%,99.2%,98.5%,98.1%,98.3%。
2.1.2结构鉴定
①化合物1:白色粉末。1H-NMR(500 MHz,DMSO-d6)δ:0.89(3H,s,H23),0.69(3H,s,H24),0.79(3H,s,H25),1.29(3H,s,H27),1.08(3H,s,H29),0.84(3H,d,J=6.5Hz,H30),3.17(1H,s,H18),3.78(1H,d,J=2.0,Hz,H3),4.13(1H,brs,H2),5.73(1H,brs,H12);13CNMR(125 MHz,DMSOd6)δ:41.41(C1),64.71(C2),77.93(C3),38.02(C4),47.68(C5),18.54(C6),32.49(C7),39.06(C8),46.56(C9),37.82(C10),23.18(C11),126.81(C12),138.67(C13),41.6(C14),28.89(C15),25.17(C16),46.91(C17),53.21(C18),71.67(C19),41.2(C20),25.9(C21),37.28(C22),28.15(C23),21.86(C24),16.3(C25),16.67(C26),24.09(C27),179.66(C28),26.42(C29),16.13(C30)。以上数据与文献[7]报道基本一致,故鉴定该化合物为蔷薇酸。
②化合物2:白色粉末。1H-NMR(400 MHz,CD3OD)δ:5.35(1H,d,J=8.0 Hz,H1′),5.33(1H,brs,H12),2.54(1H,s,H18),2.64(1H,m,H3),1.36(3H,s,H27),1.23(3H,s,H29),1.01(3H,d,H25),1.00(3H,d,H23),0.95(3H,d,J=6.4 Hz,H30),0.89(3H,s,H26),0.79(3H,s,H24);13CNMR(CD3OD,100 MHz)δ:42.9(C1),67.3(C2),80.3(C3),39.6(C4),49.0(C5),22.6(C6),34.2(C7),41.6(C8),48.4(C9),39.5(C10),24.9(C11),129.8(C12),139.8(C13),42.7(C14),29.8(C15),26.7(C16),48.5(C17),55.1(C18),73.8(C19),43.0(C20 ),27.3(C21),38.4(C22),29.4(C23),16.8(C24),17.1(C25),19.4(C26),24.9(C27),178.7(C28),27.2(C29),17.8(C30),95.9(C1′),74.0(C2′),78.7(C3′),71.3(C4′),78.4(C5′),62.6(C6′)。以上数据与文献[8]报道基本一致,故鉴定该化合物为刺梨苷(kaiiichigeside F1)。
③化合物3:白色粉末。1H-NMR(400 HMz,CD3OD)δ:1.36(3H,s,H27),1.23(3H,s,H29)1.06(3H,s,H25),0,95(3H,d,J=8 Hz,H30),0.80(3H,s,H26),0.72(3H,s,H24),5.33(1H,overlapped,H12),5.35(1H,s,H28);13CNMR(400MHz,CD3OD)δ:48.12(C1),69.87(C2),78.47(C3),44.26(C4),49.5(C5),19.4(C6),33.69(C7),41.43(C8),47.94(C9),39.15(C10),24.89(C11),129.67(C12),139.87(C13),42.95(C14),29.78(C15),26.69(C16),47.29(C17),55.12(C18),74.02(C19),43.08(C20),27.36(C21),38.45(C22),66.69(C23),14.0(C24),17.84(C25),17.76(C26),24.96(C27),178.7(C28),27.24(C29),16.74(C30),95.94(C1′),78.3(C2′),78.55(C3′),71.23(C4′),78.55(C5′),62.63(C6′)。以上数据与文献[9]报道基本一致,故鉴定该化合物为苦莓苷F1。
④化合物4:白色粉末。1H-NMR(600 MHz,MeOD)δ:5.32(s,1H,H1′),5.30(s,1H,H12),3.80(s,1H,H6′),3.78(s,1H,H3),3.67(dd,J=12.0,4.6 Hz,2H,H23),3.53(s,1H,H5′),3.51(s,1H,H4′),2.60(td,J=13.3,4.1 Hz,2H,H16),2.50(s,1H,H18),1.33(s,3H,H27),1.19(s,3H,H29),0.97(s,3H,H25),0.92(d,J=6.6 Hz,3H,H30),0.77(s,3H,H26),0.70(s,3H,H24);13C-NMR(151 MHz,MeOD)δ:178.71(C28),139.79(C13),129.83(C12),95.94(C1′),78.74(C5′),78.46(C3′),74.21(C3),74.01(C2′),73.79(C19),71.27(C4′),67.62(C23),62.57(C6′),55.13(C18),50.00(C5),48.98(C17),48.66(C9),43.43(C20),43.10(C14),42.86(C8),41.36(C4),39.72(C1),38.48(C10),38.02(C22),33.80(C7),29.83(C15),27.60(C21),27.37(C2),27.21(C29),26.68(C16),24.85(C27),19.43(C6),17.79(C26),16.75(C25),16.48(C30),12.87(C24)。以上数据与文献[10]报道基本一致,故鉴定该化合物为rotundic acid-28-O-β-D-glucopyranosyl ester。
⑤化合物5:白色粉末。1HNMR(600 MHz,MeOD)δ:5.35(s,1H,H1′),5.33(s,1H,H12),3.80(s,1H,H2)2.93(d,J=9.5 Hz,1H,H3),2.54(s,1H,H18),1.35(s,3H),1.22(s,3H),1.03(s,6H),0.95(d,J=6.7 Hz,3H),0.83(s,3H),0.80(s,3H);13CNMR(151 MHz,MeOD)δ:178.67(C28),139.86(C13),129.66(C12),95.93(C1′),84.69(C3),78.76(C5′),78.47(C3′),74.01(C2′),73.77(C19),71.20(C4′),69.68(C2),62.56(C6′),56.85(C5),55.11(C18),43.10(C14),42.84(C20),41.43(C8),40.66(C10),39.34(C4),38.46(C22),34.22(C7),29.79(C15),29.45(C23),27.37(C21),27.20(C29),26.65(C16),24.93(C27),24.81(C11),19.84(C6),17.77(C25),17.61(C24),17.29(C26),16.75(C30)。以上数据与文献[11]报道基本一致,故鉴定该化合物为rosamultin。
⑥化合物6:白色粉末。1HNMR(600 MHz,MeOD)δ:5.39(s,1H,H1′),5.37(s,1H,H12),3.80(s,1H,H6′),3.78(s,1H,H2),3.51(s,1H,H23),3.49(s,1H,),3.34(s,6H),1.74(s,3H,H25),1.10(s,3H,H30),1.08(s,3H,H29),1.00(s,3H,H24),0.92(s,3H,H26),0.69(s,3H,H27);13C-NMR(150 MHz,MeOD)δ:176.73(C28),139.81(C13),137.76(C19),134.16(C18),127.66(C12),95.90(C1′),78.81(C3′),78.53(C5′),78.32(C3),74.16(C2′),71.34(C4′),69.94(C2),66.44(C23),62.68(C6′),50.95(C1),50.00(C17),48.65(C5),48.55(C9),45.98(C14),44.30(C4),40.46(C8),39.10(C10),35.96(C16),35.78(C20),35.34(C7),31.72(C22),29.85(C15),27.60(C21),24.46(C11),22.52(C29),19.92(C27),19.12(C25),18.93(C26),18.50(C30),14.18(C24)。以上数据与文献[12]报道基本一致,故鉴定该化合物为2α,3β,23-trihydroxyurs-12,18-dien-28-oic acid 28-O-β-D-glucopyranoside。
2.2HPLC含量测定
2.2.1对照品溶液的制备 分别精密称取化合物1~5,加甲醇使溶解,制成含蔷薇酸、刺梨苷、苦莓苷、rotundic acid-28-O-β-D-glucopyranosyl ester、rosamultin浓度分别为0.660 0,0.345 0,0.397 5,0.180 0,0.195 0 mg·mL-1的混合对照品溶液。
2.2.2供试品溶液的制备 取钻地风粉末(过60目筛)约1 g,精密称定,置锥形瓶中,加入甲醇-三氯甲烷(1:1)溶液25 mL,超声提取30 min,滤过,滤液蒸至近干,加甲醇溶解 并定容至5 mL。
2.2.3色谱条件 色谱柱:C18(250 mm×4.6 mm,5 μm);流动相为乙腈(A):0.1%磷酸溶液(B)(0~13 min:20%→25%A;13~20 min:25%→32%A;20~30 min:32%→35%A;30~40 min:35%→48%A;40~50 min:48%→50%A;50~70 min:50%→95%A);柱温:25 ℃;检测波长:203 nm;流速:1 mL·min-1,理论塔板数以蔷薇酸计不低于7 000。色谱图见图1。
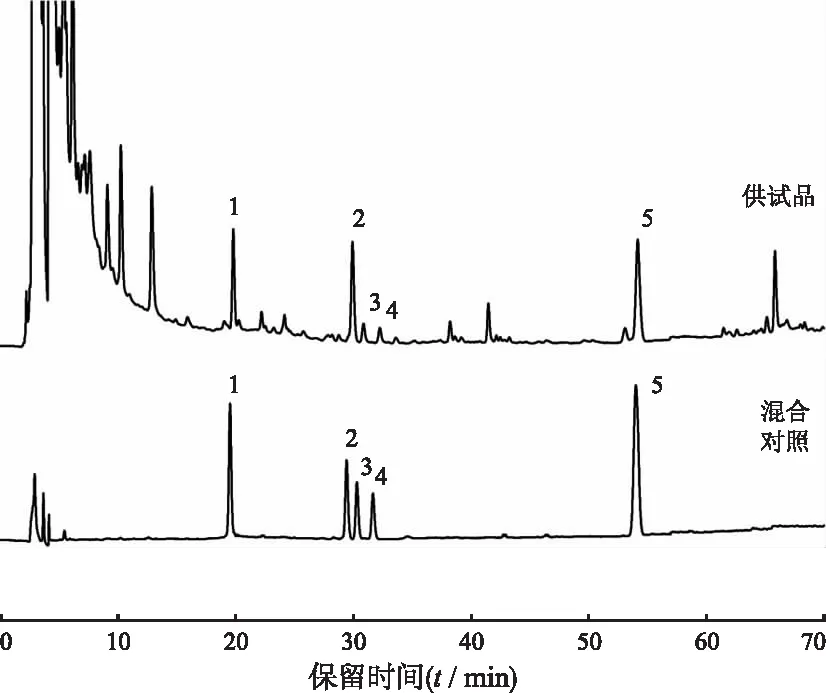
1.苦莓苷;2.刺梨苷;3.rosamultin;4.rotundic acid-28-O-β-D-glucopyranosyl ester;5.蔷薇酸。
2.2.4线性关系及范围考察 取化合物1~5,制成系列梯度浓度,按“2.2.3”项下色谱条件进行测定,以峰面积(Y)为纵坐标,浓度(X)为横坐标进行线性回归。结果见表1。
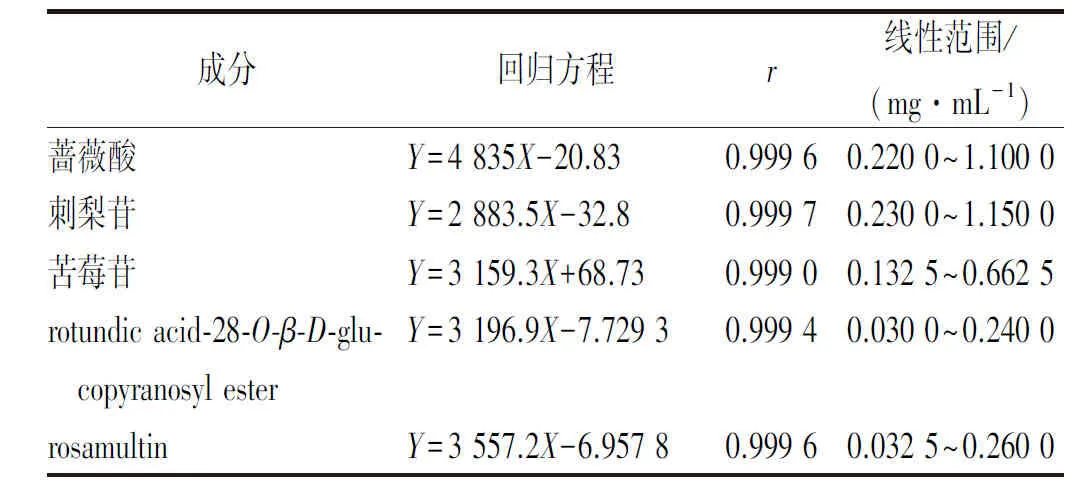
表1 5种成分线性关系及范围
2.2.5仪器精密度实验 取“2.2.1”项下的混合对照品溶液重复进样6次,按“2.2.3”项下方法进行测定。结果化合物1~5的RSD值分别为 1.2%,1.1%,1.3%,2.1%,1.8%,满足含量测定的要求。
2.2.6稳定性实验 取“2.2.2”项下供试品溶液,按“2.2.3”项下方法,分别在0,2,4,8,12 h测定化合物1~5的峰面积,结果化合物1~5的RSD分别为2.1%、1.8%、2.1%、2.4%、2.5%,表明供试品溶液中5个成分在12 h内较稳定。
2.2.7重复性实验 取6份钻地风粉末,按“2.2.2”项下方法,重复测定5个成分含量,得化合物1~5平均含量分别为2.570 3,4.283 9,2.855 2,0.244 3,0.638 4 mg·g-1,RSD分别为2.1%、2.2%、2.8%、3.0%、2.9%。
2.2.8准确度实验 取已知含量的钻地风粉末6份各0.5 g,精密称定,加入适量对照品,平行制备6份供试品溶液,进样测定后计算样品的回收率。5种成分的回收率与RSD结果如表2所示。照分析方法验证指导原则(《中华人民共和国药典》2020年版四部通则9101),含量较低的组分回收率可适当放宽,待测成分含量小于10 mg·g-1的回收率限度为90%~108%,小于1 mg·g-1的回收率限度为85%~110%,结果显示符合回收率符合限度标准。
2.2.9样品含量测定 取不同产地的钻地风粉末,按照“2.2.2”项下方法分别制备供试品溶液,按照“2.2.3”项色谱条件进样测定,结果见表3。
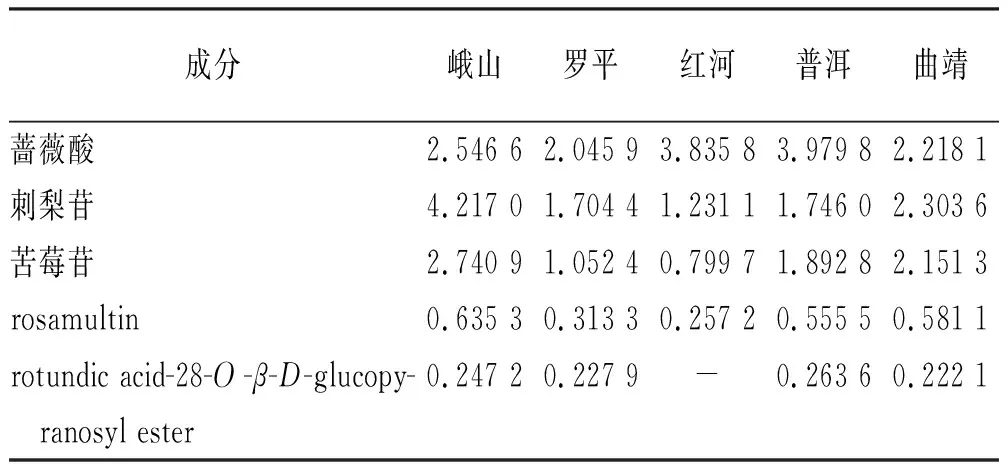
表3 各成分含量测定结果
3 讨论
本实验从钻地风中分离出6个成分,分别是蔷薇酸(1)、刺梨苷(2)、苦莓苷(3)、rotundic acid-28-O-β-D-glucopyranosyl ester(4)、rosamultin(5)、2α,3β,23-trihydroxyurs-12,18-dien-28-oic acid 28-O-β-D-glucopyranoside(6),其中rotundic acid-28-O-β-D-glucopyranosyl ester为首次从该植物中分离得到。现代研究表明,三萜类成分大多具有抗氧化、抗炎抗菌等活性[13-15],蔷薇酸抗炎镇痛作用显著,且具有降血糖活性[16];苦莓苷镇痛作用优于传统镇痛药物阿司匹林和对乙酰氨基酚,在体外显示明显的抗肿瘤活性,还可抗风湿和抗顺铂诱发的肾毒性[17-19]。
为确定各化合物在钻地风中的含量,使用HPLC-DAD进行含量测定。6个成分均属于乌苏烷型三萜化合物,采用全波长进行扫描,选取203 nm为检测波长;流动相考察了甲醇-水、乙腈-水和乙腈-磷酸溶液对分析结果的影响,结果显示在乙腈-0.1%磷酸溶液梯度洗脱下,基线平稳且各目标峰分离度较好。6个成分中化合物6含量过低未达到基线分离,因此仅建立化合物1~5的含量测定方法。含量测定结果显示,各个产地的钻地风中蔷薇酸、刺梨苷、苦莓苷含量占比较高,蔷薇酸含量最高的产区为普洱,刺梨苷和苦莓苷含量最高的为峨山。不同产地的钻地风成分含量差异较大,可能与采集时间、土壤和气候等因素有关。本研究分离得到的6个成分以及所建立的含量测定可为钻地风及其相关制剂的开发应用和质量控制提供依据。

