抗帕金森病药物的治疗评价与新药研究进展*
徐雅楠,赵志刚
(首都医科大学附属北京天坛医院药学部,北京 100070)
帕金森病(Parkinson's disease,PD)是一种常见的中老年神经系统退行性疾病,以黑质多巴胺能神经元进行性退变和路易小体形成为主要病理变化,以纹状体区多巴胺递质减少、多巴胺与乙酰胆碱递质失平衡为主要生化改变,以震颤、肌强直、动作迟缓、姿势平衡障碍的运动症状和睡眠障碍、嗅觉障碍、自主神经功能障碍、认知和精神障碍等非运动症状的临床表现为显著特征。PD患者确诊时约有高达60%的多巴胺能神经元已发生退变[1],但具体发病机制仍不明确,线粒体功能障碍、内质网应激、神经炎症、基因突变、肠道菌群均发现与PD关系密切[2]。作为一种发病机制尚无定论的疾病,当前只能使用药物对症治疗,无法阻止或逆转疾病的发展,这是当前PD治疗药物研究面临的最大问题和挑战。
1 PD治疗药物评价
多巴胺能系统是治疗PD的药物主要作用靶点,通过补充中枢多巴胺递质、兴奋中枢多巴胺受体、抑制中枢多巴胺的分解等方式,缓解因多巴胺能神经元退行性改变造成的不良影响。治疗药物可以分为多巴胺前体、多巴胺受体激动剂(dopamine receptor agonists,DAs)、选择性单胺氧化酶B抑制剂(monoamine oxidase B inhibitor,MAO-BI)、外周儿茶酚胺-O-甲基转移酶抑制剂(catechol-O-methyltransferase,COMTI)等。其他靶点作用药物还有抗胆碱能药和金刚烷胺[3-6]。目前我国上市的可用于治疗PD的药物见表1。根据国内外最新循证及临床研究,现从药物的作用特点、有效性及安全性角度,对我国使用的PD治疗药物做一简要评价。

表1 中国大陆已上市的PD治疗药物
1.1左旋多巴 左旋多巴是多巴胺的前体物质,本身并无药理活性,但它可通过血脑屏障,在中枢系统经多巴脱羧酶转化为多巴胺,补充相对减少的多巴胺,改善PD症状,是治疗PD的基础药物。但是随着疾病进展和药物的长期使用,患者易出现运动并发症,包括左旋多巴引起的异动症(levodopa-induced dyskinesia,LID)和症状波动。深入研究发现,左旋多巴本身不会引起异动症,是药物对多巴胺受体的脉冲式刺激、5-羟色胺能神经元中的非生理性左旋多巴向多巴胺的转化、皮质-纹状体谷氨酸能传递的过度活跃以及多巴胺释放轴突上烟碱乙酰胆碱受体的过度刺激共同作用导致异动症的发生[7]。
ZHOU等[8]对左旋多巴与运动并发症的关系进行了系统评价,结果显示左旋多巴的初始剂量、每千克体质量使用的左旋多巴剂量、左旋多巴累积剂量及左旋多巴累积等效剂量是诱发运动并发症的独立危险因素,而左旋多巴的初始治疗时间与运动并发症无关。因此我国指南建议左旋多巴应在满足症状控制的前提下,尽可能选择最低的有效剂量,或在使用小剂量左旋多巴基础上加用DAs、MAO-BI或COMTI,或直接选择其他药物。
1.2外周多巴脱羧酶抑制剂 外周多巴脱羧酶抑制剂单用不具有治疗效果,必须与左旋多巴一起使用。我国上市的两种含外周多巴脱羧酶抑制剂的药物是多巴丝肼(左旋多巴+苄丝肼)和卡左双多巴(左旋多巴+卡比多巴)。前体药物左旋多巴通过血脑屏障进入中枢,经多巴脱羧酶的作用转化为多巴胺。为防止左旋多巴在外周提前脱羧生成多巴胺产生不良反应,因此将左旋多巴与外周多巴脱羧酶抑制剂联用。外周多巴脱羧酶抑制剂不能透过血脑屏障,仅在外周产生抑制作用,可使循环中左旋多巴增加,从而使中枢左旋多巴增加,同时减少左旋多巴的给药剂量。
多巴丝肼和卡左双多巴具有和左旋多巴相同的问题,药物对多巴胺能间断的脉冲式刺激容易导致LID[7],为解决这一问题,国外研制了一种新制剂——左旋多巴-卡比多巴肠凝胶(levodopa-carbidopa intestinal gel,LCIG),该药主要用于进展性晚期PD,通过经皮内镜胃造口术十二指肠置管利用CADD Duodopa泵将LCIG持续定向泵入小肠上段或上段空肠,保持血药浓度稳定,减轻药物对多巴胺能系统的阶段性刺激。系统评价显示,LCIG可显著减少无LID患者的“关”期时间,增加“开”期时间。但是,在已经出现LID的患者中,LCIG对增加“开”期时间、改善统一帕金森病评定量表(UPDRS)得分、改善帕金森Hoehn-Yahr分级评估和PD患者生活质量问卷得分上的疗效有限[9]。LCIG持续给药对无LID的患者来说是一个可以考虑的治疗策略,不过还需扩大人群、增加样本量来证实其疗效和安全性。LCIG目前在中国、美国等地暂未批准上市。
1.3DAs DAs分为麦角类和非麦角类激动剂,能兴奋多巴胺受体,减轻PD患者症状。DAs可单独使用,也可作为左旋多巴治疗方案的添加药物,改善运动并发症。我国上市的麦角类激动剂是溴隐亭,非麦角类药物有普拉克索、罗匹尼罗、罗替高汀、吡贝地尔和阿扑吗啡等。
麦角类药物问世时间最早,但由于可能引起瓣膜病变等严重不良反应,临床已不主张使用,多选择非麦角类DAs。不过由于溴隐亭的价格较低,有时考虑到经济因素,患者会自愿选择溴隐亭治疗PD。
非麦角类DAs与左旋多巴治疗的受试者相比,接受DAs单独治疗的受试者出现运动并发症可能性更小。但是非运动相关的副作用,如水肿、嗜睡、便秘、头晕、幻觉、恶心等不良反应发生率增加[10]。若DAs与左旋多巴联用,与安慰药组相比,可显著减少左旋多巴引起的“关”期发作时间[-1.05 h·d-1,95%CI=(-1.19,-0.90);P<0.000 01]和所需左旋多巴剂量[-55.65 mg·d-1,95%CI=(-62.67,-48.62);P<0.000 01],并显著改善患者UPDRS Ⅱ、Ⅲ部分得分与总分,但非运动症状的不良反应发生率增加[11]。最新研究还发现[12],除了抗PD作用,普拉克索还具有多巴胺能神经元保护作用,可避免因缺血或甲基苯异丙胺神经毒性带来的神经元退化,但该作用需要在人体中进一步验证。
1.4单胺氧化酶B抑制剂 MAO-BI包括第1代的司来吉兰和第2代的雷沙吉兰,其可通过抑制多巴胺的降解弥补中枢多巴胺的不足。司来吉兰和雷沙吉兰单药治疗PD时,患者的Hoehn-Yahr评分和UPDRSⅢ评分没有显著差异,二者在控制运动症状方面具有相同的疗效,而当MAO-BI和左旋多巴联合使用时,与安慰药相比,司来吉兰更加有效[13]。有临床研究显示这两种药具有疾病修饰作用[14],但是尚缺乏循证医学证据。
美国食品药品管理局(FDA)在2017年批准了沙芬酰胺用于治疗PD开关现象中“关”期的发作。沙芬酰胺的系统评价结果显示,与安慰药组相比,接受沙芬酰胺治疗的PD患者“关”期时间缩短[MD=-0.72 h,95%CI=(-0.89,-0.56)],非异动症发作的“开”期时间[MD=0.71 h,95%CI=(0.52,0.90)]增加,UPDRS Ⅲ 运动功能评分降低[平均差-1.83,95%CI=(-2.43,-1.23)],但该药物引起的不良反应多于对照组[15]。当前缺少不同剂量沙芬酰胺的随机对照试验,其疗效和安全性有待更多试验来证明。
还有一种新药唑尼沙胺,当前作为抗癫痫药使用。在偶然情况下,有学者发现其在患有PD的癫痫患者中,唑尼沙胺对PD也有治疗效果,随后展开了针对PD的临床试验。随机对照试验结果显示[16],唑尼沙胺是治疗PD的一种安全有效的附加疗法。最有说服力的证据是使用唑尼沙胺25~50 mg可显著降低UPDRS III评分和每日“关”期时间[16]。此外,唑尼沙胺可能在改善PD的非运动症状方面发挥有益作用,包括冲动性强迫症、快速眼动睡眠障碍和痴呆症等[16]。FDA和我国虽然尚未批准该药用于治疗PD,但随着证据的完善,未来唑尼沙胺有望在PD治疗中发挥重要作用。
1.5COMTI COMTI通常联合左旋多巴一起使用,我国上市的药物有恩他卡朋和托卡朋。SONG等[17]对COMTI在PD患者中的疗效与安全性进行了网状Meta分析,结果显示使用托卡朋的PD患者 “开”期时间[MD=3.2 h,95%CI=(2.1,4.2)]比恩他卡朋[MD=0.64 h,95%CI=(0.29,1.0)]久,但患者对恩他卡朋的耐受性更好。托卡朋对肝脏的不良影响较重,包括可能引起急性暴发性肝功能衰竭、肝细胞损伤等,使用时应进行监测。而恩他卡朋未发现明显的肝毒性,安全性更高,临床使用更多,但肝功能不全患者仍需禁用。
作为添加治疗药物,COMTI和DAs、MAO-BI相比,有优势也有不足。Cochrane系统评价显示[11],在减少“关”期时间上,DAs为1.54 h·d-1;MAO-BI为0.93 h·d-1;COMTI为0.83 h·d-1。在减少左旋多巴剂量方面,DAs为-116 mg·d-1;COMTI为-52 mg·d-1;MAO-BI为-29 mg·d-1。在给药一段时间后UPDRS得分变化方面,DAs 10.01分;MAO-BI 2.20分;COMTI 1.46分。但是和单用左旋多巴制剂相比,添加使用这三类药物时,LID和其他不良反应的发生均显著增加,三类药物间不良反应发生率差异无统计学意义。整体看,DAs治疗可能比COMTI和MAO-BI更有效,后两者的疗效似乎相近,但缺少直接的头对头随机试验来评估这三类药物对患者总体生活质量的影响。
欧盟在2016年批准了最新的奥匹卡朋作为添加药物用于治疗PD,我国还未上市。与恩他卡朋相比,其对左旋多巴的生物利用度更好,药效持续时间更持久,抑制COMT的时间更长[18]。值得注意的是,临床试验显示服用奥匹卡朋的患者约18%患有异动症[19],该药物与异动症之间的关系有待进一步研究。尚未发现奥匹卡朋相关的肝毒性。奥匹卡朋其他常见的副作用包括头晕、异梦、幻觉、便秘、口干、直立性低血压和肌肉痉挛等[17]。除痉挛外其他不良反应均与恩他卡朋相同。目前尚缺乏对奥匹卡朋的循证医学评价。
1.6抗胆碱能药 抗胆碱能药专门用于治疗PD患者的锥体外系反应,尤其是震颤显著的患者,但对认知有较严重的不良影响。PIEPER等[6]系统评价了抗胆碱能药物与认知功能的相关性,结果显示,无论短期还是长期使用,抗胆碱能药物都与偶发性痴呆有关[短期OR=1.23,95%CI=(1.17,1.29),I2=2%;长期OR=1.50,95%CI=(1.22,1.85),I2=90%],任何抗胆碱能药物的使用都与认知能力下降有关[SMD=0.15;95%CI=(0.09,0.21),I2=3%]。不过抗胆碱能药物与认知相关的研究主要是观察性试验,因此尚不能确定抗胆碱能药物和认知间的因果关系。未来需要更高质量的研究证据来指导抗胆碱能药物的使用。
1.7金刚烷胺 金刚烷胺也是在偶然情况下被发现可以治疗PD,其具体的作用机制和作用靶点尚未完全阐明,可能是通过促进纹状体内多巴胺的合成及释放、减少神经细胞对多巴胺的再摄取发挥治疗作用,改善PD患者的症状。
金刚烷胺治疗PD患者LID的疗效已经获得随机对照试验的证实[20],在随机对照试验中,金刚烷胺最常见的副作用是网状青斑、口干和视力模糊,没有严重的副作用发生。但金刚烷胺的其他用途,如治疗药物诱发的PD、非典型PD或迟发性运动障碍等,仍然缺乏强有力的证据基础。未来的研究需要解决它在早期PD和其他运动障碍患者的运动和非运动症状管理中的作用。
2 PD新药研究
PD现阶段的治疗药物不能延缓或阻止疾病的发展,长期使用,药物疗效还会减弱,并增加运动或非运动并发症的发生风险[7]。除了作用于多巴胺能神经元的药物外,研究人员正在积极寻找和开发其他作用靶点的药物,以求在PD的治疗上有新的突破。
在美国临床试验数据库(ClinicalTrials.gov)注册的PD新药临床试验有以下几类,见表2。
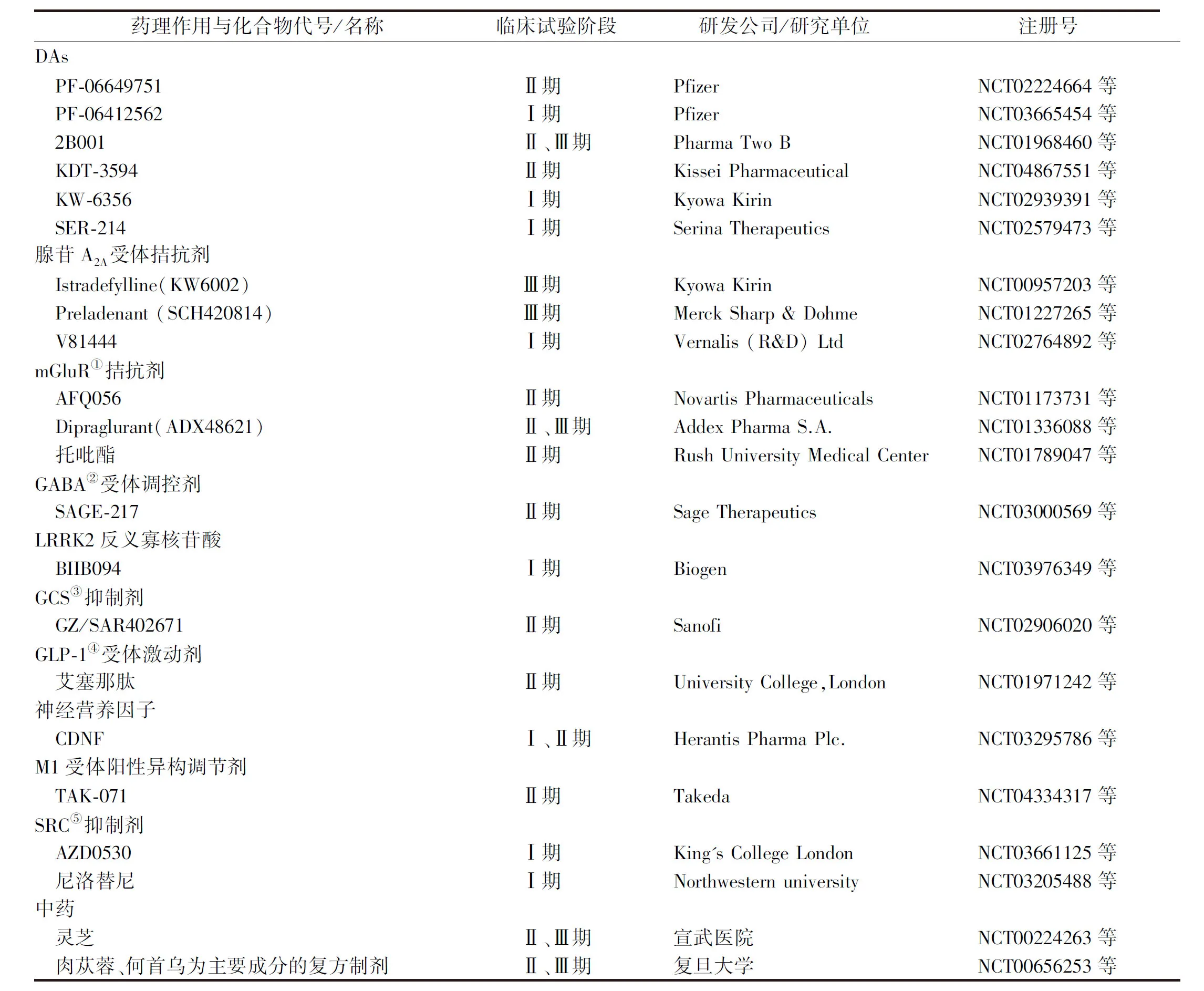
表2 临床试验中的PD治疗药物
2.1多巴胺受体激动剂 可以查到临床试验结果的药物有PF-06649751和P2B001。PF-06649751是多巴胺D1/D5受体部分激动剂,临床试验结果显示,与安慰药组相比,服用PF-06649751可以显著改善患者的运动症状,患者耐受性良好,不良反应发生率低,最常见的不良反应与已上市的药物相似,为恶心、头痛、口干、嗜睡和震颤[21]。P2B001是普拉克索(0.3 mg或0.6 mg)和雷沙吉兰(0.75 mg)的复合制剂,临床研究表明与安慰药组相比,P2B001组患者的UPDRS各部分评分都有显著降低,恶心和嗜睡的不良反应发生率较安慰药组更高[22]。
2.2腺苷A2A受体拮抗剂 腺苷是一种重要的神经调节剂。在大脑中,腺苷A2A受体主要存在于基底神经节中,基底神经节在运动控制中起着重要作用,而在PD患者和长期服用DAs的患者中,基底神经节被发现存在退化或异常,腺苷A2A受体上调[23],若阻断A2A受体,可能降低长期多巴胺能药物治疗引起的PD发作和随后运动障碍的风险[24]。PAGNUSSAT等[25]还发现A2A受体还可调节突触可塑性,认为A2A受体激活是触发记忆损伤的充分必要条件。
近些年有许多临床试验对腺苷A2A受体拮抗剂治疗PD的有效性、安全性展开评估。其中一款新药Istradefylline(商品名Nourianz)在2019年8月27日被FDA批准作为添加药物,用于PD“关”期的治疗,是近二十年来FDA批准的第一种用于PD的非多巴胺能药物。该药的系统评价显示[26],Istradefylline可显著缩短“关”期时间[20 mg·d-1:SMD=-0.23,95%CI=(-0.40,-0.06),P=0.009,I2=55%;40 mg·d-1:SMD=-0.28,95%CI=(-0.44,-0.12),P=0.000 5,I2=34%],显著改善UPDRS III 运动能力得分[20 mg·d-1:SMD=-0.15,95%CI=(-0.27,-0.02),P=0.02;40 mg·d-1:SMD=-0.24,95%CI=(-0.37,-0.11),P=0.000 2]。而另一种新药Preladenant的临床试验结果未达到预期,“关”期时间没有显著减少[27],疗效欠佳。
Istradefylline对PD患者的显著疗效,证明腺苷受体通路在PD中发挥作用,有助于对PD机制的进一步探索,未来也可能会发展出更多药物。但该类药物能否在临床中改善患者突触可塑性、营养神经,需要严谨的随机对照研究来验证。
2.3谷氨酸受体拮抗剂 LID的发生与皮质-纹状体神经元的谷氨酸受体(mGluR)过度表达以及谷氨酸能信号的改变密切相关,由此产生皮质纹状体电路的去抑制样变化,导致运动皮层的异常活动[15,28]。针对谷氨酸能的改变,研究人员开展了对mGluR拮抗剂的研究,拟将其作为辅助药物来改善患者的运动症状。mGlu5受体拮抗剂治疗LID的回顾性Meta分析显示[29],与对照组相比,mGlu5受体拮抗剂可改善患者改良的异常不自主运动量表得分(P=0.010)。然而Lang-Fahn日常生活运动障碍量表(P=0.42)和UPDRS Ⅳ得分(P=0.20)与安慰药相比没有显著改善。mGluR5拮抗剂的不良事件发生率高于安慰药,特别表现在头晕(16.3%比4.3%)、幻觉(10.1%比1.1%)和疲劳(10.1%比4.8%),患者耐受性较差。因此mGluR拮抗剂与临床应用尚有一段距离,需要继续改进化合物结构,用更多的证据来证明mGluR类药物治疗PD的效果。
2.4选择性γ-氨基酸(GABA)受体调控剂 GABA是大脑中抑制性氨基酸,由于基底节在自主运动中起着关键作用,基底节GABA受体有可能成为治疗PD的靶点,通过调控基底节GABA受体,或许可以改善PD患者中基底节功能障碍,从而改善PD的运动症状[30]。目前代号为SAGE-217的选择性神经活性类固醇GABA受体阳性调控剂正在进行Ⅱ期临床试验,将初步评价其在PD患者中的治疗作用[31],目前没有临床结果公开发表。
2.5基因靶点药物 编码富亮氨酸重复激酶2(leucine-rich repeat kinase 2,LRRK2)的PARK8基因与PD发病关系紧密。在PD发病机制中,LRRK2通过调节大脑免疫细胞的反应,激活神经胶质细胞调节神经炎症的通路[32]。除此之外,LRRK2对多巴胺受体具有调节功能,过表达的LRRK2延缓细胞膜D1受体的内化,使D1受体在胞膜内积累;同时LRRK2过表达导致D2受体在高尔基体大量积聚,D2受体含量增加。LRRK2还参与调节囊泡运输,包括囊泡分泌、囊泡胞吞和胞吐、内体-溶酶体功能以及逆转运复合体功能,但当前研究有限,具体参与分子和完整通路并不清楚[33-34]。PARK8基因突变通常使LRRK2含量和活性增加,通过调节上述多种途径,增加突变个体PD的发病概率,因此抑制激酶的活性有可能成为治疗PD的新途径[35]。通过反义寡核苷酸靶向结合LRRK2蛋白上游mRNA的治疗方法目前已进入Ⅰ期临床试验[36]。而LRRK2激酶抑制剂目前还处于临床前研究阶段。
编码葡萄糖脑苷脂酶(glucocerebrosidase,GBA)的基因突变是PD发病的危险因素[2]。研究发现,GBA的缺乏会降低自噬通量,这种缺陷导致线粒体自噬减少,使功能障碍的线粒体在细胞内积累。同时,GBA功能受损使α-突触核蛋白降解失衡,溶酶体过载,导致α-突触核蛋白在细胞内积累。另一方面,因突变而错误折叠的GBA在内质网累积可引起未折叠蛋白反应功能障碍,扰乱内质网相关的钙离子稳态[34]。这些过程均对神经细胞造成损伤,影响细胞正常功能状态,促使PD的发生。在这条通路里,葡萄糖神经酰胺合成酶(glucosylceramide synthase,GCS)是合成葡糖脑苷脂的关键酶,葡糖脑苷脂在GBA的催化下又转变为葡萄糖和神经酰胺。动物实验表明[37],用GCS抑制剂治疗α-突触核蛋白模型小鼠,可减缓小鼠海马体α-突触核蛋白、泛素和tau聚合体的积累,改善相关记忆缺陷。这样的发现使GCS抑制剂有望成为治疗PD的新策略,相关Ⅱ期临床试验已经开展,但有关结果尚未公布。
2.6胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)受体激动剂 在过去十年,人们越来越关注中枢神经系统中神经退行性变和异常胰岛素信号之间的关系,发现胰岛素可能在神经元代谢、修复和突触效能中起着关键作用。糖尿病和胰岛素抵抗不仅增加PD发病的可能,而且还可以决定PD的预后和进展[38]。PD患者大脑中的胰岛素信号是脱敏的,这样的改变有可能是PD的一种潜在发病机制[38]。
降糖药GLP-1受体激动剂在阿尔茨海默病动物模型和PD动物模型中均发现对神经有保护作用,并且在阿尔茨海默病动物模型中使大脑内胰岛素信号恢复敏感[39]。另外有研究证实,GLP-1对PD具有疾病修饰作用[40]。评估GLP-1抑制剂治疗PD的随机对照试验显示[41],经过48周的给药和12周的停药后,与安慰药组相比,艾塞那肽组患者在第48周和第60周时,运动障碍协会修订版UPDRS Ⅲ得分得到改善,但两组在其他6种量表或问卷的得分上差异无统计学意义。该研究说明艾塞那肽对PD患者修订版UPDRS运动部分评分有积极影响,并且有益影响可持续至停药后。但是无法确定艾塞那肽在人体中对疾病潜在病理生理学的影响,需要更多临床试验共同验证。
2.7脑多巴胺神经营养因子 研究发现脑多巴胺神经营养因子(cerebral dopamine neurotrophic factor,CDNF)在大鼠和小鼠PD模型中能够保护黑质纹状体多巴胺能通路[42-43],保护神经元免受α-突触核蛋白的毒性作用[44],并且可以增强神经干细胞向损伤纹状体的迁移与增值,改善PD所致的运动功能障碍[42]。目前CDNF正在进行I期临床试验。
2.8M1阳性异构调节剂 随着PD进展,前脑基底节胆碱能丢失会造成认知能力下降和步态平衡障碍,使患者跌倒风险增加,这种风险对老年人可能是致命的。然而临床用于调节胆碱能神经元的胆碱酯酶抑制剂长期使用对认知有严重不良影响。为解决这些问题,日本武田制药公司开发了一种新化合物TAK-071。动物试验结果表明TAK-071可改善部分胆碱能丧失小鼠的注意力,特别是在目标驱动和注意力控制等方面[45]。除此之外,研究人员还发现TAK-071有助于复杂的运动控制[46]。TAK-071在健康人群中耐受性良好,口服给药后有良好的透过血脑屏障的能力[47]。目前该化合物正在进行Ⅱ期临床试验以评估在PD患者中的疗效。
2.9SRC抑制剂 SRC是一组非受体酪氨酸激酶家族,共有11种激酶,包括酪氨酸激酶Fyn。化合物AZD0530是一种SRC抑制剂,最初被研发出来用于治疗癌症,然而临床试验结果不理想。但其抑制Fyn的作用被发现可以改善PD[48]。Fyn可以在多巴胺D1受体刺激下,调节N-甲基-D-天冬氨酸受体NR2B亚基的磷酸化[48-49],最终使细胞过度兴奋而造成兴奋性毒性,使神经细胞损伤和凋亡。SANZ-BLASCO等[49]使用Fyn基因敲除小鼠和野生型小鼠,用6-羟基多巴胺诱导细胞损伤,并用左旋多巴长期治疗,构建运动障碍小鼠模型,研究Fyn在LID中的作用。研究人员发现,与野生型对照小鼠相比,缺乏Fyn的小鼠表现出LID和NR2B磷酸化减少。预先给予化合物AZD0530,能显著降低运动障碍野生型小鼠的LID。这些结果证明Fyn在LID发展过程中起着关键作用,并确定Fyn是治疗PD运动障碍的一个新的潜在治疗靶点。实际临床效果还需要等待临床试验的确认。
2.10中药制剂 中药制剂分子种类丰富,可能有多个作用靶点和通路,但复杂的分子组成为药物作用机制的研究带来困难。在小鼠模型中,我国研究人员发现中药灵芝孢子粉及其提取物对包括多巴胺能神经元在内的脑组织细胞具有保护作用,这种作用可能与减轻大脑中氧化应激和神经炎症反应有关[50]。但目前缺乏随机对照双盲的临床试验来证实中药制剂的疗效和安全性。
3 结语
已有的PD治疗药物最大的缺点是只能暂时控制症状,而不能阻止病情进展。同时长期使用药物后,治疗效果会下降,到了疾病后期基本需要多类药物联合应用,这不仅提高患者不良反应的发生率,而且也带来沉重的经济负担和社会负担。目前延缓疾病进展并改善患者症状的疾病修饰药物寥寥无几。MAO-BI类药物和罗匹尼罗可能具有疾病修饰作用,但缺乏循证医学证据,需要进行更多探索。
研究人员一直在寻找和开发新的药物治疗作用靶点。目前PD治疗药物的基础研究和临床试验广泛且丰富,有望为未来PD治疗带来更多曙光。

