复方柏连制剂对小鼠抗炎镇痛作用及湿热型UC模型大鼠TNF-α、IL-6、IL-1β表达的影响*
郭媛媛,朱志坤,王飘,王五兵,李思琪,陈凌云,余晓玲
(1.云南中医药大学中药学院药剂实验室,昆明 650500;2.昆明市中医医院药剂科,昆明 650500)
溃疡性结肠炎(ulcerative colitis,UC)是以大肠黏膜及黏膜下层持续性炎症为特征的慢性非特异性疾病,具有易复发、难治愈的特点[1-2]。UC发病机制较复杂,其症状主要有腹泻、黏液脓血便、反复腹痛等[3],中医认为 UC 属 “泄泻”“肠癖”“脏毒”“滞下”“下血”“肠风”的范畴[4-5]。近年,越来越多的临床试验证明,具有多靶点、多成分的中药辅助治疗有利于缓解UC症状,具有疗效可靠、副作用少、复发率低的优势[6]。
复方柏连方为治疗UC的经验方,具有清热除湿、活血化瘀、收敛止痢及促进溃口愈合等作用,在临床上疗效显著,为方便患者使用,在原汤剂基础上制成复方柏连灌肠剂(compoundbailianenema)和复方柏连凝胶剂(compoundbailiangel),本文通过对两种制剂的毒理和药效进行研究,为临床应用提供参考依据。
1 材料与方法
1.1材料
1.1.1实验动物 昆明小鼠,无特定性病原体(SPF)级,6~8 周龄,体质量为(20±2) g;SD 大鼠,SPF 级,体质量为150~180 g,购买于昆明医科大学动物中心,许可证号为:SYXK(滇)2020-0004,饲养于云南中医药大学动物中心 SPF 级动物房,室温:(22±3) ℃,相对湿度:55%~60%。
1.1.2药物与试剂 复方柏连灌肠剂(昆明市中医医院提供,每瓶200 mL,批号:210915)、复方柏连凝胶剂(昆明市中医医院提供,每瓶200 g,批号:211010)、阿司匹林(上海皓鸿生物医药科技有限公司,批号:Lc1210006)、柳氮磺吡啶肠溶片(上海信谊天平药业有限公司,批号:09211015)、冰醋酸(广东光华科技股份有限公司,批号:20190526)、0.9%氯化钠水溶液(安徽靓水亭医疗器械有限公司,批号:20220224)、蜂蜜(昆明道地中药饮片厂,批号:211101)、猪油(临沂经开区裕升食用油有限公司,批号:20220108)、红星二锅头白酒(北京红星股份有限公司,批号:20211205)、4% 多聚甲醛(北京兰杰柯科技有限公司,批号:21348860)、水合氯醛(成都市科隆化学品有限公司,批号:2019121301)、2,4,6-三硝基苯磺酸(TNBS)(Sigma-Aldrich贸易有限公司,批号:SLCK4178)、乙醇(天津市致远化学试剂有限公司,批号:20220301826)、二甲苯(天津市致远化学试剂有限公司,批号:20190311)、酶联免疫吸附(ELISA)法检测试剂盒(江苏酶免实业有限公司,肿瘤坏死因子(TNF)-α:20220518-31063A、白细胞介素(IL)-1β:20220518-30206A、IL-6:20220518-30219A)。
1.1.3仪器 CP124C 电子分析天平(奥豪斯仪器有限公司,感量:0.01 mg)、T-1000电子天平(美国双杰兄弟有限公司,感量:0.1 mg)、高速离心机(湖南仪器仪表总厂离心机厂,离心半径12 cm)、正置白光拍照显微镜(日本尼康公司,NIKON ECLIPSE C1)。
1.2方法
1.2.1急性毒性实验 因复方柏连制剂毒性低,动物灌肠给药受药物浓度和体积限制,测不出半数致死量(LD50),故进行最大给药量实验[7]。取昆明小鼠30只,雌雄各半,采用随机数字表法分为3组,每组10只,分为正常对照组、复方柏连灌肠组、复方柏连凝胶组。给药前动物禁食不禁水12 h,正常对照组予以0.9%氯化钠溶液每只灌肠0.8 mL,复方柏连灌肠组(2.02 g·mL-1)予以复方柏连灌肠剂每只灌肠0.8 mL,复方柏连凝胶组(2.02 g·g-1)予以复方柏连凝胶剂每只灌肠0.8 g。各组均24 h内灌肠 2 次,观察并记录给药后30 min、2 h及随后14 d小鼠外观、行为、饮食、排泄物及毒性反应,每日称体质量;记录14 d内死亡小鼠数,死亡小鼠立即解剖,观察其内脏病理变化。所有小鼠实验第15天脱颈处死,解剖观察脏腑病理变化。
1.2.2黏膜刺激实验 取SD大鼠 40 只,雌雄各半,采用随机数字表法分为正常对照组、空白凝胶组、复方柏连灌肠组、复方柏连凝胶组,每组 10 只。复方柏连灌肠组(2.02 g·mL-1)予以复方柏连灌肠剂 5.25 mL·kg-1灌肠,复方柏连凝胶组(2.02 g·g-1)予以复方柏连凝胶剂 5.25 g·kg-1灌肠,正常对照组和空白凝胶组予以等体积0.9%氯化钠溶液或空白凝胶灌肠。每天给药1次,连续给药 7 d。
1.2.3抗炎实验 取昆明小鼠80只,雌雄各半,采用随机数字表法分为8组,每组10只:正常对照组(0.9%氯化钠溶液)、阳性对照组(阿司匹林混悬液0.2 g·kg-1)、复方柏连灌肠组和复方柏连凝胶大(34 g·kg-1)、中(17 g·kg-1)、小(8.5 g·kg-1)剂量组,各组动物每天灌肠给药1次,灌肠剂量为16.83 mL·kg-1,连续给药7 d。末次给药30 min后,每只右耳背腹两侧涂以二甲苯0.04 mL,左耳作对照,不做处理。30 min后处死动物,剪下双耳,用直径8 mm的打孔器在双耳同部位打下圆形耳片称质量,计算小鼠耳胀肿率。小鼠耳肿胀率(%)=(右耳片质量-左耳片质量)/左耳片质量×100%;小鼠耳肿胀抑制率(%)=(正常对照组平均肿胀度-给药组平均肿胀度)/正常对照组平均肿胀度×100%[8]。
1.2.4镇痛实验 取昆明小鼠 80 只,分组及给药同“1.2.3”抗炎实验。末次给药1 h 后,腹腔注射 0.6% 冰醋酸溶液,每只10 mL·kg-1,观察记录15 min内小鼠扭体次数[9],计算扭体抑制率。小鼠扭体抑制率(%)=(正常对照组平均扭体次数-给药组平均扭体次数)/正常对照组平均扭体次数×100%。
1.2.5TNBS/乙醇致大鼠UC实验
①动物模型建立。取SD大鼠 120 只,雌雄各半,适应性喂养1周,采用随机数字表法分为 10 组,除正常对照组外,其余各组均参考文献[10]建立大肠湿热模型。于造模第11天禁食24 h,给予造模药液(TNBS 100 mg·kg-1+50%乙醇)0.8 mL,用直径约1.5 mm的8 f导尿管插入肛门上段约8 cm处一次性注入上述混合试剂[11],提拉大鼠尾巴倒立30 s,让药液与肠道充分接触,造出UC大鼠模型。大鼠出现腹泻、稀便、血便等指标即为造模成功。
②给药方法。将造模成功大鼠全部给予正常饲料和纯净水喂养,并随机分为 9 组,模型对照组(0.9%氯化钠溶液)、空白凝胶组、阳性对照组(柳氮磺吡啶肠溶片混悬液0.36 g·kg-1)、复方柏连灌肠组和 复方柏连凝胶高(20.4 g·kg-1)、中(10.2 g·kg-1)、低(5.1 g·kg-1)剂量组、外加正常对照组。各组动物每天灌肠给药1次,灌肠剂量为10.10 mL·kg-1,连续给药14 d。
③观察指标及检测方法
(1)DAI 评分计算:每日观察大鼠一般情况后,根据便血情况并结合体质量变化进行小鼠疾病活动指数评分(disease activity index,DAI),DAI 评分=体质量下降分数+粪便性状分数+便血分数[12]。评分标准见表1。
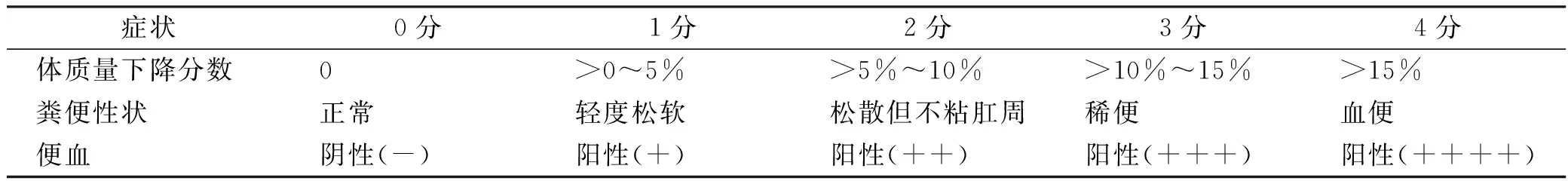
表1 DAI评分标准
(2)血清中 TNF-α、IL-6、IL-1β测定:于大鼠末次给药1 h后用10%水合氯醛(3 mL·kg-1)腹腔注射麻醉,立即剖腹取腹主动脉血约8 mL,静置30 min,以3 000 r·min-1离心15 min,离心半径为12 cm,分离上层血清,置于-20 ℃冰箱内保存,采用ELISA法测定,测定炎性因子TNF-α、IL-6、IL-1β的含量。
(3)损伤结肠长度及 CMDI 评分的测定:每组大鼠采血结束后,随即解剖,统一在距肛门约2 cm处往上取结肠组织,肉眼观察肠黏膜的损伤程度,按结肠黏膜损伤指数(colon mucosa damage index,CMDI)进行评分,用大头针固定结肠,测量结肠长度。0分:无;1分:轻度充血,水肿,表面光滑,无糜烂或溃疡;2分:充血水肿,黏膜粗糙呈颗粒状,有糜烂或肠粘连;3分:高度充血水肿,黏膜表面有坏死及溃疡形成,溃疡最大纵径<1.0 cm,肠壁增厚或表面有坏死及炎症;4分:在3分基础上溃疡最大纵径>1.0 cm或全肠壁坏死。
(4)结肠病理学变化:另取病变结肠组织约2 cm于4%多聚甲醛溶液中固定,制成病理切片,常规苏木精-伊红(HE)染色,观察组织病理学变化。
2 结果
2.1急性毒性实验结果 14 d内各组小鼠活动正常,皮毛光滑,饮食及大、小便未见明显异常,无死亡小鼠,给药后实验组体质量增长与正常对照组比较差异无统计学意义(P>0.05)(图1)。实验结束处死所有小鼠,解剖肉眼观察小鼠心、肝、脾、肺、肾、结肠等主要脏器未见明显异常。

图1 急性毒性实验对小鼠体质量的影响
2.2黏膜刺激实验结果 实验组及正常对照组大鼠每日给药后毛发色泽及排泄物均正常,直肠病理检查结果均正常,黏膜完整,无溃疡,黏膜腺体间无淋巴细胞浸润,浅表无糜烂及不典型增生,可见散在杯状细胞。给药期间无死亡大鼠。见图2。
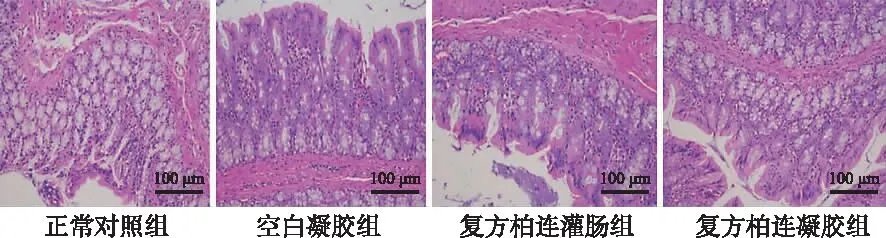
图2 各组大鼠结肠组织的病理切片图(HE)
2.3抗炎实验结果 对照组小鼠在给予二甲苯致炎后,右耳明显肿胀,肿胀率达65.32%。与正常组相比,阳性药阿司匹林对二甲苯致小鼠耳廓肿胀具有明显的抑制作用(P<0.01),复方柏连灌肠剂和凝胶剂大、中、小剂量均可显著抑制二甲苯引起的小鼠耳肿胀。表明复方柏连灌肠剂和凝胶剂具有一定的抗炎作用,见表2。
表2 复方柏连制剂对二甲苯致小鼠耳廓肿胀的影响
2.4镇痛实验结果 与对照组相比,阳性药阿司匹林对醋酸致小鼠疼痛具有明显的抑制作用(P<0.01),复方柏连灌肠剂和凝胶剂大、中、小剂量均能明显减少小鼠扭体次数,给予复方柏连灌肠大剂量时小鼠扭体次数显著减少(P<0.01),抑制率为51.07%,见表3。
表3 复方柏连制剂对醋酸致小鼠扭体次数的影响
2.5TNBS/乙醇致大鼠UC实验结果
2.5.1DAI评分 模型对照组与正常对照组 DAI 评分差异有统计学意义(P<0.01),提示造模成功。给药14 d后,相较于模型对照组,给药组 DAI 评分显著降低(P<0.05或P<0.01),提示给药组症状减轻,给药可缓解UC大鼠疾病症状。见表4。
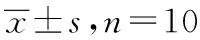
表4 复方柏连制剂对UC大鼠DAI评分的影响
2.5.2损伤结肠长度及CMDI评分 治疗14 d后,模型对照组与正常对照组损伤结肠长度差异有统计学意义(P<0.05),其中,阳性组、复方柏连灌肠、复方柏连凝胶大剂量组损伤结肠长度显著增加(P<0.05);与模型组相比,阳性组与各给药组CMDI评分降低(P<0.05)。见表5。
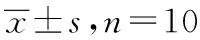
表5 治疗14 d后各组大鼠损伤结肠长度及CMDI评分
2.5.3结肠病理改变 正常对照组镜下可见肠组织各层结构清晰,黏膜上皮完整,肠腺数量丰富,排列紧密,未见明显溃疡及炎症细胞浸润。模型对照组和空白凝胶组镜下可见肠组织大面积溃疡,少量上皮细胞坏死,固有层可见多量肠腺坏死,结构消失,结缔组织增生,伴多量淋巴细胞浸润,黏膜下层结缔组织增生,有大量炎症细胞浸润,以中性粒细胞为主[14-15]。与正常对照组相比,给药组炎症细胞浸润程度、腺体修复程度有不同程度改善,阳性组恢复效果最好。见图3。
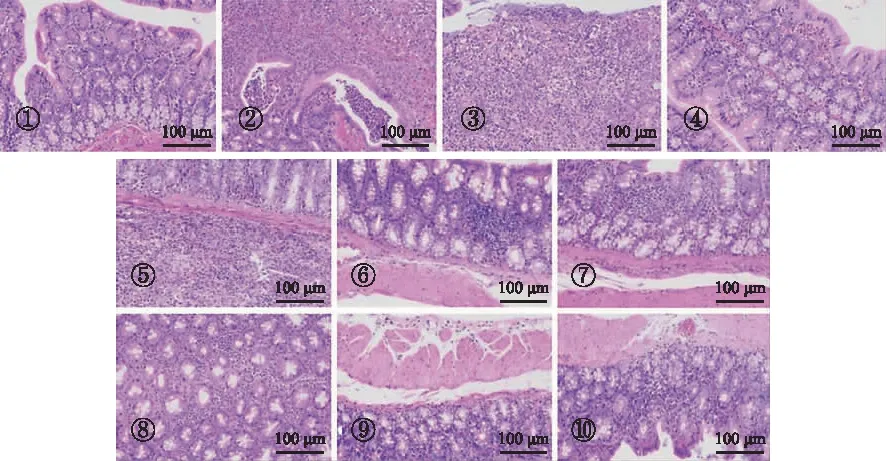
①正常对照组;②空白凝胶组;③模型对照组;④阳性组;⑤复方柏连灌肠大剂量组;⑥复方柏连灌肠中剂量组;⑦复方柏连灌肠小剂量组;⑧复方柏连凝胶大剂量组;⑨复方柏连凝胶中剂量组;⑩复方柏连凝胶小剂量组。
2.5.4血清中TNF-α、IL-6、IL-1β含量变化 与正常对照组比较,模型对照组中TNF-α、IL-6及IL-1β 的含量显著升高(P<0.01),表明造模成功。复方柏连灌肠和复方柏连凝胶大、中、小剂量组及阳性组均能明显降低UC大鼠的损伤指数,其中复方柏连凝胶大剂量组与阳性组作用相当(P>0.05),复方柏连灌肠和复方柏连凝胶大剂量组作用均优于中、小剂量组(P<0.05或P<0.01)。见表6。
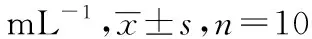
表6 复方柏连制剂对血清中TNF-α、IL-6、 IL-1β的影响
3 讨论
目前UC的发病机制尚未明确,中医认为该病主要由湿邪侵袭肠道,湿热和脾胃虚弱导致,并将其分为7种证型。本研究参考相关文献,基于“病证结合”原则,建立的 UC 大肠湿热证模型能够更好地体现中医病机和西医病理的特点,更符合药效的观察和评价。并选取 TNF-α、IL-6、IL-1β 作为炎症评价指标,以上指标在 UC 的发生和发展中起着重要作用[16],并与 UC 的疾病活动呈正相关。TNF-α 是一种具有生物活性的炎症物质,可与肿瘤坏死因子受体-1 结合,促进炎症因子产生[17-18];IL-1β 属于Th1分泌的细胞因子,可由巨噬细胞、内皮细胞诱导产生,促进炎症反应,刺激T淋巴细胞活化和B淋巴细胞抗体的分泌,直接介导UC患者炎症的发生[19];IL-6是促炎因子,能与靶细胞表面IL-6受体识别并结合成复合物,调控炎症细胞因子的表达[20]。本实验模型对照组大鼠的肠组织中TNF-α、IL-1β、IL-6活性均显著升高,与UC发病机制一致。复方柏连制剂大、中、小剂量组及阳性组均能降低小鼠耳肿胀率,减少扭体次数,且与模型对照组比较差异有统计学意义(P<0.05);均能明显降低UC大鼠的肠损伤指数。表明复方柏连灌肠剂和凝胶剂有较好的抗炎镇痛、清热除湿作用,对UC有一定的治疗作用,为该制剂进一步应用于临床提供了基础。

