甘露特纳胶囊改善阿尔兹海默病认知障碍并降低神经炎症的机制研究
王玲玲,杨 娟,王 涛,李锦师,隋海晶,赵晓晖
(上海市浦东新区人民医院神经内科,上海 201200)
阿尔兹海默病(Alzheimer′s disease,AD)是一种损害记忆和认知功能的进行性神经退行性疾病,可能导致生命晚期的痴呆[1]。AD的主要病理结果是老年斑块、神经纤维缠结、突触结构稳定性的破坏和神经元死亡。甘露特纳胶囊(sodium oligomannate capsules,GV-971)是一种源自海藻的口服寡糖,由上海绿谷制药公司开发,用于治疗AD。甘露聚糖酸钠于2019年11月在中国首次获得批准,用于治疗轻中度AD,以改善认知功能[2]。GV-971是一种聚合度为2~10的低聚糖混合物[3],可以直接与β-淀粉样蛋白(amyloid β-protein,Aβ)的多个亚区结合,抑制Aβ纤维的形成,并将预先形成的纤维稳定为无毒的单体[4]。口服后,大多数摄入的GV-971保留在肠道中,可以重建肠道微生物群,减少细菌代谢物驱动的免疫细胞向大脑的外周渗透,并抑制在动物模型中观察到的大脑中的神经炎症[4]。在一项为期36周的多中心、随机、双盲、安慰剂对照的3期临床试验[4]中,GV-971显示了对逆转AD患者认知障碍的治疗效果。本研究旨在探究GV-971改善认知功能及神经炎症的机制,报告如下。
1 材料与方法
1.1材料 AD淀粉样前体蛋白(Amyloid precursor protein,APP)/早衰蛋白1(presenilin 1,PS-1)小鼠(雌性,9月龄)和WT-C57(野生型C57小鼠,雌性,9月龄)购自中国医学科学院医学实验动物研究所[许可证号:SYXK(京)2021-0058,北京,中国]。所有小鼠均在我院动物实验中心饲养。每组小鼠为6只,共计18只。动物分组如下:健康组(野生型C57小鼠)自由喂食及饮用水;对照组(APP/PS1小鼠)每天口服1次GV-971(100 mg/kg),其余时间自由进食及饮用水;治疗组(GV971+APP/PS1小鼠)每天同一时段口服1次蒸馏水,其余时间自由进食及饮用水。持续3个月,在3个月结束时,对小鼠进行行为学测试评估其认知行为表现。
本研究中进行的所有小鼠饲养程序均经我院动物伦理委员会批准。
1.2Morris水迷宫实验 Morris水迷宫实验[5]用于评估小鼠的学习和记忆。小鼠被放置在1个装满水的圆形水池里(直径1.2 m,24~26 ℃),视觉信号放置在水池周围。水迷宫实验包括1个可见测试(即刻)、隐藏站台测试(第1~5天)和探针测试(第6天)。在可见测试和隐藏站台测试期间,小鼠释放到水池的频率是4次/d,记录逃避潜伏期(寻找隐藏站台的时间)和游泳速度。如果小鼠未在60 s内找到平台,则将其抓出并在站台上放置15 s。在探针测试期间,释放小鼠,并允许其在无平台的水池内自由游泳60 s。记录在每个象限中花费的时间百分比。
1.3Y型迷宫实验 Y型迷宫试验包括自发交替试验和新臂探索试验。Y型迷宫由3个对称的手臂组成,呈120 °,不同颜色的图案被贴在每个手臂上以便区分[6]。在自发交替试验中,允许小鼠在Y型迷宫中自由移动8 min。小鼠在重叠的三联组上连续进入3个手臂的行为被定义为自发交替。记录小鼠的总进入次数和自发交替的次数。交替的百分比用以下公式计算:[自发交替的数量/(总的手臂条目数-2)]×100%[7]。在新的手臂探索测试中,1个手臂被挡板挡住,并被定义为新的手臂,允许小鼠探索其他2个手臂(家的手臂和熟悉的手臂),持续5 min。间隔2 h后,移除挡板,允许小鼠自由探索所有3个手臂5 min。用摄像机记录小鼠进入新臂的次数、行走的距离以及小鼠在新臂上花费的时间,Y迷宫的准确性是正确交替和总交替之间的比率。每次试验后用75%的乙醇清洗Y型迷宫。
1.4组织样本采集 小鼠行为试验结束后,腹腔注射戊巴比妥钠 (800 mg/kg)麻醉小鼠,然后立即用磷酸盐缓冲盐水(phosphate buffered saline,PBS)(含4%多聚甲醛)进行心脏灌流。灌注后,冰上移出大脑,快速分为左右半脑并取出每个半脑的皮层和海马组织。一部分分装入提前标记好的EP管,液氮速冻,后放入-80 ℃保存,等待后一步实验。另一部分4 ℃固定过夜,4 ℃、30%蔗糖孵育至平衡。用低温恒温器(CM1850,Leica,Wetzlar,German)制备冠状切片,4 ℃保存。
1.5硫黄素S染色 自由漂浮切片(30 μm)在溶于50%乙醇的1%硫黄素S(北京索莱宝公司,北京,中国)中孵育10 min,用50%乙醇洗涤2次,每次5 min,然后再用蒸馏水洗涤1次,5 min;然后使用Vectashield荧光安装介质(H-1000,上海桑戈生物科技有限公司,上海,中国)安装切片。在荧光显微镜下(Olympus,Tokyo,Japan)老年斑显示为绿色斑点状,使用Image J(vision 1.48,National Institutes of Health,Bethesda,MD,USA)进行统计分析。
1.6酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA) 在每只小鼠中,大脑皮层或海马体的左半部分在含有50 mmol/L Tris和5 mol/L盐酸胍(pH 8.0)的缓冲液中均质化。将匀浆在室温下混合4 h,并在含有5%牛血清白蛋白、0.03%吐温20和蛋白酶抑制剂混合物的PBS中稀释[8]。采用ELISA试剂盒(上海茁彩生物科技有限公司,上海,中国)分析小鼠脑组织炎性细胞因子(interleukin-1β,IL-1β)、IL-10和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的蛋白水平,通过比较样品与标准品的相对吸光度来测定各因子的浓度。
1.7实时定量聚合酶链式反应(quantitative real time polymerase chain reaction,qRT-PCR) 收集小鼠脑组织,总采用Trizol(Invitrogen)提取总RNA。RNA浓度用Nanodrop ND-1000分光光度计(Thermo Fisher Scientific)测量。RNA纯度根据A260/A280(1.8~2.0)比值进行判断。cDNA合成采用Takara cDNA Synthesis Kit (Otsu,Japan),miRNAs和mRNAs的real-time PCR检测使用SYBR Green试剂(Bio Fact,Daejeon,South Korea)。3-磷酸甘油醛脱氢酶(GAPDH)用作内参,用2-△△Ct计算定量表达。实验重复3次。引物如下表1所示,由生工生物工程(上海)股份有限公司)合成。
表1 水迷宫实验检测小鼠逃避潜伏期Table 1 Morriswater maze test to detect the escape latency of mice

表1 水迷宫实验检测小鼠逃避潜伏期Table 1 Morriswater maze test to detect the escape latency of mice
组别逃避潜伏期第1天第2天第3天第4天第5天健康组51.45±1.4538.67±4.5623.45±3.4519.21±4.5217.89±4.00对照组50.67±4.5648.99±4.6640.98±1.5652.74±2.7444.04±4.04治疗组50.79±2.7940.12±4.1234.25±3.5636.54±4.1133.23±3.23组间F值=70.943 P值<0.001时点间F值=84.024 P值<0.001组间·时点间F值=15.259 P值<0.001

表1 引物序列Table 1 Primers sequence
表2 水迷宫实验检测小鼠处于不同象限的时间Table 2 Morris water maze test to detect the time of mice spent in different target quadrants

表2 水迷宫实验检测小鼠处于不同象限的时间Table 2 Morris water maze test to detect the time of mice spent in different target quadrants
组别处于目标象限时间的百分比健康组53.32±3.32 对照组23.45±3.34*治疗组41.23±1.23# F值171.507P值<0.001
*P值<0.05与健康组比较 #P值<0.05与对照组比较(SNK-q检验)
表3 Y迷宫检测空间工作记忆的准确性Table 3 Accuracy of the Y-maze in detecting spatial working memory
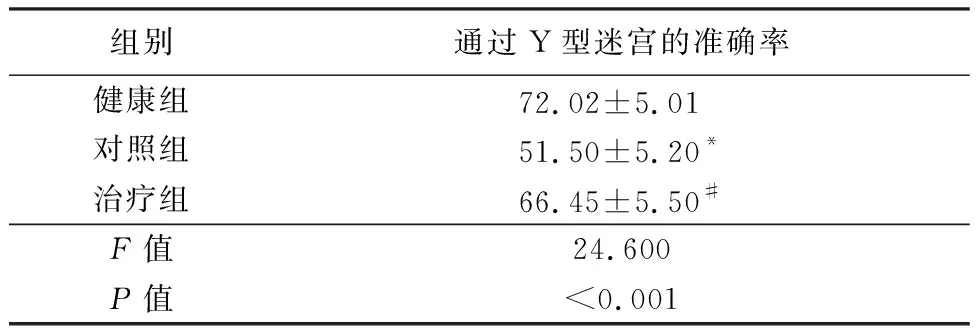
表3 Y迷宫检测空间工作记忆的准确性Table 3 Accuracy of the Y-maze in detecting spatial working memory
组别通过Y型迷宫的准确率健康组72.02±5.01 对照组51.50±5.20*治疗组66.45±5.50#F值24.600P值<0.001
*P值<0.05与健康组比较 #P值<0.05与对照组比较(SNK-q检验)
1.8蛋白质印迹法(Western blot) 述各组小鼠脑组织或细胞裂解液置于冰预冷的RIPA裂解缓冲液中(碧云天生物技术有限公司,上海,中国)30 min,然后4 ℃,12 000×g离心10 min。上清液用于分析。用BCA法(碧云天生物技术有限公司)检测蛋白浓度。10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(碧云天生物技术有限公司)分离的蛋白转移到硝基纤维素膜(Whatman,Piscataway,New Jersey)上,室温下用封闭液(cat.no.P0023B,碧云天生物技术有限公司)封闭1 h,再用相应的一抗和膜一起孵育,并4 ℃过夜。洗膜并加入二抗室温孵育2 h,ECL工作液(Merck Millipore,Billerica,MA,USA)显影。最后用Image J软件(vision 1.48,National Institutes of Health,Bethesda,MD,USA)进行数据分析,β-actin作为内参(一抗:BACE1,ab183612,1∶1 000;β-actin,ab8227,1∶1 000;二抗:山羊抗兔IgG H&L (HRP),ab205718,1∶5 000,Abcam,Cambridge,UK)。
1.9统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较采用独立样本t检验、单因素方差分析、SNK-q检验和重复测量方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1GV-971改善小鼠认知障碍 对阿尔兹海默症模型小鼠进行为期3个月的GV-971口服治疗后,水迷宫实验结果显示,健康组和对照组的逃避潜伏期随时间的推移均呈缩短趋势,健康组比对照组趋势更为明显,治疗组的逃避潜伏期随时间的推移呈现先缩短后延长后缩短的趋势,3组组间、时点间以及组间·时点间交互作用差异有统计学意义(P<0.05),治疗组在目标象限停留的时间百分比少于健康组和对照组,差异有统计学意义(P<0.05)。治疗组通过Y迷宫的准确率少于健康组和对照组,差异有统计学意义(P<0.05)。见表1~3。
2.2GV-971降低AD小鼠神经炎症 硫黄素S对脑组织染色结果显示,与健康组相比,对照组大脑皮层和海马区Aβ斑块占比和斑块面积显著升高,差异均有统计学意义(P<0.05)。与对照组相比,治疗组小鼠大脑皮层和海马区Aβ斑块占比和Aβ斑块面积均显著降低,差异有统计学意义(P<0.05)。ELISA结果显示,与健康组相比,对照组小鼠脑组织炎性细胞因子IL-1β和TNF-α水平显著增高,而IL-10水平显著降低,差异均有统计学意义(均P<0.05)。与对照组相比,治疗组IL-1β和TNF-α水平均显著降低,而IL-10水平显著上升,差异均有统计学意义(均P<0.05)。见图1、表4~5。

图1 硫黄素S染色各组小鼠大脑皮层和海马区的Aβ沉积
表4 硫黄素S染色各组小鼠大脑皮层和海马区的Aβ沉积Table 4 Thioflavin S staining of Aβ deposition in the cerebral cortex and hippocampus of mice in each group

表4 硫黄素S染色各组小鼠大脑皮层和海马区的Aβ沉积Table 4 Thioflavin S staining of Aβ deposition in the cerebral cortex and hippocampus of mice in each group
组别大脑皮层斑块占比(%)斑块面积(mm2)海马体斑块占比(%)斑块面积(mm2)健康组0.99±0.22170.45±7.451.12±0.12100.31±4.41对照组1.92±0.23*234.34±4.34*2.45±0.45*171.32±5.34*治疗组1.45±0.19#200.32±2.32#1.65±0.12#130.21±3.31#F值28.328230.73834.887388.314P值<0.001<0.001<0.001<0.001
*P值<0.05与健康组比较 #P值<0.05与对照组比较(SNK-q检验)
表5 ELISA检测小鼠脑组织炎性细胞因子IL-1β、TNF-α和IL-10的含量Table 5 ELISA to detect the levels of inflammatory cytokines IL-1β, TNF-α and IL-10 in brain tissues of mice
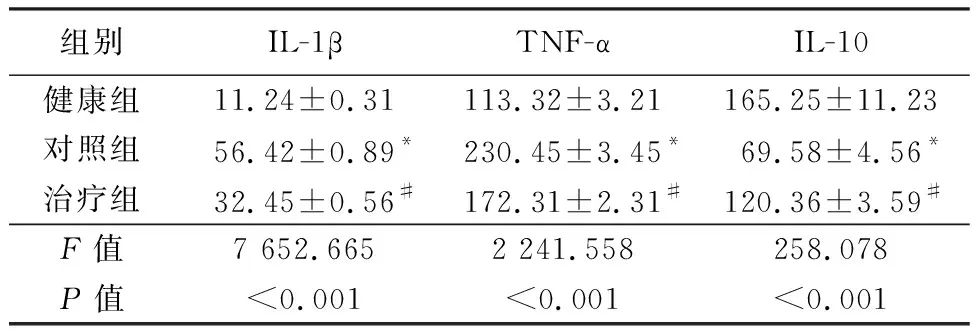
表5 ELISA检测小鼠脑组织炎性细胞因子IL-1β、TNF-α和IL-10的含量Table 5 ELISA to detect the levels of inflammatory cytokines IL-1β, TNF-α and IL-10 in brain tissues of mice
组别IL-1βTNF-αIL-10健康组11.24±0.31113.32±3.21165.25±11.23对照组56.42±0.89*230.45±3.45*69.58±4.56*治疗组32.45±0.56#172.31±2.31#120.36±3.59#F值7 652.6652 241.558258.078P值<0.001<0.001<0.001
*P值<0.05与健康组比较 #P值<0.05与对照组比较(SNK-q检验)
2.3GV-971降低AD小鼠BACE水平 qRT-PCR和Western blot对各组小鼠脑组织BACE1的表达检测结果显示,与健康组相比,对照组小鼠脑组织中BACE1的mRNA和蛋白水平均升高,差异均有统计学意义(P<0.05)。与对照组相比,治疗组小鼠大脑中BACE1的mRNA和蛋白表达下降,差异有统计学意义(P<0.05)。见表6、图2。
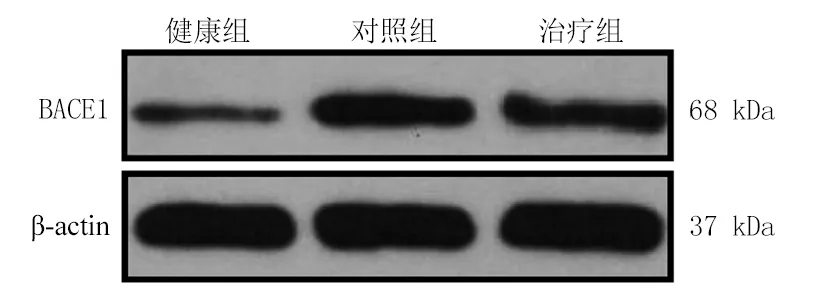
图2 Western blot检测各组小鼠脑组织中BACE1的蛋白水平
表6 qRT-PCR及Western blot检测各组小鼠脑组织中BACE1表达水平Table 6 qRT-PCR and Western blot to detect the expression level of BACE1 in the brain tissue of each group

表6 qRT-PCR及Western blot检测各组小鼠脑组织中BACE1表达水平Table 6 qRT-PCR and Western blot to detect the expression level of BACE1 in the brain tissue of each group
组别BACE1 mRNABACE1 蛋白健康组1.00±0.04 0.29±0.04 对照组2.01±0.05*0.54±0.04*治疗组1.45±0.05#0.41±0.01#F值698.27385.273P值<0.001<0.001
*P值<0.05与健康组比较 #P值<0.05与对照组比较(SNK-q检验)
3 讨 论
AD是患者常见慢性神经退行性疾病之一,其特征是认知和记忆的进行性恶化[9-10]。AD的组织病理学标志是含有Aβ的细胞外斑块和含有聚集的tau的细胞内缠结,以及选定脑区中的神经元和突触损失。区域差异性淀粉样β蛋白沉积已经在一些家族性AD导致APP和PS-1基因突变的转基因小鼠品系或同时表达突变APP和PS-1的双转基因小鼠中捕获[11]。
APP/PS1小鼠品系是广泛用于模拟AD的动物模型,并且具有人类AD的许多特征,包括炎症和突触可塑性[12]。在本研究中,9个月大的APP/PS-1转基因小鼠行为能力弱。APP可以进行非淀粉样变或淀粉样变加工,这取决于切割蛋白质的分泌酶[13],在淀粉样变形成过程中,APP被BACE-1酶切割,产生细胞外可溶性APP-β(sAPPβ)[14]。GV-971是一种被提出有新型作用机制的寡糖,在非临床研究中,GV-971通过调节肠道微生物群和减少可能加重神经炎症的外周炎症,显示了大脑神经炎症的减少GV-971直接与Aβ结合,减少Aβ在大脑中的沉积[15-19]。在一项为期36周的临床实验中,GV-971在改善认知方面表现出显著疗效,并在所有观察期内持续改善[20]。在本研究中APP/PS1小鼠经过GV-971治疗后,空间记忆及行动能力部分恢复,另外本研究显示GV-971能够抑制AD小鼠脑组织BACE-1的表达。BACE-1是生成Aβ的关键酶。在转基因AD动物模型中,肿胀和芽生轴突末梢,失营养性神经突起高表达BACE-1可能是导致局部Aβ生成增多和淀粉斑发展的关键因素[21]。因此推测GV-971可能具有降低sAPPβ水平的能力,由此能够下调APP加工从而减少Aβ的产生。
现已知,炎症在AD的病理学中起着重要作用[22]。神经炎症既可能是AD的发病原因,也可能是AD病理或与其相关的风险因素的结果,并通过加剧Aβ的沉积和Tau蛋白病变而增加疾病的严重性。本研究通过检测促炎因子TNF-α、IL-1β及抗炎因子IL-10的表达,探讨GV-971对AD小鼠神经炎症的影响。促炎细胞因子如TNF-α和IL-1β诱导空间记忆的损伤,根据淀粉样蛋白级联假说,Aβ沉积在老年斑块中并引发促炎反应,导致氧化应激、神经元变性和神经炎症[23]。TNF-α和IL-1β作为常见的促炎因子,是评价机体炎症水平的常用指标。TNF-α是一种多功能炎症细胞因子,能够刺激IL-6、IL-8等因子的生成,从而使机体产生持续存在的炎症反应。IL-10属于内源性抗炎介质,已被证实可以减轻Aβ1-42所致AD动物学习记忆功能减退。本研究结果显示,与野生型C57小鼠相比,APP/PS1小鼠促炎因子水平显著上升,而抗炎症因子水平显著下降,证实AD中的神经炎症反应。Mangalmurti等[24]研究表明,脑组织炎症反应与AD症状的发生密切相关,抑制炎症反应是治疗AD的关键。本研究显示,当APP-PS1小鼠经过GV-971治疗后,GV-971炎症水平下调,提示GV-971对AD小鼠神经炎症的抑制作用。Tang等[25]研究显示,LPS诱导的神经炎症可以上调BACE-1、APP和Aβ在脑内的表达,且过表达BACE-1可能对AD的发生具有促进作用。基于既往研究推测,GV-971可能通过降低BACE-1表达从而抑制神经炎症。
综上所述,初步推测GV-971介导BACE1对AD小鼠神经炎症进行调控,但BACE1调控机制复杂,在今后的研究中,将进一步探究BACE1影响AD小鼠神经炎症相关机制。

