国自然申报项目中知情同意书存在的问题及改进建议
□ 潘玲玲 PAN Ling-ling 陈旻 CHEN Min
In the process of application and implementation of the National Natural Science Foundation, ethical application and review is an important part. By sorting out the ethical materials of a Grade-A tertiary hospital in Fujian Province applying for the National Natural Science Foundation in 2022, this paper summarized the main problems existing in the informed consent form, and put forward possible countermeasures. Through publicity, education and standardized training for researchers,the ethical awareness of researchers should be improved. At the same time, the construction of ethics committees should be strengthened. The template of informed consent form should be further improved, and information management and process supervision should be strengthened to improve the quality of informed consent form and better protect the rights and interests of subjects.
随着我国健康事业的发展,国家对科技创新工作投入的增加以及研究人员对科研需求的增多,越来越多的临床医生投入到科学研究当中,国家自然科学基金(以下简称“国自然”)的申请量逐年上升[1],其中,涉及人的生物医学研究也与日俱增[2-3],这些研究涉及受试者的知情权、治疗权、补偿权和隐私权等,而取得受试者知情同意就是尊重和维护受试者权益最基本的方式,但由于研究人员对知情同意的认知不足、缺乏伦理委员会监管等原因[4-6],导致知情同意书内容存在诸多问题。本文拟收集福建医科大学附属第一医院(以下简称“我院”)2022 年申报的国自然中涉及人的医学研究项目,总结其申报过程中出现的伦理问题,进一步提出可能的解决措施,以提升研究者伦理意识,提高知情同意书质量,更好地保护受试者合法权益。
我院国自然伦理审查中知情同意书的常见问题及表现形式
2022 年国家自然科学基金委共接收我院185 项国自然申报项目,通过对伦理审查中发现的问题进行汇总和梳理,共总结了7 类问题如图1 所示。数据分析表明,在119 项涉及人的医学伦理项目中,有18 项缺乏伦理材料,占伦理问题总数的25.00%;有12 项混淆常规诊疗和研究干预、11 项知情同意书与研究方案不一致,分别占问题总数的16.67%、15.28%。
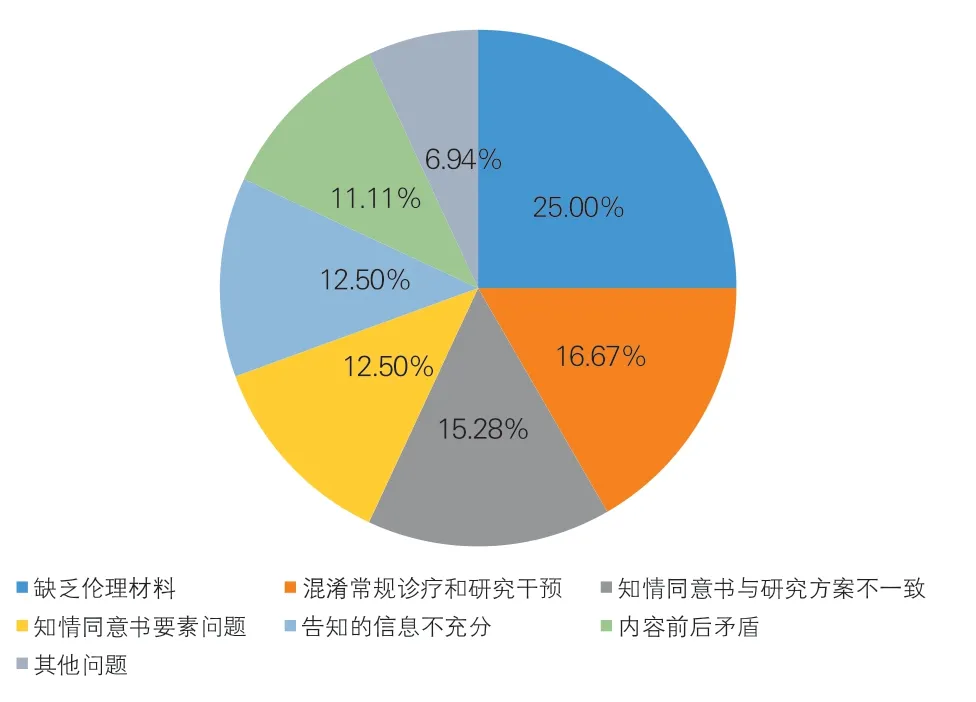
图1 2022年我院国自然申报项目伦理审查问题汇总
1.知情同意书认知问题。通过对国自然申报项目进行初审,发现有15 项研究方案提及使用人的样本信息,但研究者未提交伦理材料供伦理委员会审查。另有3 个项目申请者认为仅收集手术后废弃的组织样本进行检测分析,可以申请免知情同意。但这些项目仍可以联系到受试者,不应免知情同意。
2.知情同意书内容问题
2.1 常规诊疗和研究干预。审查发现有11 份知情同意书提到大量临床诊疗操作流程,实际上研究是收集常规诊疗操作后的数据资料。另有1 份知情同意书在风险部分描述了“植入刺激器”对受试者产生的风险,“植入刺激器”是该项目的临床诊疗操作,不是该研究的干预措施。研究者混淆了临床知情同意和研究知情同意,导致混淆了临床诊疗风险与研究风险。
2.2 知情同意书与研究方案不一致。部分国自然申请书的研究方案和知情同意书存在不一致问题,主要表现为:知情同意书中提到收集受试者的组织标本而研究方案却只字未提;研究方案和知情同意书中关于抽取血液的毫升数、组织克数等数据的描述不一致;研究方案是回顾性收集受试者的影像学资料,但知情同意书却描述成前瞻性收集受试者资料;知情同意书中有给受试者交通费、营养补贴等,但是研究方案里却没有相关的经费预算等。
2.3 知情同意书要素问题。因研究者对知情同意书中各要素的理解有误,审查发现知情同意书中最经常被研究者遗漏的要素是“可选择的其他诊疗方法”,其次是“补偿”。比如抽取受试者静脉血15mL×5 次,却不予任何补偿。另外,还有2 个项目把允许受试者随时退出写进“研究过程与方法”里,在“受试者可能的受益”里提到“费用”和“补偿”的内容,存在诱导受试者参与研究的嫌疑,而事实上这些内容也并非为受益。
2.4 知情同意书告知的信息不充分。审查中发现,知情同意书中关于必须告知的事项告知不充分,说明不全面,违背了“充分告知”原则。知情同意书中提到使用受试者的剩余组织标本,但是没有说明具体是什么组织的剩余标本。需要抽一些静脉血,没有写明抽血的量和次数等。缺乏研究者的联系方式或只留下科室的固定电话。
2.5 知情同意书内容前后矛盾。有8 份知情同意书在研究过程和方法里提到抽取受试者血液,这是研究的干预内容,存在一定的风险,但是后面的内容却表示该研究无干预,不存在风险,前后相互矛盾。
2.6 知情同意书其他问题。总体表现为语句不通顺,内容啰嗦冗长,出现错别字。知情同意书照搬研究方案的内容,充斥着大量专业术语和英文缩写,受试者阅读困难。也有个别计量单位使用不当,比如收集术后废弃股骨头组织的体积和提取腓肠肌的长度单位有误。
分析及建议
1.加强伦理宣传教育。不同于临床研究项目,科研管理部门会统一通知国自然项目申请者递交伦理材料,而且要提交的伦理材料相对简单,包括伦理申请表和知情同意书。审查发现,许多研究者使用了人的样本信息,但未提供伦理材料以供伦理委员会审查,这些研究者对伦理审查无概念。有些研究者认为观察性研究没有对受试者造成伤害或研究风险低于最小风险,故未对受试者进行知情同意[2,7]。另有一些研究者的知情同意书脱离研究方案,研究者伦理认知薄弱,应付伦理审查。
为了提高研究者的伦理意识,科研管理部门应加强伦理宣传教育[4-5]。科研管理部门可通过OA 资讯、微信等多种渠道进行宣传教育,在新员工入职岗前培训班和项目申报启动会上宣读伦理相关法规和制度要求,贯彻“生物医学研究必须通过伦理审查后才能开展”的理念。强调对于已经开展的研究,不予补申请伦理审查;对于已经投稿的论文,不予补申请伦理批件,及时刹住事后补伦理审批的不良风气。研究者通过强化理论学习,加强对伦理相关法规的研读,提高自身伦理素养;通过学习经典案例,养成在研究开展前自觉做好受试者知情同意工作的习惯。
2.进行规范化培训。国家基金资助项目的数量已成为衡量一家医院综合实力和科研水平的重要指标[8]。为此,各医疗机构广泛动员本单位人员积极申报,有的将申报数纳入科室绩效考核指标。为了完成考核指标,部分研究者敷衍了事,递交的知情同意书质量堪忧,有的研究者直接照搬临床知情同意,提及大量常规诊疗操作及其带来的风险,混淆了研究知情同意与临床知情同意。由于研究者的不严谨,知情同意书告知的信息不充分,内容前后矛盾以及出现其他细节问题,容易引起受试者的不信任。
针对以上这些问题,一方面要通过培训提高撰写知情同意书的能力,另一方面要通过限制申报项目提高研究者的配合度[9-10]。科研管理部门可以针对科研项目伦理审查重点开展规范化培训,包括伦理申请流程和知情同意书撰写。同时对审查不通过的督促修改到位,否则限制其申报各级各类课题,促使研究者重视伦理审查。
3.完善知情同意书模板。知情同意书中出现的要素问题和告知信息不充分等问题,提示要不断完善知情同意书模板。国家基金主要资助基础性研究,我院涉及人的伦理的项目一般是利用人体剩余组织标本信息,因此可以根据这个特点制定统一的知情同意书范本,解决常见的共性问题,既方便研究人员写出合格的知情同意书[9],又减轻了伦理秘书的工作量,提高伦理审查效率。
4.重视伦理委员会建设。涉及人的医学研究日益增多以及基金申报的时限性,均给伦理委员的审查能力提出了新的考验[2,11]。研究者不重视伦理审查,提交的伦理材料问题频出,伦理委员会应加大审查力度,对存在问题较多的项目加强监管,并要求修改后重新审查通过才能立项[10]。一项针对北京地区三级医疗机构开展的调查[2]显示,伦理委员会普遍存在人手不足的情况。目前,医院伦理委员会大多挂靠科研、医务等职能部门,委员由临床科室的医生兼任,少有全职人员和伦理学专业人员,委员审查能力参差不齐,对伦理材料审查要求的理解和掌握水平不一[12]。
为了保障伦理委员会高效运作,严格落实伦理法规,加大对伦理材料的审查力度。首先,应建设一支经验丰富的多学科专家团队,并定期进行培训和考核,确保能对伦理材料进行专业高效的审查,同时能提供伦理培训和咨询服务。其次,伦理秘书应具备伦理审查的经验,可以对伦理申请材料进行初审,对不合格材料进行初筛,减轻伦理委员的负担[11]。
5.推动伦理审查信息化。一项针对国自然申请者的全国性抽样调查数据显示,22.9%的研究者认为伦理审查消耗了科研人员太多的时间和精力[13]。为了减少因伦理材料不合格导致的多次跑腿,减少准备材料花费的时间精力,提高研究者的配合度,应积极推动伦理审查信息化建设,提高伦理审查的便捷性和连续性[2]。传统的伦理审查,伦理审查和后续的立项审查脱节时有发生。部分项目在申报阶段无需提交伦理批件,等课题立项后再进行正式伦理审查,导致有些项目未经过伦理审批直接立项开展[9,12]。另有一些研究者发起的临床研究经过伦理审批后直接开展,未经过立项审查。
为了促进伦理审查与立项审查的有效衔接,应推动伦理审查信息化建设[9]。为此,我院利用临床试验管理系统(clinical trial management system,CTMS)使伦理审查和立项审查无缝衔接,为研究人员提供研究项目科学审查与伦理审查一站式服务。传统的线下审查,伦理秘书在反馈伦理委员会审查意见时要花费较多时间进行沟通,伦理委员在收到研究者递交的修改后材料时要重新审阅。而且纸质档案管理存在储存空间大,档案调阅流程繁琐,档案管理不规范,不方便伦理跟踪检查等问题。在CTMS 系统中,委员可随时随地进行线上审阅并修订留痕,节约了秘书的协调沟通成本。伦理审查通过的项目再提交立项审查,这种联动方式会自动跟踪提醒研究者准备后续的立项审查,也减少重复报送材料,提高研究者主动申请伦理的意愿。所有的伦理申请材料和委员审查意见均以数字化形式归档,降低档案整理、储存与管理成本。将伦理档案电子化,方便管理人员检索查阅,也方便伦理委员会进行实时监管[2]。
6.健全伦理全过程监管。借助信息化管理平台,伦理委员会不仅能在项目申报阶段对知情同意书进行审查,还可以在项目执行过程中,对研究方案是否修改、知情同意执行情况等进行跟踪审查。伦理委员会的全过程监管可以使研究者在研究过程中受到伦理约束,保障受试者的权益在研究全过程中得到有效落实[2]。另外,应强化伦理委员会与立项管理部门的协同性监管[9],在研究立项前,涉及人的医学研究应具备伦理批件方可获批立项。为了防止研究者通过初始审查后,在项目执行过程中未签署知情同意,或履行不到位,在课题中期检查时,伦理委员会应同步进行伦理跟踪审查,结题验收时要提供伦理结题审查批件方可验收通过[12]。
小结
近些年来,随着新版《药物临床试验质量管理规范》[14]《涉及人的临床研究伦理审查委员会建设指南(2020 版)》[15]等规范的修订,进一步强调维护受试者的合法权益,因此对知情同意的要求越来越严格,也对研究者和伦理委员会提出了更高的要求。针对我院国自然申报项目伦理审查发现的问题,提出相应的建议,研究者要提高伦理意识,加强伦理学习与培训,科研管理部门要加强伦理委员会建设,完善知情同意书模板,伦理委员会要借助信息化管理系统加强伦理审查力度和全过程监管,从而提高国自然以及其他科研项目伦理材料的质量,促使我院科学研究在科学和伦理两架马车的引领下行稳至远。

