胸腔积液癌细胞EGFR基因突变与NSCLC患者>外周血NLR、LMR的关系
南阳光, 朱晓明, 付海琴, 江美兵, 唐伟, 周俊
宣城市中心医院呼吸内科,安徽宣城 242000
目前,靶向治疗逐渐发展成为治疗非小细胞肺癌(non-small cell lung cancer,NSCLC)的主要手段,吉非替尼治疗表皮生长因子受体(epidermal growth factor receptor,EGFR)基因具有敏感突变的局部晚期NSCLC或转移性NSCLC效果显著[1]。多数NSCLC患者因各种因素导致难以对肿瘤组织进行EGFR基因检测,故寻找EGFR检测的替代组织样本具有重要临床意义。胸腔积液采集方便,对患者影响较小,因此胸腔积液癌细胞EGFR基因检测逐渐被应用于临床,但其与肺癌肿瘤组织样本可能存在差异[2]。既往研究报道,外周血中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)、淋巴细胞/单核细胞比值(lymphocyte/monocyte ratio,LMR)在鉴别肺腺癌EGFR基因突变及病理亚型方面有一定的参考价值[3]。基于此,本研究拟探讨胸腔积液癌细胞EGFR基因突变状态与NSCLC患者外周血NLR、LMR水平的关系,现报道如下。
1 资料和方法
1.1 一般资料
选取本院2020年4月—2022年4月收治的伴有胸腔积液的NSCLC患者82例,男45例,女37例,年龄(62.14±7.07)岁,吸烟史40例;根据患者是否有胸腔积液癌细胞EGFR基因突变分为突变组和野生组。纳入标准:符合NSCLC相关诊断标准[4],经病理确诊为NSCLC;均可进行肺部穿刺采集胸腔积液;患者及其家属愿意配合完成本研究,并签署知情同意书。排除标准:入组前已接受放化疗或分子靶向治疗;存在其他恶性肿瘤史;存在其他感染性疾病;存在血液系统障碍疾病;存在自身免疫性疾病。本院医学伦理委员会已对本研究进行审核,并批准通过。收集所有患者性别、年龄、吸烟史、病理分型、肿瘤位置等临床资料。
1.2 Sanger测序法检测EGFR基因突变
入组后抽取新鲜胸腔积液样本15 mL,2 000 r/min离心10 min,去除上清液,保留沉渣。将沉渣进行石蜡包埋,切取石蜡切片,经HE染色及免疫组化染色后高倍镜下观察有无肿瘤细胞。使用Qiagen DNA提取试剂盒提取胸腔积液癌细胞DNA,采用紫外分光光度仪进行检测。采用Sanger测序法检测EGFR基因18~21外显子突变。所有操作严格按照试剂盒说明书执行。
1.3 全自动血细胞分析仪检测外周血NLR、LMR水平
入组后采集空腹静脉血5 mL,使用贝克曼LH 750全自动血细胞分析仪检测外周血淋巴细胞计数、中性粒细胞计数、单核细胞计数水平,试剂盒均为贝克曼配套试剂盒。所有操作严格按照试剂盒说明书执行。计算NLR和LMR水平。
1.4 统计学方法
2 结 果
2.1 两组临床特征的比较
82例NSCLC患者中胸腔积液癌细胞出现EGFR突变共24例(29.27%),其中18外显子点突变2例,19外显子缺失突变7例,20外显子点突变3例,21外显子点突变12例。EGFR基因突变与肿瘤位置有关系,周围型者EGFR基因突变率较中央型高(P<0.05;表1),与其他临床特征无关系(P>0.05;表1)。

表1 两组临床特征的比较
2.2 EGFR基因突变与外周血NLR、LMR水平的关系
EGFR基因突变型者外周血NLR水平低于野生型者,LMR水平高于野生型者(P<0.05;表1)。ROC曲线分析以截断值为临界水平,将患者分为NLR低水平和高水平、LMR高水平和低水平,NLR低水平、LMR高水平患者胸腔积液癌细胞EGFR基因突变率较高(P<0.05;表2)。
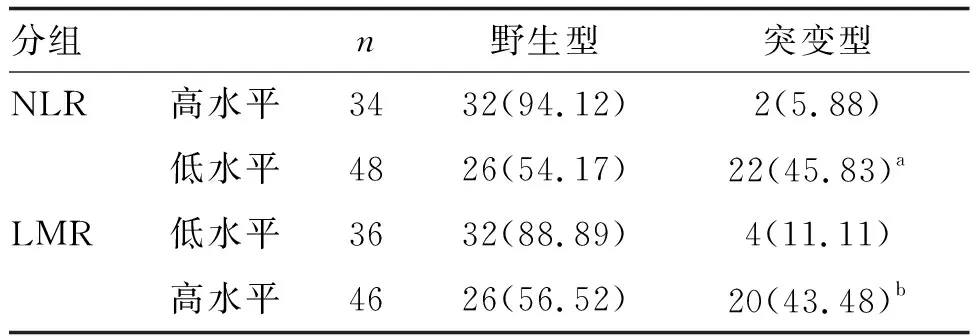
表2 EGFR基因突变与外周血NLR、LMR水平的关系 例(%)
2.3 ROC曲线分析NLR、LMR诊断EGFR基因突变的效能
以是否EGFR基因突变为状态变量(EGFR突变型=1,EGFR野生型=0),NLR、LMR为检验变量,ROC曲线分析显示(图1),NLR诊断EGFR基因突变的曲线下面积(area under curve,AUC)为0.731(95%CI 0.622~0.823),约登指数为0.468,截断值为2.02,灵敏度为91.67%,特异度为55.17%。LMR诊断EGFR基因突变的AUC为0.743(95%CI 0.635~0.833),约登指数为0.385,截断值为5.50,灵敏度为83.33%,特异度为55.17%。

图1 外周血NLR、LMR诊断EGFR基因突变的ROC曲线图
3 讨 论
靶向治疗是肺癌领域在近10年来突出的进展,也就是针对肺癌细胞本身特有的基因变化采用的治疗手段[5]。EGFR基因靶向治疗药物的出现给晚期NSCLC的治疗带来革命性变化。EGFR-TKI已成为EGFR敏感突变NSCLC患者的一线(首选)标准治疗方案[6]。手术切除标本是检测EGFR基因突变的最佳样本,但是对于晚期病人缺乏手术的指征,不能通过手术获取切除标本,因此,寻找能够替代进行EGFR检测的有效样本已成为临床研究的热点。胸腔积液是晚期肺癌患者常见的并发症之一,胸水标本获取比较简单、安全。国内外研究报道,恶性肿瘤患者胸腔积液可用于EGFR基因突变检测,其结果可指导临床EGFR-TKI使用[7-8]。本研究对82例NSCLC患者胸腔积液癌细胞进行EGFR基因突变检测,结果发现,EGFR总突变率为29.27%,且21外显子点突变比例最高。
本研究发现,胸腔积液癌细胞EGFR基因突变与患者性别、年龄、吸烟史、病理分型无显著关系,与肿瘤位置相关,周围型NSCLC患者胸腔积液癌细胞EGFR基因突变率较中央型高。梅馨方等[9]的研究报道,女性、未吸烟、腺癌、周围型NSCLC患者更易发生EGFR基因突变。本研究与上述报道部分一致,可能是由于本研究为胸腔积液癌细胞EGFR基因检测,可能与肿瘤组织差异有一定的关系,且本次纳入样本数量较少,也可能存在数据偏倚,后期需进一步采用多中心、大样本临床试验进行深入验证。
NLR、LMR是系统性炎症的简单生物标志物,目前已被证实是包括前列腺癌、肾癌、胃癌、脑癌和胸腺上皮性肿瘤在内的几种实体癌的预后标志物[10]。本研究发现,EGFR基因突变型患者外周血NLR水平低于EGFR基因野生型,LMR水平高于EGFR基因野生型,与徐朝娜等[11]报道基本一致,提示胸腔积液癌细胞EGFR基因突变状态与外周血NLR、LMR水平存在一定关联。本研究ROC曲线分析结果显示,外周血NLR、LMR水平对EGFR基因突变有较好诊断价值,进一步提示控制胸腔积液癌细胞EGFR基因突变可能会对NSCLC患者病情发展起到一定控制作用。
本研究ROC曲线分析结果显示,NLR低水平、LMR高水平患者胸腔积液癌细胞EGFR基因突变率较高,再次提示胸腔积液癌细胞EGFR基因突变状态与NSCLC患者外周血NLR、LMR水平有一定的关系。既往研究报道,炎症指标LMR、NLR与NSCLC患者EGFR突变具有相关性,LMR对EGFR突变有一定的预测价值,且优于NLR[12]。本研究结合上述报道,提示外周血NLR、LMR水平可能会对EGFR基因突变造成一定影响,但具体作用机制仍需后期验证。
综上所述,胸腔积液癌细胞EGFR基因突变状态与NSCLC患者外周血NLR、LMR水平可能存在一定的关联,且NLR低水平者、LMR高水平者更易发生EGFR基因突变。本研究为单中心研究、样本数量较少,可能存在数据偏倚,后期需深入探讨。

