钙蛋白酶在TOCP诱导人神经母细胞瘤SH-SY5Y细胞自噬中的调节作用
石晟源, 肖双, 胡泽慧, 龙鼎新
南华大学衡阳医学院公共卫生学院 典型环境污染与健康危害湖南省重点实验室,湖南衡阳 421001
三邻甲苯基磷酸酯(tri-ortho-cresyl phosphate,TOCP)为一种有机磷酸酯类化合物,由于其暴露途径多、毒性高及人类对其毒性作用认识不足,TOCP中毒事件在世界各地均有报道[1]。研究发现,自噬在TOCP诱导的神经毒性、生殖毒性中发挥关键作用[2],但确切作用机制并未完善。钙蛋白酶系统主要由μ-钙蛋白酶、m-钙蛋白酶和钙蛋白酶抑制素构成。μ-钙蛋白酶和m-钙蛋白酶都是钙依赖性蛋白酶,均可被Calpastatin特异性抑制[3]。45Ca吸收试验表明,TOCP增加了母鸡脑突触体对钙的摄取[4],钙通道阻滞剂维拉帕米(Verapamil)可消除TOCP增强的细胞器蛋白的磷酸化[5],而暴露于TOCP的母鸡大脑表现出细胞溶质钙浓度水平升高[6]。动物模型也证明,TOCP可激活钙蛋白酶[7],线粒体自噬也与钙蛋白酶相关[8]。因此,钙蛋白酶可能与TOCP诱导的自噬机制相关。与未分化细胞相比,分化的SK-N-SH细胞的tau、MAP、神经丝蛋白表达显著增加[9-10],本研究以未分化和分化的SH-SY5Y细胞作为实验对象,探讨钙蛋白酶对TOCP诱导的自噬的调节作用,为揭示TOCP诱导的神经毒性机制提供实验依据。
1 材料和方法
1.1 材料与试剂
人神经母细胞瘤SH-SY5Y细胞系来自中国科学院动物研究所(中国,北京)。DMEM培养基、全反式维甲酸(all-trans-retinoicacid,ATRA)、钙蛋白酶抑制肽ac184-210(Calpastatin)、3-甲基腺嘌呤(3-methyladenine,3-MA)、TritonX-100、盐酸维拉帕米(Verapamil Hydrochloride)、TOCP、兔抗LC3多克隆抗体(L8918)、小鼠抗Beclin1单克隆抗体、小鼠抗β-肌动蛋白单克隆抗体购自Sigma公司(美国,圣路易斯)。荧光钙蛋白酶底物Suc-LLVY-AMC(P-802)购自Enzolifesciences公司(瑞士,劳森)。2-APB购自阿拉丁公司(中国,上海)。HRP偶联山羊抗小鼠IgG(H+L)和HRP偶联山羊抗兔IgG(H+L)购自ZSGB-BIO公司(中国,北京)。
1.2 细胞培养和分化
SH-SY5Y细胞在含有10%胎牛血清、100 IU/mL青霉素和100 mg/L链霉素的DMEM中培养,37 ℃、5%CO2饱和湿度下孵育,每2天更换培养基,每3~4天进行传代培养。培养皿用锡箔纸包裹,用含10 μmol/L ATRA的DMEM培养基诱导细胞分化6天,使用倒置相差显微镜观察细胞。如果细胞出现至少1个比细胞体长的突起,则认为细胞已分化,可被视为神经突。倒置显微镜随机选择视野测量至少100个细胞最长神经突的长度。
1.3 细胞处理和分组
分化和未分化的SH-SY5Y细胞用0~1.0 mmol/L TOCP处理12~48 h,用磷酸盐缓冲盐水(137 mmol/L NaCl、2.7 mmol/L KCl、10 mmol/L Na2HPO4、2 mmol/L KH2PO4、pH7.4)洗涤2次。分化和未分化细胞用20 μmol/L Verapamil或100 μmol/L 2-APB或20 μmol/L Verapamil+100 μmol/L 2-APB预处理15 min,然后用1.0 mmol/L TOCP处理48 h。分化和未分化细胞用1.0 mmol/L 3-MA预处理4 h或用500 nmol/L Calpastatin预处理6 h,然后用1.0 mmol/L TOCP处理48 h。Calpastatin和3-MA在使用前30 min溶解在DMEM中,其他试剂用DMSO溶解,细胞用0.4%DMSO处理作为对照组。
1.4 荧光分光光度法检测钙蛋白酶活性
先用20 μmol/L Verapamil或100 μmol/L 2-APB预处理15 min,然后用1.0 mmol/L TOCP处理48 h。然后,用含有1 mmol/L Na3VO4的冰冷PBS洗涤细胞2次,并在含有50 mmol/L HEPES(pH7.6)、150 mmol/L NaCl、1%TritonX-100、10 mmol/L 2-巯基乙醇、0.1 mmol/L PMSF和10 mg/L亮肽素的缓冲液中裂解30 min,4 ℃ 12 000 g/min离心15 min,留上清液,采用BCA法进行蛋白定量,将等体积的裂解物与50 μmol/L钙蛋白酶底物Suc-LLVY-AMC在Hanks平衡盐溶液中稀释至200 μL,并在37 ℃下孵育15 min。加入100 μL 0.4 mol/L HCl终止反应,荧光分光光度计RF5301(日本岛津公司)在380 nm和460 nm的激发和发射波长下测量荧光。使用BCA蛋白质定量试剂盒测定蛋白含量。为了计算相对钙蛋白酶活性,将荧光增加率除以蛋白质浓度并归一化为基础活性。
1.5 Western blotting检测自噬相关蛋白表达情况
细胞以1×107个/90 mm培养皿接种,在不存在或存在20 μmol/L Verapamil、100 μmol/L 2-APB、1.0 mmol/L 3-MA和500 nmol/L Calpastatin的情况下,用1.0 mmol/L TOCP处理48 h。Western blotting检测细胞LC3和Beclin1水平。用冷PBS洗涤细胞2次,制备细胞提取物,在缓冲液(50 mmol/L Tris-HCl、0.15 mol/L NaCl、1% TritonX-100、0.1%SDS、1%去氧胆酸钠、1 mmol/L EDTA和1 mmol/L PMSF、pH7.4)中裂解30 min。将裂解物以14 000 g/min离心10 min,并使用BCA法测定蛋白含量。将裂解物(80 μg总蛋白)在15%SDS-聚丙烯酰胺凝胶上进行电泳,然后转移至Hybond ECL硝化纤维素膜并用一抗(1∶1 000稀释)4 ℃孵育过夜。洗膜,加入辣根过氧化物酶标记的二抗(1∶5 000稀释)孵育。使用标准ECL方法检测蛋白质印迹。
1.6 统计学分析
2 结 果
2.1 未分化和分化的SH-SY5Y细胞
用含有10 μmol/L ATRA的DMEM培养基诱导细胞分化3天,观察到SH-SY5Y细胞出现分化现象(图1)。
图1 显微镜观察SH-SY5Y细胞(100×)
2.2 TOCP增加未分化和分化的SH-SY5Y细胞中钙蛋白酶活性
未分化SH-SY5Y细胞在1.0 mmol/L TOCP处理24 h后,钙蛋白酶活性开始显著增加,分化细胞12 h后钙蛋白酶活性即开始显著增加;未分化和分化的SH-SY5Y细胞钙蛋白酶活性均表现为浓度依赖性和时间依赖性增加(P<0.05,P<0.01;图2)。
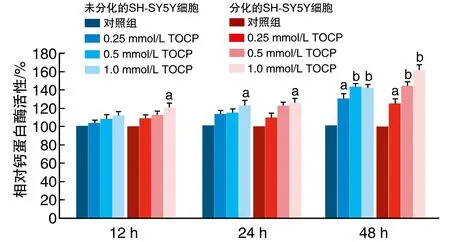
图2 TOCP上调未分化和分化的SH-SY5Y细胞钙蛋白酶活性a为P<0.05,b为P<0.01,与对照组比较。n=3。
2.3 钙蛋白酶抑制剂缓解TOCP在未分化和分化的SH-SY5Y细胞中诱导的自噬
透射电镜下,1.0 mmol/L TOCP处理48 h的SH-SY5Y细胞胞质中出现明显自噬泡的形成,呈现聚集的空泡或液泡(蓝色箭头),提示TOCP确实能够诱发SH-SY5Y细胞自噬的发生(图3A)。实验浓度下钙蛋白酶抑制剂并不影响未分化和分化SH-SY5Y细胞的形态(图3B)。1.0 mmol/L TOCP处理48 h后,未分化、分化的SH-SY5Y细胞LC3-II和Beclin1表达增加(P<0.01);Calpastatin可以部分降低TOCP在未分化、分化的SH-SY5Y细胞中诱导的LC3-II和Beclin1的表达(P<0.05,P<0.01;图3C和D);表明TOCP诱导的自噬受钙蛋白酶激活的调节。

图3 钙蛋白酶抑制剂缓解TOCP在未分化和分化的SH-SY5Y细胞中诱导的自噬A为SH-SY5Y细胞的超微结构(8 000×),蓝色箭头为自噬泡;B为钙蛋白酶抑制剂对SH-SY5Y细胞形态的影响(100×);C和D分别为未分化和分化SH-SY5Y细胞LC3-II、Beclin1的表达。a为P<0.05,b为P<0.01,与DMSO组比较;c为P<0.05,d为P<0.01,与TOCP组比较。n=3。
2.4 钙通道阻滞剂在未分化和分化的SH-SY5Y细胞中抑制钙蛋白酶活性
与TOCP组比较,Verapamil和2-APB处理后,未分化和分化的SH-5Y5Y细胞均观察到钙蛋白酶活性显著降低(P<0.01;图4)。但Verapamil+2-APB+TOCP组并没有较Verapamil+TOCP组和2-APB+TOCP组进一步降低(图4)。这些结果表明,TOCP通过外部钙流入和内质网释放的钙离子等钙紊乱激活钙蛋白酶活性。

图4 钙通道阻滞剂抑制TOCP诱导的SH-SY5Y细胞钙蛋白酶活性上调a为P<0.05,b为P<0.01,与DMSO组比较;c为P<0.05,d为P<0.01,与TOCP组比较。n=3。
2.5 钙通道阻滞剂调节TOCP在未分化和分化的SH-SY5Y细胞中诱导的自噬
图5A为钙通道阻滞剂作用下分化和未分化SH-SY5Y细胞的形态。在Verapamil预处理的未分化和分化SH-SY5Y细胞中,TOCP诱导的LC3-II表达完全抑制(P<0.01)。然而,2-APB并未降低TOCP诱导的LC3-II水平,未分化SH-SY5Y细胞的LC3-II表达与TOCP组比较无统计学意义;相反,在分化的SH-SY5Y细胞中,与TOCP组相比,LC3-II表达被2-APB显著上调(P<0.01);在未分化和分化的SH-SY5Y细胞中,Verapamil+2-APB+TOCP组显示出部分抑制作用(P<0.05;图5)。以上表明TOCP诱导的细胞自噬可能与细胞内钙紊乱导致钙蛋白酶激活相关。

图5 钙通道阻滞剂调节TOCP在未分化和分化的SH-SY5Y细胞中诱导的自噬A为钙通道阻滞剂作用下SH-SY5Y细胞的形态(100×);B和C分别为未分化和分化SH-SY5Y细胞LC3-II的表达。a为P<0.05,b为P<0.01,与DMSO组比较;c为P<0.05,d为P<0.01,与TOCP组比较。n=3。
3 讨 论
TOCP在工业上应用广泛,由于人们对其认识不足,TOCP中毒事件常有报道。TOCP的毒作用机制至今未能完全阐明,近年来,自噬机制作为研究热点受到广泛关注[11]。相关研究发现,TOCP可增加分化和未分化SH-SY5Y细胞的自噬活性[12-13],但TOCP如何诱导自噬的详细机制仍未阐明。细胞在分化过程中形态和功能将出现一定的变化。本研究发现,TOCP处理导致钙蛋白酶呈浓度和时间依赖性激活,分化细胞比未分化细胞对TOCP的处理更敏感,提前出现钙蛋白酶升高,但在整体趋势上并无统计学差异。
钙蛋白酶在细胞周期、细胞骨架重塑、自噬、细胞凋亡等生理过程中发挥着重要调节作用[3],在异丙酚通过d-天冬氨酸受体抑制肿瘤坏死因子-α介导的海马神经元自噬机制中,m-钙蛋白酶发挥着关键作用[14]。自噬过程的发生主要包括自噬信号诱导、囊泡成核、自噬体延长封闭、自噬体与溶酶体融合并对底物进行降解[15],吞噬细胞膜扩张和ATG5与钙蛋白酶切割相关[16]。研究发现,抑制钙蛋白酶可恢复自噬活性并防止线粒体断裂[17],钙蛋白酶通过促进感染后的自噬调节CVB3诱导的病毒性心肌炎[18],钙蛋白酶6在炎症环境中也能抑制自噬[19],而缺血诱导的钙蛋白酶1激活会损害溶酶体功能并抑制自噬体形成[20]。在神经退行性疾病的治疗中,钙蛋白酶抑制剂将受到重视[21],Calpain-1 C2L结构域肽已发挥抗氧化作用[22]。然而导致钙蛋白酶活性变化的原因众多,内源性蛋白Calpastatin作为Calpain 1和2的特异性抑制剂,已在研究中广泛使用。3-MA是一种特异性自噬抑制剂,通过Ⅲ类PI3K通路抑制自噬体的形成,可显著抑制TOCP诱导的LC3-II和Beclin1的表达。本研究中,3-MA处理作为抑制自噬的阳性对照,结果发现钙蛋白酶抑制剂Calpastatin可以抑制未分化和分化的SH-SY5Y细胞中TOCP诱导的自噬水平,提示TOCP可以在未分化和分化的SH-SY5Y细胞中通过影响钙蛋白酶活性而调节自噬。
同样,由于钙蛋白酶是钙依耐性的,钙蛋白酶活性增加可能是钙水平升高和钙蛋白酶抑制素丰度降低的结果[23],细胞钙稳态将直接影响钙蛋白酶的活性。而TOCP会扰乱细胞内钙含量,钙可以通过胞外流入细胞质。T型和L型钙通道是质膜上电压门控钙通道,Verapamil通过抑制T型和L型钙通道保护细胞器蛋白免受TOCP诱导的磷酸化[5]。钙也可以由内部钙储存库释放进入细胞质,即可通过兰尼碱受体和肌醇三磷酸(inositol triphosphate 3,IP3)受体激活而引起内钙释放增加。兰尼碱受体钙通道在心肌和骨骼肌中占主导地位,IP3受体不断介导钙从内质网释放,而2-APB是一种IP3受体拮抗剂。研究发现,Piezo1介导细胞外Ca2+内流导致细胞内钙过载,从而导致钙蛋白酶的激活[24]。本实验通过维拉帕米和2-APB阻断钙通道后发现,SH-SY5Y细胞钙蛋白酶活性受到抑制。钙是细胞信号转导中重要一环。据报道,钙信号可以调节自噬[25-27]。内质网中Ca2+的减少会激活钙释放激活钙(Ca2+release activated Ca2+,CRAC)通道,导致胞外Ca2+内流,高浓度2-APB通过抑制CARC电流限制胞质钙离子补充。当同时用Verapamil和2-APB预处理时,钙蛋白酶活性未出现进一步下降,可能是由于在Verapamil和2-APB分别处理时,钙蛋白酶活性已降至最低。上述结果表明,外部钙流入和内部钙储存释放所导致的胞质内钙含量升高是TOCP诱导钙蛋白酶激活的原因之一。自噬相关蛋白LC3-II的检测结果提示,Verapamil可以抑制TOCP诱导的自噬。因此,钙蛋白酶调节由TOCP诱导的自噬可归因于通过电压门控钙通道的外部钙流入。然而,2-APB在分化的SH-SY5Y细胞中增加了TOCP的自噬水平,可能是由于2-APB不是特异性IP3受体抑制剂,还能通过影响钙库操作的钙通道和SERCA泵调节自噬。
综上,TOCP通过调节电压门控钙通道和IP3受体钙通道上调钙蛋白酶活性,进而导致SH-SY5Y细胞自噬。

