糖化血红蛋白指数升高增加颈动脉斑块风险
韦 莹 王 广
(首都医科大学附属北京朝阳医院内分泌科,北京 100020)
糖化血红蛋白(hemoglobin A1c,HbA1c)可以反映糖尿病患者2~3个月内的血糖控制情况,已经被美国糖尿病协会(American Diabetes Association,ADA)作为糖尿病的诊断指标之一[1]。近期有研究[2-3]表明,即使血糖控制水平相当,一些患者的HbA1c实际测量值仍存在个体差异。因此,有研究[4]提出可以利用糖化血红蛋白指数(hemoglobin glycation index,HGI)来量化不同个体间的HbA1c差异:先将HbA1c与空腹血糖做线性回归分析,得到方程式,然后将空腹血糖值代入方程式后得出预测HbA1c的数值,实测HbA1c与预测HbA1c的差值即为HGI。既往研究[5-8]表明,HGI和心血管代谢指标具有一定的相关性,包括肥胖、血脂、尿酸、胰岛素抵抗等。HGI也被发现和糖尿病患者的微血管并发症(包括糖尿病视网膜病变、糖尿病肾病)[9]、心血管事件(包括心血管原因死亡、非致死性心肌梗死或非致死性卒中)、外周动脉疾病[10]等相关。有研究[11]纳入了423名糖尿病患者,结果显示HGI和冠状动脉性心脏病的严重程度相关,高HGI的糖尿病患者多支血管病变的比例增加。在非糖尿病患者中,HGI也可增加冠状动脉钙化以及肝脂肪变性的风险[7,12]。但目前关于HGI与颈动脉粥样硬化斑块的研究较少,目前仅有一篇文章[5]结果显示HGI和颈动脉内中膜厚度(intima-media thickness,IMT)独立相关,但该研究的研究对象为387名糖尿病白种人的非糖尿病后代,人群较为局限。因此,为了进一步研究HGI对心血管疾病的影响,本研究拟在中国更大的横断面研究中进一步探索HGI与颈动脉斑块之间的关系。
1 对象与方法
1.1 研究对象
研究对象为2016年4月至2021年8月在首都医科大学附属北京朝阳医院进行健康体检的成人(年龄≥18岁)。排除标准:①未进行颈动脉超声检查者;②空腹血糖及糖化血红蛋白数据缺失者;③严重肾功能或肝功能不全者[估算肾小球滤过率(estimated glomerular filtration rate,eGFR)<60 mL/(min·1.73 m2), 或丙氨酸氨基转移酶或门冬氨酸氨基转移酶超过正常上限3倍]。最终纳入1 106名研究对象进行分析。所有研究对象均已签署知情同意书。本研究已通过首都医科大学附属北京朝阳医院伦理委员会批准(伦理批号2022-科-517)。
1.2 资料收集
由专业的医师收集所有研究对象的年龄、性别、体质量、身高和病史(包括高血压、糖尿病、高脂血症)等信息。非同日两次测量收缩压≥140 mmHg (1 mmHg=0.133 kPa)或舒张压≥90 mmHg,或患者正在服用降压药,则诊断为高血压[13]。高脂血症定义为总胆固醇(total cholesterol,TC)≥5.2 mmol/L,或三酰甘油(triglyceride,TG)≥1.7 mmol/L,或低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)≥3.4 mmol/L,或高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)<1.0 mmol/L,或非高密度脂蛋白胆固醇(non-high density lipoprotein-cholesterol,non-HDL-C)≥4.1 mmol/L[14]。糖尿病定义为:空腹血糖≥7.0 mmol/L或随机血糖≥11.1 mmol/L且有典型高血糖症状或正在服用降糖药[1]。清晨空腹(禁食8 h以上)采集研究对象的静脉血,于首都医科大学附属北京朝阳医院检验科由专业人员按照规范操作检测血肌酐、空腹血糖(fasting blood glucose,FBG)、HbA1c、TC、TG、LDL-C、HDL-C、尿酸等。eGFR通过慢性肾疾病流行病学合作公式(Chronic Kidney Disease Epidemiology Collaboration equation)计算[15]。颈动脉超声检查由具有资质的超声医生完成,采用高分辨率B型超声测量颈动脉内中膜厚度,局限性增厚≥1.2 mm定义为颈动脉斑块形成[16]。
1.3 HGI测定
在所有研究人员中,将HbA1c与空腹血糖做回归分析,得到线性回归方程式:预测HbA1c(%)=2.87+FBG(mmol/L)×0.49。然后将研究对象的空腹血糖值代入方程式得出预测HbA1c的数值,最后计算HGI=实测HbA1c-预测HbA1c[3]。本文将所有人群按照HGI(%)三分位数分成3组:Q1:[-6.29,-0.194], Q2:(-0.194,0.118], Q3:(0.118,3.88].
1.4 统计学方法

2 结果
2.1 各个HGI亚组基本信息比较
如表1所示,本研究共纳入1 106位参与者。HGI高分位组(Q3)中45岁以上人数明显增多。同时,Q3组呈现更明显的代谢异常,表现为:高血压、高脂血症、糖尿病所占人数的比例更多,TC、TG、LDL-C水平最高(P<0.05)。Q3组人群中具有颈动脉斑块的比例也最高(Q1∶Q2∶Q3为23.8%vs23.9%vs39.6%,P<0.001)。HGI低分位(Q1)组FBG最高,而HbA1c在3组之间呈递增关系(P<0.001)。3组在性别、体质量指数(body mass index,BMI)、eGFR、HDL-C、尿酸的分布上差异无统计学意义(P>0.05)。
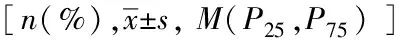
表1 HGI三分位组之间基本信息比较Tab.1 Baseline information of all participants categorized by HGI terciles
2.2 颈动脉斑块组与非颈动脉斑块组基本信息的比较
如表2所示,一共322例(29.1%)患者具有颈动脉斑块。具有颈动脉斑块的人群中45岁以上者比例较大,女性占比偏小,呈现更明显的代谢异常,表现为:高血压、高脂血症、糖尿病所占人数的比例更多,TC、TG、LDL-C浓度更高(P<0.05),尿酸浓度也更高(P=0.052)。与不伴有颈动脉斑块的人群相比,颈动脉斑块组血糖控制更差,表现为FBG [ 6.20 (5.55, 7.71) mmol/Lvs5.59(5.25, 6.04) mmol/L,P<0.001]及HbA1c[5.9%(5.6%, 7.0%)vs5.5%(5.3%, 5.8%),P<0.001]更高,HGI也明显升高[0.07%(-0.22%, 0.36%)vs-0.07%(-0.31%, 0.15%),P<0.001],eGFR减低的比例也较大(P<0.001)。2组患者BMI、HDL-C的分布差异无统计学意义(P>0.05)。

表2 颈动脉斑块组和非颈动脉斑块组之间基本信息的比较Tab.2 Baseline information of all participants categorized by carotid plaques
2.3 影响颈动脉斑块的多因素Logistic 回归分析
如表3所示,以是否具有颈动脉斑块为因变量进行Logistic 回归分析,结果显示:年龄、性别、高血压、糖尿病及HGI均是颈动脉斑块的独立危险因素(P<0.05)。年龄、男性、高血压(OR=2.51,95%CI:1.82~3.46,P<0.001)和糖尿病(OR=2.71,95%CI:1.90~3.88,P<0.001)均与颈动脉斑块正相关。在校正了年龄、性别、BMI、高血压、高脂血症、糖尿病、eGFR以及尿酸后,HGI中分位(Q2)组具有颈动脉斑块的风险是HGI低分位(Q1)组的1.47倍(OR=1.47,95%CI:0.98~2.20,P=0.06), HGI高分位组具有颈动脉斑块的风险是HGI低分位组的1.66倍(OR=1.66,95%CI: 1.14~2.43,P=0.008)。

表3 颈动脉斑块的Logistic 回归分析Tab.3 Logistic regression for carotid plaques in all participants
3 讨论
本项研究显示,在校正了年龄、性别、BMI、高血压、高脂血症、糖尿病、肾功能以及尿酸后,HGI是颈动脉斑块的独立危险因素。同时,本研究也发现HGI升高与心血管代谢性疾病风险升高相关,包括高血压、糖尿病、血脂异常,进一步为HGI在心血管疾病中的作用增添了新的证据。
HbA1c是监测长期血糖控制的可靠指标,血糖控制不佳(HbA1c≥8%)会增加心血管疾病和死亡的风险[17]。HGI代表了HbA1c的个体差异,这种差异可能与基因遗传、种族差异导致的红细胞寿命差异,以及1型葡萄糖转运蛋白(glucose transporter protein type 1,GLUT1)的表达和活性等有关[2]。HGI偏高代表实测HbA1c较预测HbA1c大,细胞内血红蛋白糖基化程度高,可能会增加个体的心血管代谢风险。颈动脉内中膜厚度是动脉粥样硬化的早期可靠指标,颈动脉斑块与心肌梗死及卒中风险增加也有关[18]。同时,笔者研究发现HGI较高者伴有较差的心血管疾病代谢指标,包括HbA1c、TC、TG、LDL-C浓度升高,高血压、糖尿病及血脂异常比例也较高,这与其他研究[5-7]结果显示的高HGI人群心脏代谢风险升高的结论相一致。
HGI升高与血管动脉粥样硬化风险增加相关的机制尚不明确。非酶促反应的血红蛋白糖基化引起血管动脉粥样硬化的机制之一可能是晚期糖基化终末产物 (advanced glycation end products,AGEs)。有研究[19]显示在糖尿病患者当中,HGI和AGEs的浓度存在正相关。AGEs通过在细胞外基质和基底膜分子间形成交联,与晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)结合,导致多种微血管和大血管并发症;AGEs还可以阻断血管内皮一氧化氮的活性,增加活性氧的产生[20]。AGEs被证实普遍存在于在糖尿病患者的血管系统中,并促进了动脉粥样硬化的发展[20]。此外,在2型糖尿病患者中,食物来源的AGEs可能参与了胰岛素抵抗的发展,限制AGEs饮食可以改善胰岛素敏感性[21]。胰岛素敏感性受损也是动脉粥样硬化的重要危险因素[22]。此外,炎症反应可能也是介导HGI和颈动脉斑块之间关系的因素之一。有研究[5, 7]显示,HGI升高和炎症因子升高相关,包括超敏C反应蛋白、红细胞沉降率、补体C3、血小板、白细胞计数、纤维蛋白原等。人体研究[23]中表明,RAGE过表达可以加强炎症反应,促进金属蛋白酶表达,进一步影响动脉斑块的稳定性。
此外,本研究还发现年龄、男性、高血压和糖尿病均与颈动脉斑块正相关,与既往研究[24]结果一致。动脉粥样硬化是一种慢性疾病,随着年龄的增长发病率逐渐增加。雌激素对内皮功能和脂质稳态具有保护作用,男性雌激素较低,动脉粥样硬化风险随之升高。早期发现糖尿病、高血压、高血脂,并对其进行管理或干预将助于减缓动脉粥样硬化的进展。
本研究具有一定的局限性。首先,本研究为单中心研究,限制了文章结论在其他地区/其他人群中的普适性。其次,没有测量胰岛细胞功能、AGEs的相关指标,HGI和颈动脉斑块之间的关系是否与其相关有待进一步探索。最后,此研究为回顾性的横断面研究,HGI和颈动脉斑块之间的因果关系仍有待研究。
综上所述,本研究结果表明HGI升高是颈动脉斑块的独立危险因素,HGI升高与多种心血管代谢的危险因素相关。HGI对于预测不同个体的心血管疾病代谢特征具有一定的作用,为糖尿病及心血管疾病的管理提供了新的思路和依据。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明韦莹:提出研究思路,设计研究方案,分析数据,撰写文章;王广:收集数据,提出研究思路,设计研究方案,修改及审定论文。

