老年2型糖尿病患者黎明现象的分析和对策
郑晓敏 李 彬 刘翠平 周迎生 崔丽梅*
(1.清华大学附属垂杨柳医院内分泌科,北京 100022; 2.首都医科大学附属北京安贞医院内分泌科, 北京 100029)
黎明现象(dawn phenomenon,DP)是Schmidt等[1]在1981年提出的在夜间无低血糖情况下出现的黎明时分空腹血糖(fasting blood glucose,FBG)升高,是2型糖尿病(type 2 diabetes mellitus,T2DM)患者空腹高血糖的常见原因,这种现象在老年T2DM患者中很明显,影响患者整体血糖控制,并增加患者糖尿病并发症发生及进展的风险[2]。既往人们对DP的研究多采用多次快速血糖监测的方法,其准确性容易受到血糖监测次数等因素的影响。近年来应用于临床的持续葡萄糖(glucose,GLU)监测系统(continuous glucose monitoring system,CGMS),通过连续测量和记录组织间液GLU浓度,可直观、准确监测患者整体血糖情况,对DP的判定更加准确[3]。本研究在老年T2DM患者中使用CGMS来判别发生DP的情况及相关危险因素,并分析其发生的可能原因,寻找解决方案。
1 对象与方法
1.1 研究对象
筛选自2019年7月至2020年3月在清华大学附属垂杨柳医院内分泌科住院和门诊治疗的老年T2DM患者94例,其中男性38例、女性56例,平均年龄(71.30±5.39)岁(65~88岁)。入选标准:①符合糖尿病的诊断标准[4],且分型为T2DM;②年龄≥65岁;③门诊患者可自行监测血糖并配合记录者;④对研究内容知情并签署知情同意书自愿参加者。排除标准:①妊娠期、哺乳期女性患者;②合并糖尿病酮症酸中毒等急性并发症;③合并严重肝肾功能不全及严重精神疾病等系统性疾病;④合并急性心脑血管疾病、感染、手术、创伤等应激情况;⑤近1个月使用类固醇类药物。本研究通过清华大学附属垂杨柳医院医学伦理委员会批准(批件号:2019-011KY),所有患者均签署知情同意书。
1.2 研究方法
收集患者信息,包括人口学特征、病史、既往史、降糖方案、并发症及合并症情况、生活习惯(饮食、运动)等,专人测量身高、体质量及血压。空腹采血完善肝肾功能、尿酸、血脂、糖化血红蛋白(glycosylated hemoglobin A1c, HbA1c),留晨尿检测尿微量白蛋白肌酐比,同时检测空腹C肽、空腹胰岛素等胰岛功能相关指标。由眼科医师行眼底照相检查判定糖尿病视网膜病变,由超声科医师行颈部及下肢多普勒超声检查判定糖尿病外周血管病变,由经过统一培训的专业技师使用Neurometer感觉神经定量检测仪(CPT/C,美国Neurotron公司)检查并结合患者临床表现及查体判定糖尿病周围神经病变。所有患者使用CGMS(MMT-7745WW,美国美敦力公司)进行至少3 d的血糖监测,探头型号为7008,每日至少4 次使用拜安康(1816型德国拜耳公司)血糖仪检测指尖血糖输入校正,采用选取第2天的监测结果进行分析。CGMS分析数据包括:平均葡萄糖(mean blood glucose, MBG)、葡萄糖值的标准差(standard deviations of blood glucose, SDBG)、葡萄糖变异系数(coefficient of variation, CV)、平均血糖波动幅度(mean amplitude of glycemic excursions, MAGE)、葡萄糖目标范围内时间(time in range, TIR)(标准界定为3.9~10 mmol/L)。所有病例报告表均由受过统一培训的医师填写,负责人核实后录入Epidata 3.1数据库分析。计算夜间血糖低谷值与FBG值差值(ΔGLU),用以评估是否发生DP。DP定义为ΔGLU>1.11 mmol/L(20 mg/dL)。发生DP的患者调整治疗后3个月再次行CGMS 3 d,评估血糖情况。
1.3 统计学方法

2 结果
2.1 患者一般情况
94例T2DM患者中合并高血压者71例、高血脂者74例、冠状动脉粥样硬化性心脏病者34例、脑血管病者26例。经CGMS监测发现ΔGLU 未超过1.11 mmol/L的无DP患者(non-dawn phenomenon group,NDP组)共46例;ΔGLU>1.11 mmol/L的患者48例,其中11例发生夜间低血糖(夜间血糖低于3.9 mmol/L)、发生DP的患者(DP组)共37例,DP的发生率为39.36%(37/94)。NDP组和DP组在性别、年龄、病程、血压、肝肾功能、血脂等方面差异均无统计学意义。与NDP组相比,DP组患者体质量指数(body mass index,BMI)、空腹胰岛素浓度低(P=0.029和P<0.001);FBG、HbA1c浓度增高(P<0.001和P=0.032),详见表1。
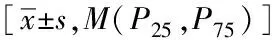
表1 2组老年T2DM患者一般临床特征Tab.1 General clinical characteristics of elderly patients with T2DM
2.2 CGMS结果分析
CGMS监测结果与指尖毛细血管血糖匹配良好,NDP组和DP组血糖监测总数、MBG、TIR差异均无统计学意义,但与NDP组相比,DP组患者血糖波动的指标SDBG、CV、MAGE均显著增高(P均<0.05),详见表2。

表2 2组老年T2DM患者CGMS数据结果Tab.2 Glycemic parameters from CGMS of elderly patients with T2DM
2.3 DP与降糖方案的关系
比较两组患者在降糖方案中选择的降糖药物,结果提示胰岛素(insulin, INS)、二甲双胍(metformin, MET)、磺脲类(sulfonylureas, SU)、格列奈类(glinide, GLN)、a-糖苷酶抑制剂(a-glycosidase inhibitors, a-GI)、噻唑烷二酮类(thiazolidinediones, TZD)、二肽激肽酶-4抑制剂(dipeptidyl peptidase-4 inhibitor, DPP-4i)、钠葡萄糖转运蛋白2抑制剂(sodium glucose transporter 2 inhibitor, SGLT2i)及胰高血糖素样肽-1受体激动剂(glucagon-like peptide-1 receptor agonist, GLP-1RA)在2组患者中差异均无统计学意义,详见表3。
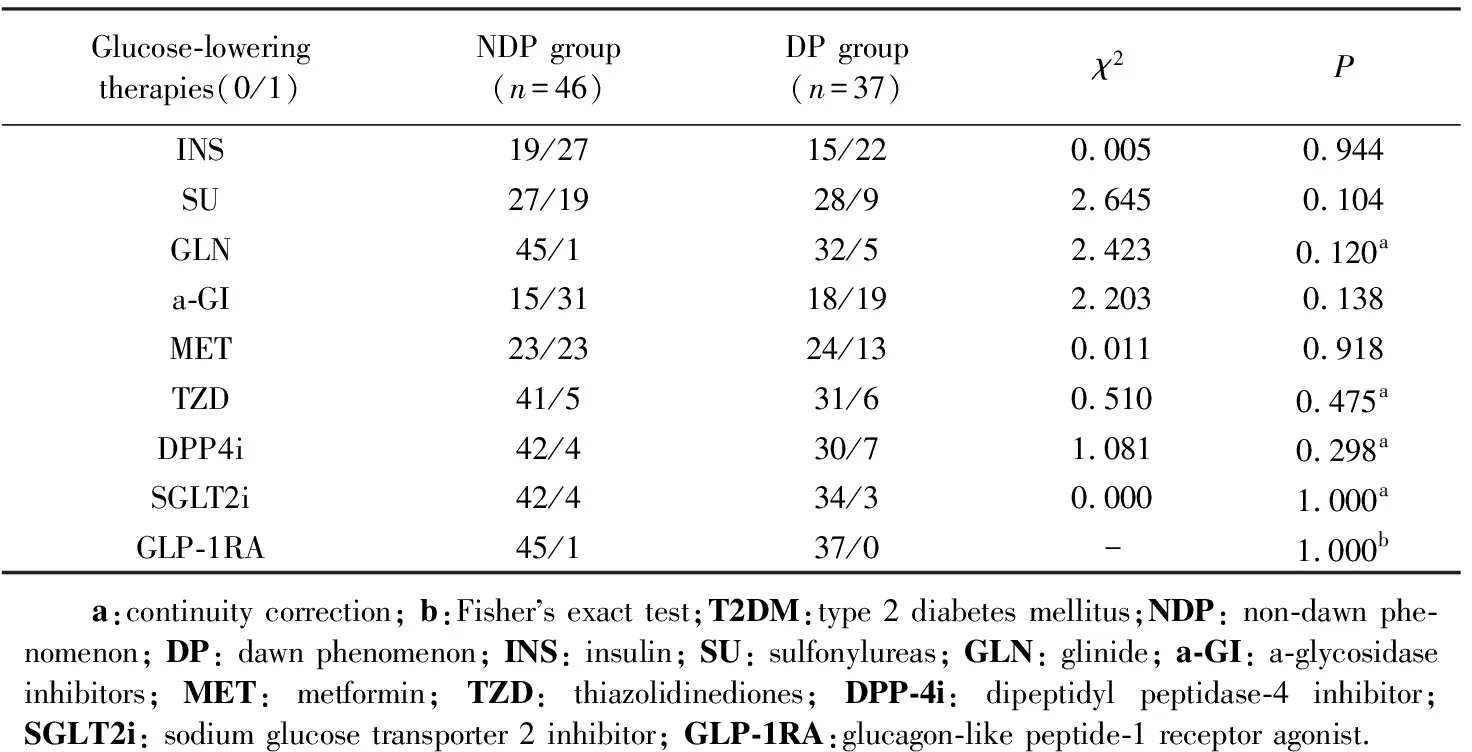
表3 2组老年T2DM患者降糖方案的比较Tab.3 Comparison of glucose-lowering therapies of elderly patients with type T2DM
2.4 DP与糖尿病慢性并发症的关系
2组发生糖尿病外周血管病变、糖尿病视网膜病变和糖尿病肾病的比率差异无统计学意义,DP组(86.49%)发生糖尿病周围神经病变的比率高于NDP组(67.39%)(P=0.043),详见表4。
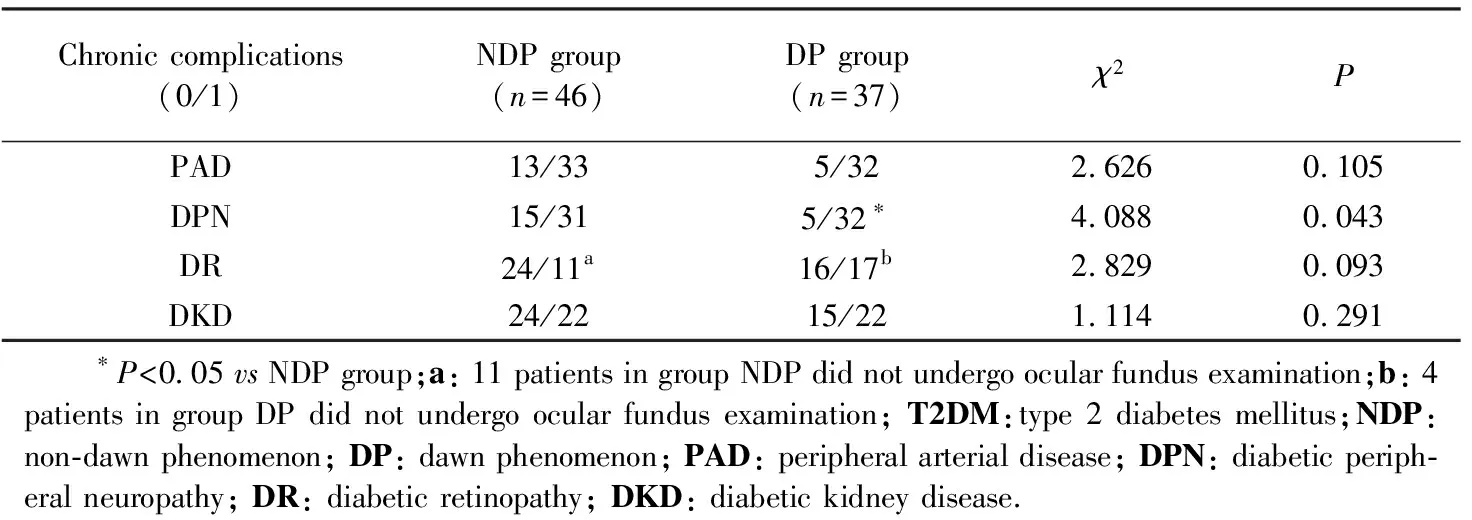
表4 2组老年T2DM患者糖尿病慢性并发症的比较Tab.4 Comparison of chronic complications in elderly patients with T2DM
2.5 发生DP的多因素分析
老年T2DM患者发生DP的多因素分析采用二分类Logistic回归分析。以是否发生DP为因变量,以单因素分析中有统计学意义的变量且考虑到FBG和HbA1c是DP的结果,不适合作为自变量进入到多因素Logistic回归分析,因此只有BMI和空腹胰岛素浓度进入方程,提示空腹胰岛素浓度低和低BMI是老年T2DM患者发生DP的独立危险因素(P分别为0.026和0.045),OR值(95%CI)分别为0.951(0.909~0.994)和0.853(0.731~0.997),详见表5。
表5 Logistic回归分析黎明现象的影响因素Tab.5 Logistic regression analysis with the dawn phenomenon as the dependent variable
2.6 DP患者的降糖方案调整
37例发生DP的患者中,加用睡前长效INS 11例、调整睡前INS剂量7例、加用MET 6例、调整MET剂量5例、加用DPP-4i及GLP-1RA分别为7例及1例。4例患者同时加用MET及睡前INS、1例同时加用MET和DPP-4i。另有5例患者调整饮食、运动及睡眠情况控制血糖。3个月后随访,37例患者均完成3 d CGMS监测,调整方案后31例患者DP得到改善,仅6例患者仍有DP,患者FBG及SDBG、CV、 MAGE均显著降低,TIR显著增高,FBG达标率(≤7.0 mmol/L)为72.97%(27/37),详见表6。
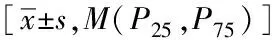
表6 有黎明现象的老年T2DM患者降糖方案调整前后CGMS结果比较Tab.6 Comparison of glycemic parameters from CGMS of before and after adjusting treatment in elderly patients with T2DM with dawn phenomenon
3 讨论
随着我国社会老龄化的加剧,老年糖尿病患者也迅速增长,2020年全国老年糖尿病患者约为7 813万[5]。但我国糖尿病的控制率仅为49.2%[4]。DP是FBG浓度增高的重要原因,是影响血糖达标的主要因素[6]。由于研究对象选择及DP诊断方法的不同,关于DP发生率的报道[7-8]差异较大(3%~55%)。有报道[7-8]认为约半数的1型糖尿病和T2DM患者会发生DP,DP在老年患者中普遍存在。Monnier等[2]使用CGMS研究发现不使用INS的T2DM患者在≥70岁、60~69岁和≤59岁 3组中DP的发生率分别为52%、70%和59%。本研究中65岁以上的老年T2DM患者发生DP的发生率为39.36%(37/94),但与Monnier的研究[2]的差别是本研究中未排除使用INS的患者,本研究94例患者中使用INS者占58.51%(55/94),INS的使用可能一定程度上控制了DP,减少了患者的DP的发生率。总体而言,老年T2DM患者DP的发生比较普遍。但在诊断DP时应注意除外夜间低血糖后发生反应性高血糖,即Somogyi现象,本研究Somogyi现象的发生率为11.7%(11/94),其与DP在治疗上需采取不同方案,故临床上监测夜间血糖对正确诊断有重大意义。
糖尿病患者发生DP的机制,一般认为与胰岛β细胞功能减退有关[9]。糖尿病患者随着病程进展,INS相对或者绝对缺乏,导致黎明时段INS不足以拮抗升糖激素的增高,发生空腹高血糖。本研究发现发生DP的患者空腹INS水平明显降低,且BMI低于无DP的患者,证明患者DP的发生与胰岛β细胞功能差有关。也有研究[10]显示INS抵抗、肝糖原输出增加、INS传导信号通路如INS受体底物-1/磷脂酰肌醇-3激酶等受损也参与FBG增高。另外,生长激素、胰高血糖素、糖皮质激素和儿茶酚胺等升糖激素水平异常增高也是DP发生的重要因素[11-12]。
近年来,随着CGMS的逐渐应用,不仅有效提高了DP诊断的准确性,同时也提供全面准确的血糖信息,通过相关软件的计算可以提供多个血糖波动指标(SDBG、CV、MAGE)及血糖达标情况(TIR)。MAGE是指根据第1个有效波方向计算血糖波动超过平均血糖值1个标准差的幅度的平均值,反映了受试者的血糖波动性,是评估日内血糖波动的“金标准”。本研究发现发生DP的患者虽然平均GLU水平无明显增高,但是反映血糖波动的相关指标,包括MAGE和SDBG、CV均显著高于无DP的患者。Li等[13]和Monnier等[14]的研究也证明有DP的患者比无DP的患者血糖波动更明显。另外,本研究发现发生DP的患者糖尿病周围神经病变的发生率明显升高,证明即使平均GLU水平相似,更大的血糖波动可能增加致糖尿病周围神经病变的发生风险。目前研究[15-17]认为血糖波动对靶器官的影响可通过氧化应激、糖基化、慢性低度炎症、内皮功能障碍、血小板活化、血管生成受损和肾纤维化等途径实现。在细胞中,血糖波动诱导的细胞毒性作用包括线粒体功能障碍、内质网应激和自噬,并伴有活力降低、凋亡激活和细胞增殖异常。这些作用通过大量基因的上调和下调以及多个信号通路的激活实现。表观遗传修饰异常也参与了GLU波动的破坏效应[15-17]。有关血糖变异性与糖尿病慢性并发症的研究[18-23]多数显示血糖变异性比平均糖化血红蛋白更能预测发生糖尿病大血管和微血管并发症,血糖变异性可预测全因死亡、致死性和非致死性心肌梗死、新发微量白蛋白尿和肾功能恶化,但也有相反的结论[18,24]。 本研究发现发生DP的糖尿病患者糖尿病周围神经病变发生率更高,可能与DP增加了糖尿病患者的血糖波动有关。
由于多数研究[8,25]将DP归因于INS作用不足(由于INS抵抗和/或β细胞功能受损),因此,提供基础INS被认为是改善DP的一种最佳的治疗方法。另有研究[26-28]显示加用DPP-4i、a-GI均可以改善血糖波动和DP,而磺脲类药物对DP无明显改善。另外生活方式的改变,如运动、失眠的改善均可以改善DP和血糖控制[29-30]。本研究中37例发生DP的患者48.65%(18/37)通过加用基础INS或调整INS剂量、29.73%(11/37)加用MET或调整MET剂量、18.92%(7/37)加用DPP-4i、2.70%(1/37)加用GLP-1RA(其中5例使用INS和DPP-4i的患者同时加用MET)、13.51%(5/37)未调整药物,仅调整饮食、运动及睡眠情况,3个月后其DP得到明显改善,血糖波动显著缓解,FBG达标率明显提高。可见,对于发生DP的患者,临床上最常用的解决方案是基础INS的加用或调整剂量,其次为MET和DPP-4i,另外GLP-1RA以及生活方式调整也是有效的治疗方法。
本研究在老年T2DM患者中使用CGMS判定DP,发现老年T2DM患者DP较普遍,是空腹高血糖的主要原因,空腹INS浓度低可能是DP发生的原因。DP与血糖波动大有关,可能导致糖尿病周围神经病变风险增高。基础INS是改善DP的有效治疗方法。但是,本研究的病例均为已治疗的T2DM患者,使用的药物可能影响研究结果,且本研究样本量较小,有待排除药物干预影响的大样本前瞻性研究进一步证明以上结论。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明郑晓敏:采集、清洗和分析数据,论文撰写;李彬、刘翠平、崔丽梅:进行试验、调研;周迎生、崔丽梅:提出研究思路,设计研究方案;崔丽梅:总体把关,审定论文。

