富马酸丙酚替诺福韦及其代谢物替诺福韦在中国健康受试者体内生物等效性研究
陈红,邱雯,吉兴芳,王志鹏,骆平英,刘海艳
(1.成都医学院第二附属医院·核工业四一六医院中西医结合科,成都 610057;2.兰州大学第二医院国家药物临床试验机构,兰州 730030;3.兰州大学药学院,兰州 730030;4.湖南科锐斯医药科技有限公司,长沙 410205)
慢性乙型肝炎(简称乙肝)是一种影响全球公共卫生的传染病,由于乙型肝炎病毒(hepatitis B virus,HBV)持续感染导致的常见慢性肝脏疾病。据世界卫生组织(WHO)报道,截至2019年,全球慢性HBV感染者约2.5亿例[1]。目前,慢性乙肝已成为我国社会负担最大的疾病之一[1]。富马酸丙酚替诺福韦(tenofovir alafenamide fumarate,TAF)作为近10年批准用于治疗慢性乙肝的第一个药物,通过被动扩散以及肝脏摄取性转运体OATP1B1和OATP1B3进入原代肝细胞。丙酚替诺福韦主要通过羧酸酯酶1水解形成替诺福韦,随后经过磷酸化,形成药理学活性代谢产物二磷酸替诺福韦。二磷酸替诺福韦借助HBV逆转录酶整合嵌入病毒DNA(这会导致DNA链终止),从而抑制HBV复制[2-4]。目前,关于替诺福韦的血药浓度测定及药动学研究报道较少[5-9],丙酚替诺福韦在健康中国志愿者体内药动学呈现高变异性[10]。笔者在本研究建立高效液相色谱-串联质谱(HPLC-MS/MS)法测定丙酚替诺福韦及其代谢物替诺福韦浓度,评价TAF片国内仿制药与国外原研药的生物等效性。报道如下。
1 材料与方法
1.1药品与试剂 受试制剂:TAF片(成都倍特药业有限公司,规格:每片25 mg,批号:180101,含量:99.6%);参比制剂:TAF片(商品名:Vemlidy®,Gilead Sciences公司,规格:每片25 mg,批号:011928,含量:96.9%);TAF对照品(中国食品药品检定研究院,批号:430025-202101);替诺福韦对照品(AOCS公司,批号:EST-007-15-E);阿哌沙班(内标,HST公司,批号:A009000-201905);外消旋替诺福韦-d6(内标,TRC,批号:12-JLI-109-1)。甲醇、乙腈(色谱纯,Merck公司),乙酸、乙酸铵、异丙醇(质谱纯,ACS公司),其余试剂均为分析纯。
1.2仪器 LC-20AD型UPLC系统(日本Shimadzu公司,配有LC-20AD型高压恒流输液泵、CTO-20AC柱温箱、CBM-20A控制器、DGU-20A3脱气机、SIL-30AC MP进样器);LCMS-8050三重四级杆质谱仪(日本Shimadzu公司);Labsolution数据采集工作站;电子分析天平(北京赛多利斯仪器系统有限公司,感量:0.01 mg);ULTS1490型超低温冰箱(美国Thermo Scientific公司);TGL16M、TGL18型离心机(长沙英泰仪器有限公司)。
1.3受试者选择 本研究共入组中国健康受试者68例。其中空腹试验入组32例,男21例,女11例,年龄(21.71±1.64)岁,身高(165.63±8.24)cm,体质量(59.23±7.29)kg,体质量指数(BMI)为(21.53±1.47)kg·(m2)-1。餐后试验入组36例,男22例,女14例,年龄(22.39±2.98)岁,身高(168.22±7.60)cm,体质量(61.83±7.23)kg,BMI为(21.80±1.48)kg·(m2)-1。所有受试者性别、年龄、身高、体质量等人口学特征均符合入组要求,受试者在试验前14 d及试验期间未曾服用过任何其他药物。试验前受试者均签署知情同意书,自愿参加,服药的依从性良好,本试验方案经兰州大学第二医院药物临床试验伦理委员会批准(伦理批件号:[2018]第20号、21号)。
1.4给药方案与血样采集 本试验采用随机、开放、两制剂、两序列、四周期、完全重复交叉的生物等效性试验设计,每周期清洗期为14 d。所有受试者于试验前1 d入住病房,统一生活管理,禁服茶、咖啡及其他含咖啡和醇类饮料,并禁止吸烟。试验当天早上随机发放受试制剂或参比制剂,受试者在端坐姿态下空腹单次口服用药(至少空腹10 h),餐后组在服药前30 min开始进食高脂餐,30 min内进餐完毕,温开水240 mL送服。服药前后1 h内禁止饮水(服药时饮水240 mL除外),服药4 h内禁食。服药4,10 h后统一进标准餐。受试者服药后应避免剧烈运动,亦不得长时间卧床。
空腹和餐后试验组分别在给药前(0 h)以及给药后5,10,20,30,40,50 min及1,1.25,1.5,1.75,2,2.5,3,4,5,6,8,12,24,48,72 h,采集前臂静脉血3 mL,置于肝素钠抗凝管中,轻柔颠倒混匀。采集的血样在30 min内4 ℃条件下离心(2000×g,10 min),离心后取上层血浆0.8 mL,转移至含2%乙酸16 μL的冻存管中,混匀5 s后置于-80 ℃冰箱内保存。血样采集前以及血样采集后到低温离心操作之前,真空采血管均须置于冰水浴内。分取血浆过程中及分取血浆后到置于冰箱之前的过程中,冻存管均置于冰水浴内。
1.5测定方法
1.5.1色谱条件 色谱柱:ACQUITY UPLC®HSS T3(2.1 mm×75 mm,1.8 μm);流动相A:5 mmol·L-1乙酸铵(含0.1%甲酸),流动相B:甲醇:乙腈(1:1);梯度洗脱(丙酚替诺福韦:0.01~0.40 min,15% B;1.00~2.50 min,95% B;2.60~3.80 min,15% B。替诺福韦:0.01~0.50 min,1% B;0.60~2.50 min,12% B;3.00~4.00 min,90% B;4.30~6.00 min,1% B);流速:0.3 mL·min-1;柱温40 ℃;进样量5.0 μL。
1.5.2质谱条件 离子源:ESI,离子化方式:正离子模式;扫描方式:MRM;监测离子对:丙酚替诺福韦(m/z)为477.05/346.10,阿哌沙班(内标,m/z)为460.05/443.00,替诺福韦为(m/z)288.10/176.10,替诺福韦-d6(内标,m/z)为294.40/181.95;接口温度:400 ℃,DL温度:250 ℃,加热块温度:400 ℃,接口电压:4.5 kV。
1.5.3对照品储备液的制备 精密称取适量TAF对照品置于棕色玻璃瓶中,甲醇溶解并定容,配制成含丙酚替诺福韦10.00 mg·mL-1的储备液;精密称取适量替诺福韦对照品置于透明玻璃瓶中,溶解于适量体积水中,配制成含替诺福韦1.000 mg·mL-1的储备液。在2~8 ℃条件下保存。
1.5.4内标工作溶液的制备 精密称取阿哌沙班对照品适量,加入适量二甲亚砜(DMSO)溶解并摇匀,再加入等量甲醇稀释,用乙腈稀释至10.00 ng·mL-1;精密称取替诺福韦-d6,加入适量DMSO溶解并摇匀,将其用甲醇稀释至10.00 ng·mL-1。2~8 ℃保存。
1.5.5标准曲线溶液的制备 取适量丙酚替诺福韦储备液,用甲醇-水(50:50)逐渐稀释,配制成标准曲线溶液,将其加入空白人血浆中(含2%乙酸)稀释,得到浓度为1.000,2.500,10.00,20.00,40.00,100.0,200.0,400.0 ng·mL-1的系列校正标样。取适量替诺福韦储备液,用甲醇-水(50:50)逐渐稀释,配制成标准曲线溶液,将其加入空白人血浆(含2%乙酸)中稀释,得到浓度为0.400 0,0.800 0,2.000,5.000,10.00,20.00,32.00,40.00 ng·mL-1的系列校正标样。
1.5.6血浆样品前处理 ①丙酚替诺福韦:吸取待测血浆样品80.0 μL至1.5 mLEP管中,加入阿哌沙班内标工作液(双空白样品替换为纯乙腈)500 μL,涡旋振荡3 min后,于4 ℃、12 000 r·min-1(2000×g)条件下离心10 min,取上清液50.0 μL至96孔进样板,加入纯水稀释液150 μL,混匀后进样分析。②替诺福韦:吸取待测血浆样品100 μL至1.5 mL EP管中,加入替诺福韦-d6内标工作液(双空白样品替换为纯甲醇)300 μL,涡旋振荡3 min,于4 ℃、12 000 r·min-1条件下离心10 min,取上清液150.0 μL至96孔进样板,加入纯水稀释液150 μL,混匀后进样分析。
1.5.7统计学方法 利用WinNonlin软件,采用非房室模型法(non-compartment model,NCA)计算丙酚替诺福韦与替诺福韦药动学参数,并采用平均生物等效性或参比制剂标度的平均生物等效性置信区间法进行评价。利用SPSS 23.0版软件,采用独立样本t检验法分析不同性别的受试者之间主要药动学参数峰浓度(Cmax),血药浓度-时间曲线下面积(AUC0-t)及AUC0-∞之间的差异,采用非参数检验法比较不同性别受试者之间达峰时间(tmax)之间的差异。以P<0.05为差异有统计学意义。
2 结果
2.1方法学考察及评价
2.1.1选择性 取6个不同来源的空白血浆,按照“1.5.6”项血浆样品前处理中双空白样品进行处理后进样。要求双空白样品中待测物峰面积不超过定量下限样品待测物峰面积的20%,内标峰面积不超过定量下限样品内标峰面积的5%。在本研究条件下,丙酚替诺福韦保留时间约为2.25 min,替诺福韦保留时间约为2.35 min,内标阿哌沙班保留时间约为2.25 min,替诺福韦-d6保留时间约为2.35 min。结果表明,空白血浆中内源性物质均不干扰代谢物和内标的测定,色谱图见图1,图2。
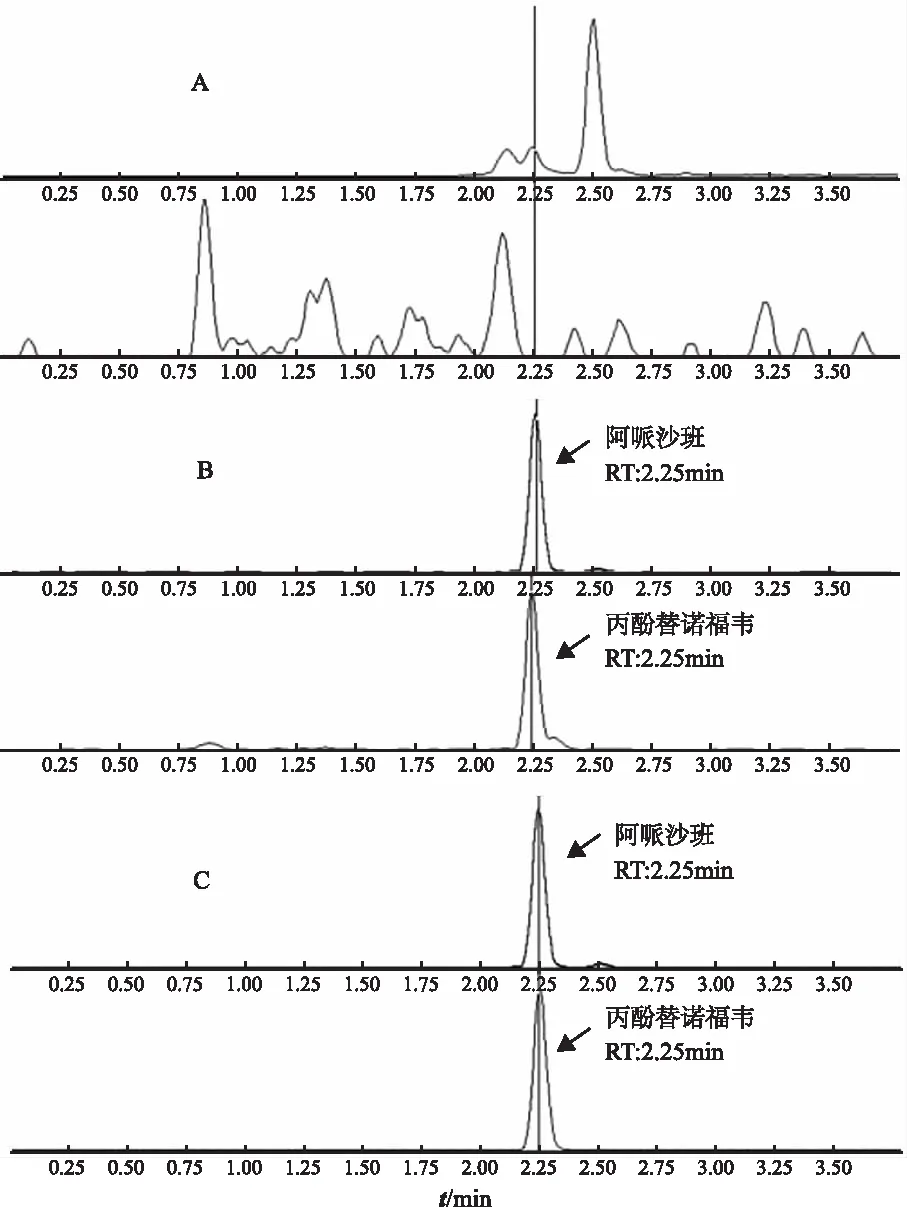
A.空白血浆;B.定量下限(1.000 ng·mL-1);C.定量上限(400.0 ng·mL-1)。

A.空白血浆;B.定量下限(0.400 0 ng·mL-1);C.定量上限(40.00 ng·mL-1)。
2.1.2标准曲线及定量限 使用空白人血浆新鲜制备下列浓度的血浆样品,丙酚替诺福韦:1.000,2.500,10.00,20.00,40.00,100.0,200.0,400.0 ng·mL-1,替诺福韦:0.400 0,0.800 0,2.000,5.000,10.00,20.00,32.00,40.00 ng·mL-1,对响应值Y(分析物与内标的峰面积比值)与分析物理论浓度(C)进行线性回归,权重为1/C2。丙酚替诺福韦在1.000~400.0 ng·mL-1范围内线性良好(R2>0.98),标准曲线:Y=0.012 654X-0.000 491 645;替诺福韦在0.4000~40.00 ng·mL-1范围内线性良好(R2>0.98),标准曲线:Y=0.101 627X-0.005 181 01。
2.1.3精密度及准确度 使用空白人血浆新鲜制备定量下限、低、中、高共4个浓度的血浆样品,每个浓度各6份,按照“1.5.6”项血浆样品前处理后测定,至少2 d内连续测定3个批次。以单个分析批内测得浓度计算批内精密度及准确度,以3个分析批测得浓度数据计算批间精密度及准确度,结果见表1。
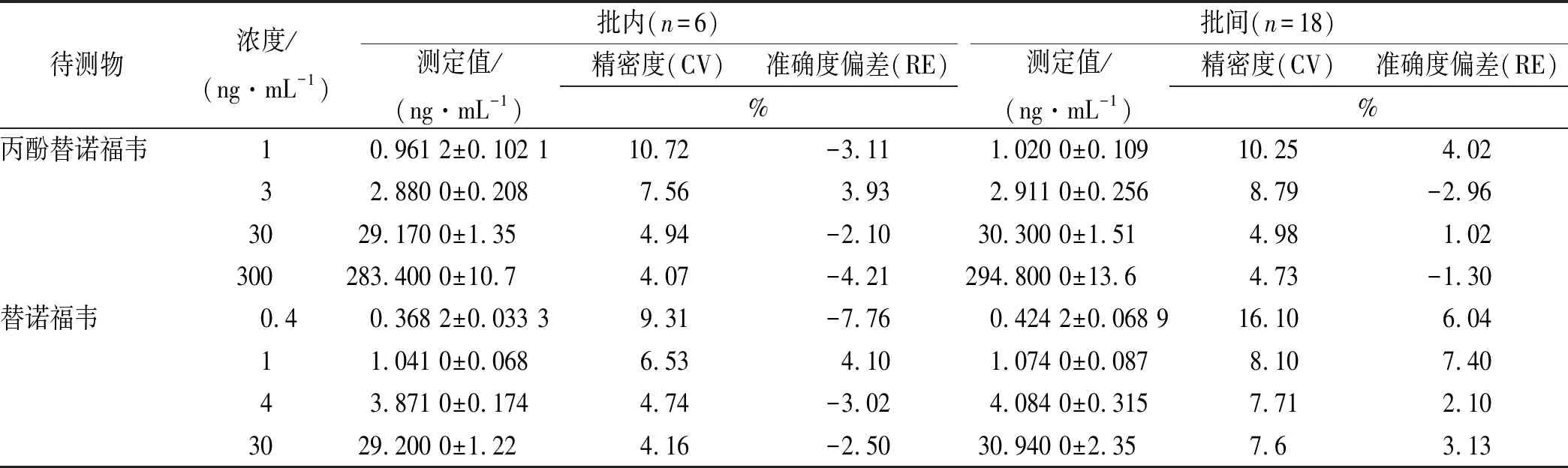
表1 丙酚替诺福韦及替诺福韦精密度及准确度考察结果
2.1.4基质效应 分别取6个不同来源的空白人血浆(含2%乙酸),按照“1.5.6”项双空白样品进行处理,向其中添加低、中、高浓度分析物及内标制得基质样品,每个浓度重复6份。另配制低、中、高浓度纯溶液样品。对比基质样品与纯溶液之间的内标归一化基质效应因子。结果丙酚替诺福韦及替诺福韦低、中、高3个浓度水平,内标归一化的基质因子变异系数均≤15%,表明在本研究条件下,各样品的基质效应均一。
2.1.5稳定性 血浆稳定性结果见表2。丙酚替诺福韦:储备液(甲醇配制)室温存放19 h稳定,工作溶液(50%甲醇水配制)室温存放41 h稳定。血浆样品室温21 h稳定,-80 ℃冻融3次稳定,制备后样品2~8 ℃存放73 h稳定。替诺福韦:工作溶液(50%甲醇水配制)室温存放41 h稳定;血浆样品室温44 h稳定,-80 ℃冻融3次稳定,制备后样品2~8 ℃存放116 h稳定。
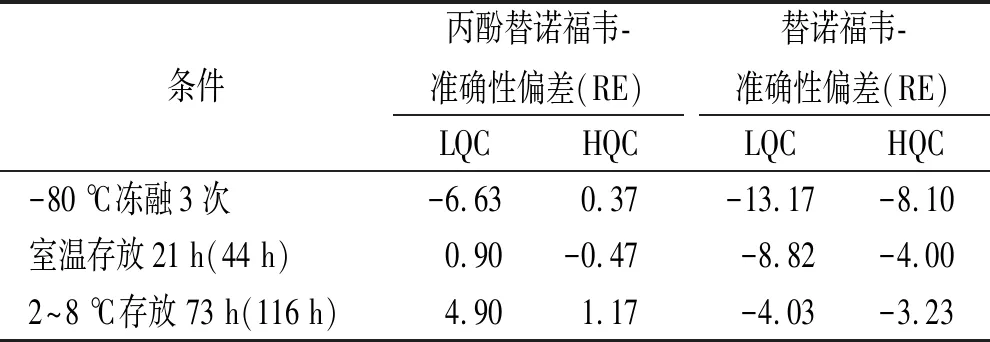
表2 丙酚替诺福韦及替诺福韦血浆稳定性考察结果
2.2药动学 本试验共入组68例受试者(空腹32例,脱落3例;餐后36例),共65例受试者完成试验。试验过程中未发生对受试者安全与权益、数据科学性评价有影响的方案偏离或违背。本试验未发生严重不良事件,9例(24.32%)受试者发生10例次不良事件,均为轻度。不良事件的组织器官和系统归类主要为各类检查、血液及淋巴系统疾病、各类神经系统疾病和代谢及营养类疾病等,首选术语主要为贫血、头晕和高尿酸血症等。
不同性别健康受试者空腹或餐后单次口服TAF片25 mg后,丙酚替诺福韦体内暴露存在显著性别差异,主要药动学参数,见表3~4。如AUC0-t和AUC0-∞经t检验,P值均<0.01。

表3 健康受试者空腹单次口服TAF片后丙酚替诺福韦和替诺福韦主要药动学参数

表4 健康受试者餐后单次口服TAF片后丙酚替诺福韦和替诺福韦主要药动学参数
受试者在空腹和高脂餐后服用TAF片25 mg,丙酚替诺福韦和替诺福韦平均血药浓度-时间曲线见图3,4,药动学参数见表5,6。

表5 空腹试验和餐后试验健康受试者体内丙酚替诺福韦的主要药动学参数

表6 空腹试验和餐后试验健康受试者体内替诺福韦的主要药动学参数
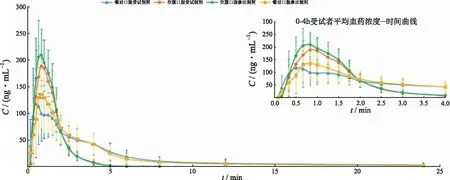
图3 健康受试者口服TAF片25 mg后丙酚替诺福韦血药浓度-时间曲线

图4 健康受试者口服TAF片25 mg后替诺福韦血药浓度-时间曲线
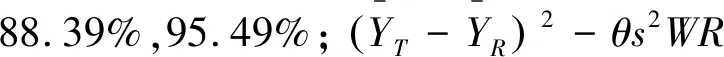

表7 丙酚替诺福韦及其代谢物替诺福韦的生物等效性结果
3 讨论
本试验首次考察性别对丙酚替诺福韦及其代谢物替诺福韦在健康中国人体内药动学特征的影响。研究结果表明(表3),在空腹条件下口服TAF片25 mg后,女性受试者体内丙酚替诺福韦暴露量(AUC)明显高于男性(P<0.01),男性受试者约为女性受试者的62%。男女性受试者Cmax比较亦差异有统计学意义(P<0.05),男性受试者Cmax约为女性受试者的61%。tmax及半衰期未表现出明显的差异。代谢物替诺福韦的主要药动学参数在不同性别受试者间均未表现出明显的差异。
原研药说明书采用群体药动学的方法评估不同影响因素对丙酚替诺福韦的药动学参数的影响,结果未将性别列出的药动学差异视为具有临床相关性。然而,本研究结果提示中国健康女性受试者在空腹服用相同剂量的丙酚替诺福韦制剂后,原型药物体内暴露存在显著性别差异。因原形药物在女性受试者中具有更高的暴露,增加女性患者发生临床不良反应风险,提示在此类药物对临床研究中应关注女性受试者的安全。
试验发现与空腹给药比较,餐后给药丙酚替诺福韦暴露量AUC0-t增加55.19%,Cmax降低10.51%,且tmax推迟约0.41 h,而代谢物替诺福韦Cmax降低15.73%,tmax推迟约0.75 h,AUC0-t基本无明显变化,说明饮食对富马酸替诺福韦的药动学存在明显影响,结果与国内外文献报道结果一致[11-12]。
本研究在健康中国成年受试者中采用随机、开放、两制剂、两序列、四周期、完全重复交叉试验,证明空腹和餐后条件下单次口服富马酸丙酚替诺福韦受试制剂和参比制剂具有生物等效性。此外,本研究发现性别对替诺福韦艾拉酚胺在健康中国人体内药动学特征的影响,但其代谢物替诺福韦的主要药动学参数在不同性别受试者间均未表现出明显的差异。同时,饮食也会对丙酚替诺福韦及其代谢物替诺福韦在健康中国人体内药动学特征产生影响。本研究结果可为富马酸替诺福韦在中国人群的安全合理用药提供重要参考依据。

