二黄祛脂方及其精简方对小鼠高血脂的防治作用*
赫翠,陈卫军,郑萌玥,潘培妍,李聪,陈文,秦冬梅
(1.石河子大学药学院/新疆植物药资源利用教育部重点实验室,石河子 832002;2.新疆第二医学院中医学院,克拉玛依 834000)
高脂血症(hyperlipidemia ,HPL)是全球性的重大健康问题,其与非酒精性脂肪肝(NAFLD)密切相关,HPL常常伴随着NAFLD的出现,且一旦出现一种代谢紊乱,其他并发症的风险就会更高[1]。目前仍缺乏治疗HPL的药物,虽然一些西药具有快速降脂作用,但它们会引起肝毒性等严重副作用[2],因此研究新的治疗药物迫在眉睫。
二黄祛脂方(EHQZF)是石河子大学第一附属医院临床上用于降脂的经典复方,由甘草(GlycyrrhizauralensisFisch,GC)、丹参(SalviamiltiorrhizaBunge,DS)、荷叶(FoliumNelumbinis,HY)、大黄(RheumpalmatumL.,DH)、姜黄(CurcumalongaL.,JH)、虎杖(ReynoutriajaponicaHoutt,HZ)、葛根(RadixPuerariae,GG)、白术(AtractylodesmacrocephalaKoidz,BZ)、泽泻(Alismaplantago-aquaticaL.,ZX)、绞股蓝[Gynostemmapentaphyllum(Thunb.)Makino,JGL]、僵蚕(BombyxBatryticatus,JC)、水蛭(HirudonipponicaWhitman,SZ)和青礞石(LapisChloriti,QMS)13味中药组成,袁今奇等[3]发现EHQZF可以通过降脂作用减轻NAFLD,但是,由于EHQZF药材种类较多,价格昂贵,并且复方中含有较难收集的矿物药(青礞石)和毒性较大的动物药(水蛭),给患者临床应用造成一定的困扰,因此对EHQZF进行精简并重新组方具有一定的现实意义。
网络药理学是一门新兴学科,其可通过“网络靶点、多组分疗法”帮助阐明中药复方治疗疾病的复杂分子机制[4]。本研究采用网络药理学方法预测EHQZF治疗HPL的关键中药及有效成分,利用液相色谱-质谱(LC-MS)鉴别关键化合物,将EHQZF抗HPL的关键中药按照Degree值排序,组方为QZF-Ⅰ(甘草、丹参、荷叶、大黄),按照处方量排序,组方为QZF-Ⅱ(虎杖、丹参、荷叶、姜黄),采用Tyloxapol诱导ICR小鼠高脂血症,Tyloxapol是一种非离子表面活性剂,可阻断血浆脂解活性并在小鼠体内诱导富含TG的脂蛋白[5],该方法可用于建立急性高血脂模型,该模型与NAFLD也密切相关[6]。利用该模型比较EHQZF、QZF-Ⅰ、QZF-Ⅱ三个复方降血脂的效果,筛选出抗HPL较优的处方。
1 材料与方法
1.1药物 ZX(批号:20060211)、GC(批号:20041521)、GG(批号:20011431)、BZ(批号:20040441)、HY(批号:20030291)、HZ(批号:19121441)、JH(批号:20080341)、JGL(批号:20020291)、DS(批号:20070501)、DH(批号:20070631)、JC(批号:19101851)、QMS(批号:19111941)和SZ(批号:20050441)均购自江阴天江药业有限公司,组方颗粒经石河子大学医学院第一附属医院袁今奇教授鉴定,均符合《中华人民共和国药典》2015年版规定。
1.2试剂 甲醇(批号:MSDS-20190426,货号:CAEQ-4-003302-4000)、乙酸(批号:MSDS-20170627,货号:CAEQ-4-011245-0500)、乙腈(货号:CAAH-1-00030-4000)均购自上海安谱实验科技股份有限公司;氢氧化钠(天津市科密欧化学试剂有限公司,批号:20190310);盐酸(天津市科密欧化学试剂有限公司,批号:20200318);乙酸乙酯(天津市北联精细化学品开发有限公司,批号:20201020);1,1-二苯基-2-苦肼基自由基(DPPH,上海梯希爱化成工业发展有限公司,批号:GTBXB-QP,货号:D4313);抗坏血酸(上海蓝季科技发展有限公司,批号:180710,货号:D10001);2,2-连氨基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)(ABTS)(上海蓝季科技发展有限公司,批号:180305,货号:F0001);过硫酸钾(天津市盛奥化学试剂有限公司,批号:20161019,货号:W510055);4%多聚甲醛(北京雷根生物技术有限公司,批号:0618A21,货号:DF0135);Tyloxapol(美国Sigma公司,批号:MKCK7328,货号:T0307-5G);丙氨酸氨基转移酶(ALT,批号:20210329,货号:C009-2-1)、天冬氨酸氨基转移酶(AST,批号:20210329,货号:C10-2-1)、三酰甘油(TG,批号:20210318,货号:A110-1-1)、总胆固醇(TC,批号:20210318,货号:A111-1-1)、高密度脂蛋白胆固醇(HDL-C,批号:20210329,货号:A112-1-1)、低密度脂蛋白胆固醇(LDL-C,批号:20210416,货号:A113-1-1)、丙二醛(MDA,批号:20211207,货号:A003-1)、超氧化物歧化酶(SOD,批号:20211204,货号:A001-1)试剂盒均由南京建成生物工程研究所提供;大鼠白细胞介素1β(IL-1β,批号:20201218,货号:SEKM0002)、大鼠IL-6(批号:20201218,货号:SEKM0007)试剂盒均由北京索莱宝科技有限公司提供。
1.3实验动物 无特定病原体(SPF)级ICR小鼠36只,雌雄各半,体质量18~25 g,购自新疆医科大学动物实验中心,实验动物生产许可证号:SCXK(新)2018-0002。小鼠于室温(23±2)℃、相对湿度约50%,12/12 h光暗交替的条件下进行饲养,自由摄食饮水,在实验前适应性喂养7 d,动物实验严格按照石河子实验动物管理法规的规定和总则建议进行。
1.4仪器 5426XG型离心机(德国艾本德股份公司);BP211D型分析天平(德国赛多利斯,感量:0.01 mg);Varioskan LUX型多功能酶标仪(Thermo Fisher Scientific,USA);VORTEX0型涡旋混匀器(上海达姆实业有限公司);SKY-100B型恒温摇床(上海天呈实验仪器制造有限公司)。
1.5活性成分的收集与筛选 在ETCM数据库(tcmip.cn/ETCM/)[7]、化学专业数据库(organchem.csdb.cn/scdb/default.htm)、TCMSP数据库(tcmspw.com/ tcmsp.php)[8]、TCMID数据库(megabionet.org/tcmid)[9]、BATMAN-TCM数据库(bionet.ncpsb.org/batman-tcm/)[10]和SymMap数据库(symmap.org/SymMap)[11]中检索EHQZF的13味药所含的化学成分,利用PubChem数据库(pubchem.ncbi.nlm.nih.gov/)[12]查找化合物的标准SMILES式,上传至FAFDrugs4数据库(fafdrugs4.mti.univ-parisdiderot.fr/)[13],将“PhysChem Filters”设置为“Drug-Like Soft”,当ADMET评估的结果为“Accepted”时,化合物被选为潜在的活性成分。
1.6活性成分的作用靶点收集 利用ChEMBL数据库(ebi.ac.uk/chembl/)[14]、TCMSP数据库、SwissTargetPrediction数据库(swisstargetprediction.ch/)[15]和ETCM数据库收集活性成分靶点,限制物种为“Homo sapiens”。在ETCM中,设置候选目标基因的置信度得分≥0.80,在SwissTargetPrediction数据库中,选择“probability>0”的靶点。合并收集到的靶点,删除重复值后将靶点导入UniProt数据库(uniprot.org/)进行标准化,即可得到活性成分的作用靶点。
1.7复方治疗HPL的靶点预测 在GeneCards数据库(genecards.org/)[16]、OMIM数据库(omim.org/)[17]、DisGeNET数据库(disgenet.org/)[18]、CTD数据库(ctdbase.org/)[19]中以“Hyperlipidemia”为关键词查询HPL靶点,将HPL靶点导入UniProt数据库进行标准化,删除重复值后,将EHQZF与HPL靶点上传至联川生物云平台(omicstudio.cn/index)制作Venn图,交集即为EHQZF治疗HPL的作用靶点,将作用靶点导入STRING平台,限定物种为“homo”,将network display options设置为“hide disconnected nodes in the network”,获得蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,采用Cytoscape软件中的Network Analyzer对PPI网络中的靶点进行自由度分析,筛选出Degree值≥2倍中位数的靶点,作为后续分析的核心靶点。
1.8LC-MS样品溶液的制备 检测EHQZF中酚酸类化合物时,用70%甲醇溶液2 mL提取EHQZF样品约100 mg,每次使用超声波提取30 min,共2 h,之后35 ℃减压浓缩至干燥,检测EHQZF中黄酮类化合物时,先用4 mol·L-1氢氧化钠水溶液2 mL处理EHQZF样品约100 mg,40 ℃水解2 h,通过滴加4 mol·L-1盐酸调节pH值为2,加入正己烷2 mL,晃动20 min,除去正己烷层,用乙酸乙酯(2×2 mL)提取水层,浓缩至干燥。在分析之前,将残余物溶解在50%甲醇200 μL中,并转移到配有插入装置的小瓶中。
1.9LC-MS色谱条件 采用Thermo ScientificTMQ ExactiveTM联合四极杆-轨道阱质谱仪和Waters HSS T3色谱柱(50 mm×2.1 mm,1.8 μm)进行LC-MS分析,质谱参数设置如下:采用电喷雾离子源;鞘气40 arb;辅助气10 arb;离子喷雾电压为-2800 V;温度350 ℃,离子传输管温度320 ℃,流速0.3 mL·min-1;柱温40 ℃;进样量2 μL;扫描模式为单离子检测模式;扫描方式为负离子。检测酚酸类化合物时流动相为乙腈(B相)-0.1%甲酸溶液(A相),其梯度洗脱过程为0~2 min(90:10),6~9 min(40:60),9.1~12 min(90:10);检测黄酮类化合物时流动相为乙腈(B相)-0.1%乙酸溶液(A相),其梯度洗脱过程为0~2 min(90:10),6~8 min(40:60),8.1~12 min(90:10)。数据用TraceFinder软件进行特征提取和预处理,然后采用外标法进行定量。
1.10EHQZF及其精简方对DPPH自由基清除能力的测定 用无水乙醇配制不同浓度(0.2,0.4,0.6,0.8,1.0 mg·mL-1)的EHQZF、QZF-Ⅰ、QZF-Ⅱ和BTBT溶液,取上述溶液1.0 mL,加0.1 mmol·L-1DPPH无水乙醇溶液2.0 mL,混匀,静置30 min,混匀后在室温条件下暗反应30 min,测定517 nm波长处的吸光度值(A1),取0.1 mmol·L-1DPPH无水乙醇溶液1 mL加入无水乙醇2 mL。在517 nm波长处测定其吸光度值(A0),以VC作阳性组,按公式计算DPPH的清除率[20]。
SA%=(A0-A1)/A0×100%
(1)
A0:DPPH与溶剂混合液吸光度;A1:DPPH与各样品反应后吸光度。
1.11EHQZF及其精简方对ABTS自由基清除能力的测定 取7 mmol·L-1ABTS溶液5 mL与140 mmol·L-1过硫酸钾88 μL混合,在室温避光条件下反应16 h制成ABTS储备液。取上述ABTS储备液0.1 mL加入纯化水5 mL稀释至该溶液在734 nm处吸光度值为0.695~0.705,即得ABTS工作液,现用现配。取无水乙醇0.3 mL加入ABTS工作液2.7 mL作为空白组,振荡混合后,室温避光反应30 min,在734 nm波长处测定其吸光度值(A0)[21]。用无水乙醇配制不同质量浓度(0.2,0.4,0.6,0.8,1.0 mg·mL-1)EHQZF、QZF-Ⅰ、QZF-Ⅱ 和BTBT溶液,以VC作阳性组。取样品溶液0.3 mL于ABTS工作液2.7 mL中,充分振荡后,避光反应30 min,在734 nm波长处测定吸光度值(A1)(重复3次)。按公式(2)计算清除率:
SA(%)=(A0-A1)/A0×100%
(2)
A0:ABTS与溶剂混合液的吸光度;A1:ABTS与各样品反应后的吸光度。
1.12药液的制备及剂量设置 EHQZF的临床每日给药剂量为(颗粒量):JH 0.6 g、DH 3 g、JC 1 g、JGL 1 g、BZ 3 g、GG 1 g、HY 0.5 g、ZX 1 g、DS 2 g、HZ 1 g、SZ 0.5 g、QMS 0.5 g、GC 1 g,参照临床剂量将本实验药物剂量从原料药剂量转换为中药提取物颗粒剂量,并根据体表面积等效剂量转换法转换为小鼠剂量,则给药剂量为2.4 g·kg-1,取以上13味中药的颗粒剂量制成EHQZF,QZF-Ⅰ和QZF-Ⅱ中药味的剂量与其在全方中的剂量相同,即取甘草颗粒:丹参颗粒:荷叶颗粒:大黄颗粒=1:2:0.5:3,制成QZF-Ⅰ,取虎杖颗粒:丹参颗粒:荷叶颗粒:姜黄颗粒=1:2:0.5:0.6,制成QZF-Ⅱ,混合后,均用60 ℃纯化水制成药液服用,经石河子大学第一附属医院制剂室进行质量控制检测。
1.13HPL小鼠模型建立及指标检测 取ICR小鼠,随机分为CON组、HPL组、EHQZF组(2.4 g·kg-1)、QZF-Ⅰ组(2.4 g·kg-1)、QZF-Ⅱ组(2.4 g·kg-1)和BZBT组(60.67 mg·kg-1),除CON组和HPL组给予纯化水外,其余各组灌胃给予相应药物,早晚各给药一次,持续13 d,第13 天时,末次给药1 h后,除CON组,其余各组腹腔注射500 mg·kg-1Tyloxapol,禁食不禁水14 h后,将小鼠安乐死,取血清检测ALT、AST、TG、TC、HDL-C、LDL-C、MDA及SOD含量,取肝组织匀浆检测IL-6、IL-1β含量,利用苏木精-伊红(HE)染色和油红O染色进行病理学观察。

2 结果
2.1EHQZF抗HPL的核心靶点的筛选 结果见图1。EHQZF和HPL共有交集靶点532个,将交集靶点导入STRING进行PPI网络分析,通过Cytoscape 3.9.0对图像可视化,以节点表示蛋白,以边表示节点间的相互作用,Degree值表征连接到该节点的边数,以此来反映节点在网络中的重要性,图示节点越大,表示该Degree值越大,交集靶点PPI网络共有节点527个,14 577条边,Degree值中位数为78,以Degree>78的靶点作为EHQZF治疗HPL的核心靶点,核心靶点PPI网络共有119个节点,4555条边。
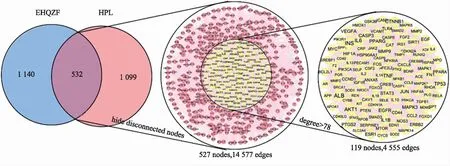
图1 PPI网络的构建和核心作用靶点的筛选
2.2“中药-活性化合物-核心靶点”的PPI网络构建 为了筛选EHQZF治疗HPL的关键中药及关键化合物,构建了“中药-活性化合物-核心靶点”网络图,见图2。根据Degree值将EHQZF治疗HPL的中药的重要性进行排序:甘草(GC,Degree=133)>丹参(DS,Degree=87)>荷叶(HY,Degree=66)>大黄(DH,Degree=63)>姜黄(JH,Degree=35)>虎杖(HZ,Degree=33)>葛根(GG,Degree=31)>白术(BZ,Degree=29)>泽泻(ZX,Degree=27)>绞股蓝(JGL,Degree=13)>僵蚕(JC,Degree=8)>水蛭(SZ,Degree=5),取Degree值排名前4位甘草、丹参、荷叶和大黄组方为QZF-Ⅰ。另外Degree值排名前10位的化合物为Quercetin、Luteolin、Kaempferol、Resveratrol、Apigenin、Protocatechuic Acid、Genistein、Emodin、Daidzein和Ferulic Acid,均为黄酮类和酚酸类化合物。根据活性成分的作用靶点排名前10位为:PTGS2、ESR1、AR、PPARG、NFE2L2、F2、GSK3B、MAPK14、NR3C1、PRKCA。
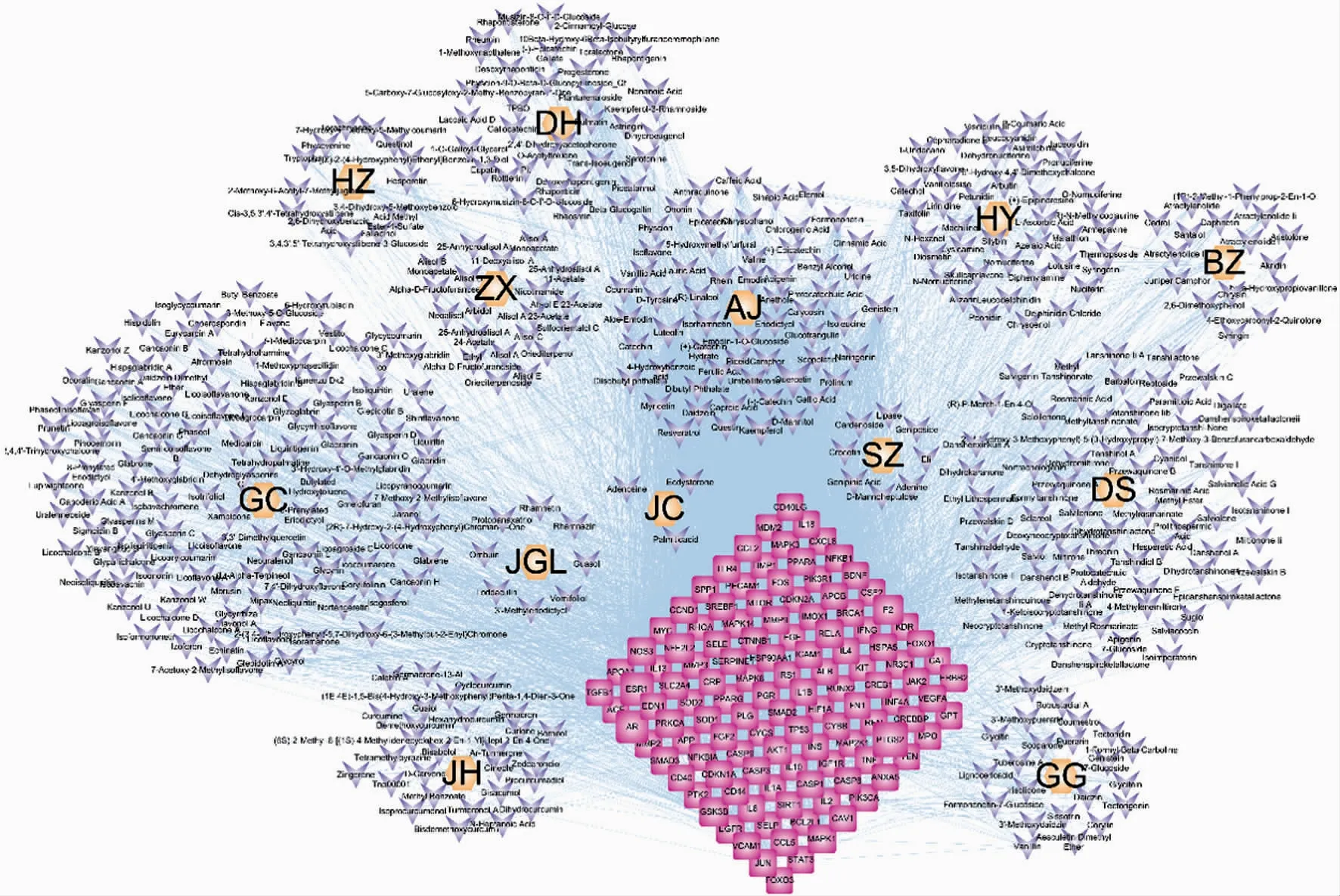
DS:丹参;HZ:虎杖;DH:大黄;JC:僵蚕;JH:姜黄;SZ:水蛭;HY:荷叶;QMS:青礞石;GC:甘草;JGL:绞股蓝;BZ:白术;ZX:泽泻;GG:葛根;六边形代表中药,锥形代表活性成分,正方形代表核心靶点,线条代表它们之间的相互作用。
2.3LC-MS定性及定量结果 EHQZF所含酚酸类和黄酮类化学成分如图3和表1所示,其中Gallic acid、Catechin、Protocatechuic acid、trans-cinnamic acid、Caffeic acid等成分在EHQZF中的含量相对较多。
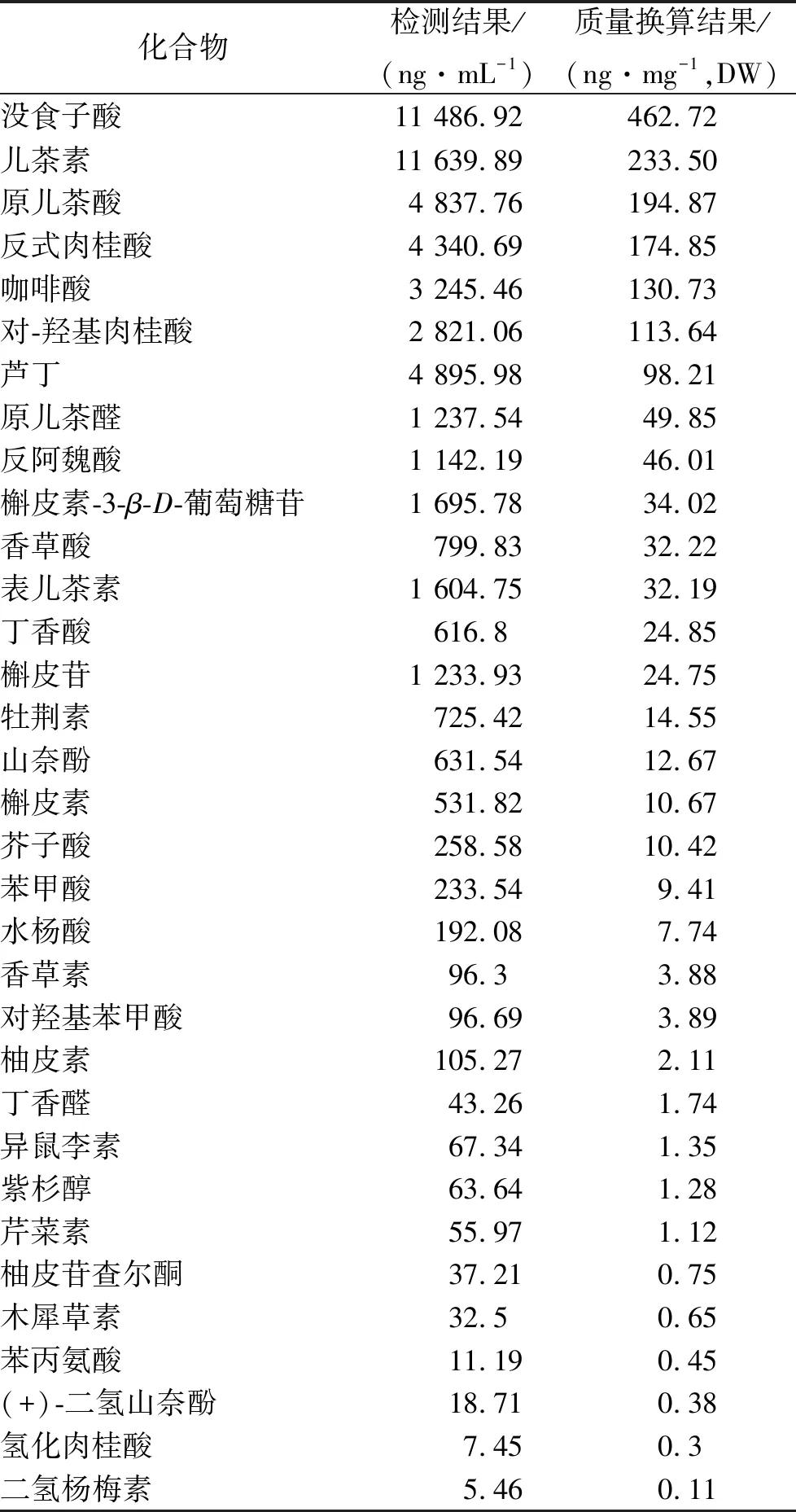
表1 EHQZF黄酮类和酚酸类化学成分的含量测定结果
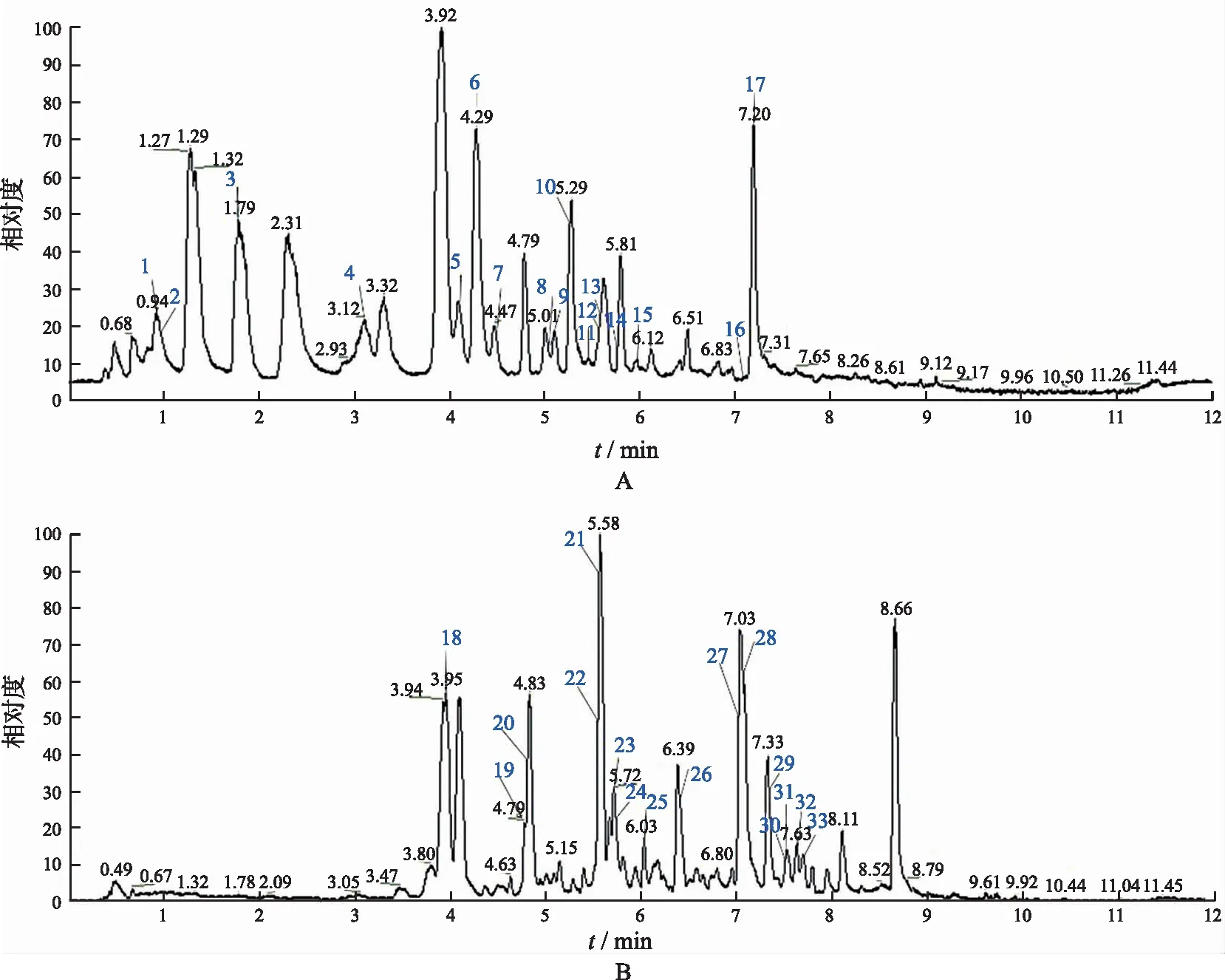
A.EHQZF中酚酸类化合物定性色谱图;B.EHQZF中黄酮类化合物定性色谱图;1.没食子酸;2.L-苯丙氨酸;3.原儿茶酸;4.原儿茶醛;5.香草酸;6.咖啡酸;7.丁香酸;8.香草素;9.对羟基苯甲酸;10.对羟基肉桂酸;11.丁香醛;12.水杨酸;13.反阿魏酸;14.芥子酸;15.苯甲酸;16.氢化肉桂酸;17.反式肉桂酸;18.儿茶素;19.表儿茶素;20.二氢杨梅素;21.芦丁;22.牡荆素;23.槲皮素-3-O-葡萄糖苷;24.(+)-紫杉醇;25.槲皮苷;26.(+)-二氢山奈酚;27.木犀草素;28.槲皮素;29.柚皮苷查尔酮;30.芹菜素;31.柚皮苷;32.山奈酚;33.异鼠李苷。
2.4EHQZF及其精简方对ABTS和DPPH的影响 结果见图4。在0.2~0.6 mg·mL-1范围内,EHQZF及其精简方对ATBS和DPPH的清除能力均随着质量浓度的增加而增加,自由基清除能力VC>QZF-Ⅰ>QZF-Ⅱ>EHQZF>BZBT,当质量浓度为0.6~1.0 mg·mL-1,ATBS的清除能力VC>QZF-Ⅰ>QZF-Ⅱ>EHQZF>BZBT,DPPH的清除能力QZF-Ⅰ>QZF-Ⅱ≈EHQZF>BZBT。QZF-Ⅰ对ATBS和DPPH的清除能力较好。
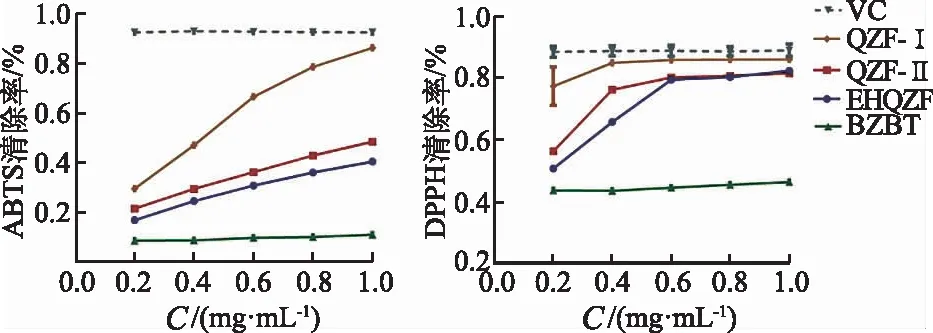
图4 EHQZF及其精简方的体外抗氧化能力(n=3)
2.5EHQZF及其精简方对HPL小鼠血清氧化指标的影响 结果见图5。与CON组比较,HPL组小鼠血清中MDA水平显著升高,T-SOD水平显著降低(P<0.01),与HPL组比较,EHQZF、QZF-Ⅰ、QZF-Ⅱ、BZBT均可降低MDA水平,升高T-SOD水平(P<0.05或P<0.01),其中BZBT降低血清MDA效果最好,其次是EHQZF,QZF-Ⅰ与QZF-Ⅱ效果相当,QZF-Ⅱ升高血清SOD的效果最好(P<0.05),其次是EHQZF、QZF-Ⅰ和BZBT。结果表明,EHQZF及其精简方在HPL小鼠中表现出明显的抗氧化能力,其中QZF-Ⅱ能力较强。
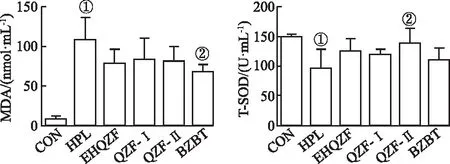
①与CON组比较,t=10.06,3.976,P<0.01;②与HPL组比较,t=3.449,2.579,P<0.05。
2.6EHQZF及其精简方对HPL小鼠肝损伤指标的影响 结果见图6。与CON组比较,HPL组小鼠血清中ALT和AST水平较高(P<0.05或P<0.01),与HPL组比较,EHQZF、QZF-Ⅰ、QZF-Ⅱ均可降低小鼠血清中ALT和AST水平(P<0.05或P<0.01),其中QZF-Ⅱ效果较好,结果表明,EHQZF及其精简方在HPL小鼠中表现出明显的抗肝损伤能力,其中QZF-Ⅱ能力较强。
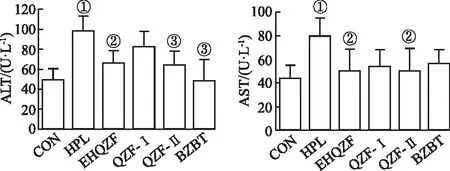
①与CON组比较,t=6.977,3.821,P<0.01;②与HPL组比较,t=2.599~4.207,P<0.05;③与HPL组比较,t=4.328,6.602,P<0.01。
2.7EHQZF及其精简方对HPL小鼠血脂四项的影响 结果见图7。HPL组小鼠血清TG、TC、LDL-C水平较CON组显著升高,而HDL-C水平较CON组显著降低(P<0.01),EHQZF、QZF-Ⅰ、QZF-Ⅱ组均可降低血清TG、TC、LDL-C水平,升高HDL-C水平(P<0.01),其中QZF-Ⅱ降低TC、TG水平的能力较强,QZF-Ⅰ降低LDL-C水平的能力较强,EHQZF及QZF-Ⅰ升高HDL-C水平的能力较强。
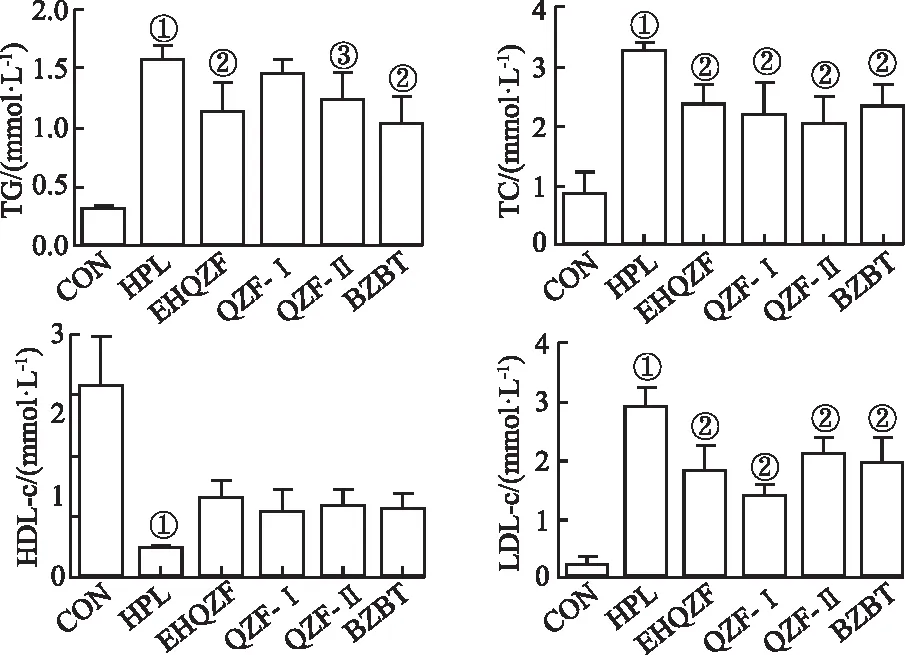
①与CON组比较,t=6.982~29.610,P<0.01;②与HPL组比较,t=3.306~10.150,P<0.01;③与HPL组比较,t=2.647,P<0.05。
2.8EHQZF对HPL小鼠肝组织匀浆炎症因子的影响 结果见图8。与HPL组比较,QZF-Ⅰ对IL-1β水平的影响不大,EHQZF及QZF-Ⅱ可明显减少IL-1β含量,其中QZF-Ⅱ减少IL-1β含量效果较好(P<0.01);与CON组比较,HPL组小鼠IL-6含量显著升高(P<0.05),EHQZF及QZF-Ⅱ 可明显减少IL-6含量,其中QZF-Ⅱ减少IL-6含量效果较好(P<0.01)。结果表明,EHQZF及QZF-Ⅱ可以降低HPL小鼠肝脏炎症因子的含量,而QZF-Ⅱ的抗炎能力最强。
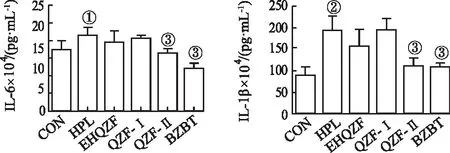
①与CON组比较,t=4.009,P<0.05;②与CON组比较,t=9.144,P<0.01;③与HPL组比较,t=4.194~14.710,P<0.01。
2.9EHQZF及其精简方对小鼠血清澄清度及肝脏形态的影响 结果见图9。与CON组比较,HPL组小鼠血清浑浊,呈乳白色;肝脏轮廓模糊,颜色发黄,表面粘连;肝组织出现严重破损,炎症细胞浸润明显,肝细胞肿大,呈空泡状,有大量脂滴蓄积;EHQZF、QZF-Ⅰ、QZF-Ⅱ组小鼠血清恢复成半透明状、肝脏的外观有所改善,空泡减少,炎症细胞浸润减轻,脂滴蓄积减少,其中QZF-Ⅱ治疗效果较好。结果表明,EHQZF、QZF-Ⅰ、QZF-Ⅱ均具有减少血清脂质蓄积,降低肝脏炎症和脂滴聚集的作用,其中QZF-Ⅱ效果最好。
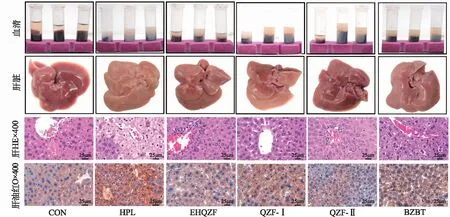
图9 EHQZF及其精简方对HPL小鼠血清澄清度、肝脏形态、肝组织病理情况、肝脏脂滴聚集的影响
3 讨论
临床验证EHQZF降血脂及防治NAFLD作用显著,但是该复方由13味药材组成,成本较高,且其防治高血脂的主要药材及有效成分不甚清晰,不利于该复方的推广。因此,本研究利用网络药理学预测EHQZF抗HPL的关键中药及有效成分,从而精简复方,分别组方为QZF-Ⅰ和QZF-Ⅱ。据报道,丹参可活血祛瘀,临床上主要用于抗氧化、降脂保肝等作用[22];荷叶可化湿清阳,具有抗肥胖和抗高TG的作用[23];姜黄是天然抗氧化剂,具有清除自由基、降血脂的潜力[24];虎杖具有利湿、清热、散瘀的功能[25];甘草可有效治疗高血脂和肝细胞脂肪变性[26];大黄可通过降低血液中ALT和TG水平,起到抗HPL的作用[27]。另外,网络药理学结合LC-MS结果表明,黄酮类和酚酸类化合物是EHQZF抗HPL的主要有效成分,据文献报道黄酮类和酚酸类化合物为中药主要有效成分,其可通过降低脂肪蓄积、抑制炎症、抗氧化从而抑制高脂血症[28]。
氧化自由基可导致脂质过氧化,与HPL和NAFLD均有关[29],在氧化脂质的生产过程中,MDA促进机体发生氧化反应[30],而SOD则是机体内抵抗氧化反应发生的酶,其可减少活性氧自由基的产生,防止代谢产物破坏机体[31]。本研究发现,EHQZF和QZF-Ⅱ抑制MDA水平,升高SOD水平的能力好于QZF-Ⅰ,而抑制ABTS和DPPH自由基的能力略差于QZF-Ⅰ,体内外抗氧化能力不同,可能是由于复方通过灌胃进入机体时部分有效成分无法被身体吸收而被排除体外,体外则保留更多的有效成分,而本处方主要是针对患者临床使用,以体内实验结果为主。因此,EHQZF和QZF-Ⅱ抗氧化能力更好。高脂血症临床表现为LDL-C、TG和TC含量增多,HDL-C含量减少[32]。因此,降低血脂水平是预防或延缓高脂血症形成的关键方法,笔者发现EHQZF提高血清HDL-C含量、降低TG含量更优,QZF-Ⅱ减少血清TC含量更优。ALT、AST是肝损伤的重要指标[33],结果表明Tyloxapol导致小鼠血清中ALT、AST含量明显升高,小鼠出现肝损伤,而EHQZF、QZF-Ⅰ、QZF-Ⅱ均可以降低血清ALT、AST水平,其中QZF-Ⅱ效果更好,说明QZF-Ⅱ的保肝作用更强。炎症在高血脂的发生和发展中起着至关重要的作用,它受IL-1β和IL-6等炎症因子的调节[34],在本研究中,EHQZF和QZF-Ⅱ可降低小鼠肝组织匀浆中IL-6、IL-1β含量,QZF-Ⅱ抗炎效果更好,而QZF-Ⅰ无明显的抗炎作用。另外,Tyloxapol诱导急性高血脂的过程往往伴随着肝脏炎症和脂肪积累[35],EHQZF、QZF-Ⅰ和QZF-Ⅱ均可改善血清澄清度,减轻肝组织炎性细胞浸润和脂滴蓄积,且QZF-Ⅱ效果更好。
综上所述,本研究发现,QZF-Ⅱ在提高血清SOD水平、降低血清肝损伤指标(ALT和AST)水平、抑制炎症因子(IL-1β和IL-6)水平,降低血清TC含量,抑制肝脏炎症和肝脏脂滴蓄积能力方面更优。EHQZF在降低血清MDA水平、提高HDL-C含量、下调血清TG含量方面更优,QZF-Ⅰ在体外抑制ABTS和DPPH自由基方面更优,综合比较发现,EHQZF和QZF-Ⅱ改善HPL能力更好,两者均可以通过抗氧化、抑制肝组织损伤、减轻肝脏炎症,降低肝脏脂滴蓄积来抗HPL,其中QZF-Ⅱ含有较少味中药,相较于EHQZF在治疗HPL方面,却起到更优的治疗效果,这对其临床应用具有一定的借鉴意义。

