miR-26a-5p 影响肝癌细胞迁移和侵袭的机制研究
范巍巍 曹萌 魏清筠
在中国,肝癌是高发性恶性肿瘤,手术切除是目前临床治疗的主要手段,但术后5 年复发率高达40%~60%,严重威胁患者的生命健康[1]。肝癌的发生、发展是一个由多基因参与的、多步骤、多阶段的由体内外多因素相互作用的复杂过程,涉及编码和非编码基因结构和表达水平的异常。微小RNA(microRNA,miRNA)是近年来研究较多的一类非编码基因,异常表达的miRNA 可能在肝细胞癌变中发挥重要作用,与肝癌转移复发、预后和治疗等紧密相关[2-4]。Li 等[5]发现,miR-26a-5p 在肿瘤组织和细胞中均异常低表达,过表达miR-26a-5p 可有效抑制肿瘤细胞的增殖生长。Ji 等[6]发现,肝癌患者miR-26-5p 的表达水平与IL-6 的表达呈负相关,而IL-6 可通过多条信号通路直接或间接影响肿瘤进程,提示miR-26a-5p 可能通过影响IL-6 相关的信号传导途径对肝癌的发生、发展起调控作用。本研究检测miR-26a-5p 和IL-6 在多种肝细胞中的表达情况,分析过表达miR-26a-5p 对肝转移性腺癌细胞SK-HEP-1 转移和侵袭能力的影响,验证miR-26a-5p与IL-6 基因的靶向作用关系,探讨其可能的分子机制,以期为肝癌复发、转移提供有价值的分子诊断标志物。
1 材料和方法
1.1 细胞和试剂
1.1.1 实验细胞及培养 人肝细胞株LO2,人肝癌细胞株HepG2、BEL-7402、SMMC-7721,高转移性肝癌细胞株MHCC97H,肝转移性腺癌细胞株SK-HEP-1,均购自富衡生物科技(上海)有限公司。所有细胞均培养于37 ℃,含5%二氧化碳(CO2)的细胞培养箱内,使用含10% FBS、100 U/ml 青霉素及100 U/ml 链霉素的高糖(dulbecco's modified eagle medium,DMEM)培养基。0.25%胰酶消化传代,倒置显微镜观察细胞生长状态。所有实验均在江苏省中医药研究院完成。
1.1.2 主要试剂 miR-26a-5p 模拟物和模拟物对照购自中国百奥迈科生物技术有限公司,批号分别为BH0930 和BIO82201。Transwell 小室(批号:2144016)购自美国Millipore 公司,Matrigel 基质胶(批号:356237)购自美国Corning 公司。pMIR-REPORT ™miRNA 表达报告基因载体系统(批号:AM5795)购自美国ThermoFisher 公司。双荧光素酶报告基因检测试剂盒(批号:E1910)购自美国普洛麦格生物技术有限公司。Trizol 提取试剂(批号:15596018)购自美国ThermoFisher 公司。MiPure 细胞miRNA 提取试剂盒、逆转录试剂和SYBR Green 实时荧光定量PCR 试剂盒均购自中国诺唯赞生物科技股份有限公司,批号分别为RC201、R323-01、Q712-02。二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(批号:P0010)购自中国碧云天生物技术有限公司。信号转导和转录激活因3(signal transducer and activator of transcription,STAT3)抗体、磷酸化STAT3(phospho- STAT3,p-STAT3)抗体、波形蛋白(Vimentin)抗体、E-钙黏蛋白(E-cadherin)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体均购自美国CST 公司,批号分别为4904T、9145T、5741S、3195T、5174T。辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(批号:20000626)购自Proteintech 公司。IL-6 ELISA 试剂盒(批号:100802)购自美国R&D公司。
1.2 方法
1.2.1 6 种细胞miR-26a-5p 表达的检测 采用实时荧光定量PCR(real-time quantitative reverse transcription PCR,qRT-PCR)法。使用miRNA 提取试剂盒提取细胞总miRNA,采用茎环法逆转录合成cDNA,根据SYBR Green qRT-PCR 试剂盒说明书方法检测细胞miR-26a-5p 相对表达量,以U6 作为内参。miR-26a-5p 引物序列:逆转录CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAGCCTATC,F-5'-ACACTCCAGCTGGGTTCAAGTAATCCAGGA-3',R-5'-TGGTGTCGTGGAGTCG-3';U6 引物序列:F-5'-CTCGCTTCGGCAGCACA-3',R-5'-AACGCTTCACGAATTTGCGT-3'。
1.2.2 6 种细胞IL-6 mRNA 表达的检测 使用Trizol试剂提取细胞总RNA,按照逆转录试剂盒说明书方法逆转录合成cDNA。根据SYBR Green qRT-PCR 试剂盒说明书方法检测细胞中IL-6 mRNA 的相对表达量,以GAPDH为内参。采用2-ΔΔCt法计算IL-6 mRNA相对表达量。IL-6 mRNA引物序列:F-5'-GGCACTGGCAGAAAACAACC- 3',R- 5'- GCAAGTCTCCTCATTGAATCC- 3';GAPDH 引物序列:F-5'-TCAGTGGTGGACCTGACCTG-3',R-5'-TGCTGTAGCCAAATTCGTTG-3'。
1.2.3 细胞转染 以1.2.1 中miR-26a-5p 表达水平最高的细胞株作为转染细胞。取对数生长期细胞调整密度至1.5~2.0×105/孔,接种于6 孔板中培养过夜。待细胞达到50%融合度时,将培养基更换为不含双抗的DMEM 培养基。使用miR-26a-5p模拟物和模拟物对照分别转染细胞,分为miR-26a-5p 模拟物组和模拟物对照组;以转染空脂质体组细胞为空白对照组,共3 组。转染4~6 h 后,将培养基更换为含10%FBS 的DMEM 培养基,37 ℃继续培养48 h,用于后续实验。
1.2.4 转染细胞中IL-6 表达的检测 采用ELISA 法。1.2.3 中各组细胞培养72 h 后,收集细胞培养液上清液,稀释后加入酶标板中。根据ELISA 试剂盒说明书方法,测定450 nm 时的光密度,以空白显色孔为对照,根据标准品所测的结果,绘制“吸光值-浓度”曲线,计算3 组细胞培养液上清液中IL-6 质量浓度。
1.2.5 转染细胞荧光素酶活性的检测 采用双荧光素酶报告实验。通过工具网站TargetScan 预测分析miR-26a-5p 与IL-6 的碱基结合位点。将野生型(Wt)的IL-6 3'-非编码区(untranslated region,UTR)的序列扩增到pMIR-Report 荧光素酶载体系统的下游位点,引物序列:F- 5'- CTATATTTTTAAGAAGTACCACTTGAAACATTTA- 3',R- 5'- AGCTTAAATGTTTCAAGTGGTACTTCTTAAAAATATAGAGC-T-3',构建荧光素报告基因质粒。设计定点突变引物,将结合位点中种子序列TT突变为AA,引物序列:F-5'-CTATATTTTTAAGAAGTACCACAAGAAACATTTA- 3',R- 5'- AGCTTAAATGTTTCTTGTGGTACTTCTTAAAAATATAGAGCT- 3',构建靶点突变型(Mut)报告基因质粒。将转染细胞以2.0×104/孔的密度接种于24 孔板中,实验分为6 组:miR-26a-5p 模拟物组、模拟物对照组、空白对照组、miR-26a-5p 模拟物+空载质粒组、miR-26a-5p 模拟物+ Wt 质粒组、miR-26a-5p 模拟物+ Mut 质粒组。共转染48 h 后,根据双荧光素酶报告基因检测试剂盒方法裂解细胞,检测并计算细胞荧光素酶相对活性。
1.2.6 转染细胞迁移能力的检测 采用细胞划痕实验。将1.2.3 中3 组细胞调整密度至2×105/ml 接种于6 孔板中,待细胞达到50%融合度时,用无菌枪头在单层细胞上直线划痕,PBS 清洗,分别于0 和48 h 时倒置显微镜观察并拍照。重复3 次实验,每次2 个复孔。对拍照视野中迁移过原划线的细胞进行计数,用Image J 软件测量两侧细胞的间距。
1.2.7 转染细胞侵袭能力的检测 采用Transwell 法。在24 孔Transwell(膜孔径8 mm)的上室加入1 g/L 的基质胶70 μl,37 ℃放置60 min 后形成基底膜结构。取1.2.3 中3 组细胞,以无血清培养基将细胞密度调整为1×105/ml,取200 μL 细胞悬液接种于上室,下室加入含10% FBS 的DMEM 培养基500 μl,37 ℃,5% CO2培养24 h 后,棉签抹去滤膜上层细胞,甲醇固定。结晶紫染色15 min。重复3 次实验,光镜观察拍照,计数穿过膜的细胞数。
1.2.8 转染细胞上皮间质转化(epithelial-mesenchymal transition,EMT)相关蛋白表达的检测 采用Western blot法。收集1.2.3各组细胞,裂解后,4 ℃12 000 r/min 离心15 min 收集总蛋白。根据BCA 试剂盒方法测定蛋白含量,经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDSPAGE),湿法转膜,5%脱脂牛奶封闭后,加入STAT3、p-STAT3、E-cadherin、Vimentin、GAPDH 等一抗,4 ℃孵育过夜;PBS 溶液洗膜3 次,加入HRP 二抗,室温孵育1 h。采用化学发光法,滴加ECL 显影液进行荧光显影,拍照保存。以鼠GAPDH 单抗作为内参,使用Image J图像处理软件分析目的条带的灰度值,计算目的蛋白相对表达量=目的条带灰度值/GAPDH 灰度值。
1.2.9 EMT 相关基因mRNA 表达的检测 采用qRTPCR 法。收集1.2.3 各组细胞,参照1.2.2 方法提取总RNA,并逆转录成cDNA,qRT-PCR 法扩增mRNA。以GAPDH 为内参,采用2-ΔΔCt法计算相关基因mRNA 相对表达量。E-cadherin 蛋白的编码基因CDH1 引物序列:F-5'-GCCTCCTGAAAAGAGAGTGGAAG-3',R-5'-TGGCAGTGTCTCTCCAAATCCG-3';N-cadherin 蛋白的编码基因CDH2 引物序列:F-5'-CCTCCAGAGTTTACTGCCATGAC-3',R-5'- GTAGGATCTCCGCCACTGATTC-3';Snail 蛋白的编码基因SNAI1 引物序列:F-5'-TGCCCTCAAGATGCACATCCGA-3',R-5'-GGGACAGGAGAAGGGCTTCTC-3';Slug 蛋白的编码基因SNAI2引物序列:F-5'-ATCTGCGGCAAGGCGTTTTCCA-3',R-5'-GAGCCCTCAGATTTGACCTGTC-3'。
1.3 统计学处理 采用GraphPad Prism 8.0 统计软件,计量资料多组间比较采用单因素方差分析,两两比较采用LSD-t法。P<0.05 为差异有统计学意义。
2 结果
2.1 6 种细胞miR-26a-5p 和IL-6 mRNA 相对表达量的比较 相比LO2,BEL-7402、SMMC-7721、MHCC97H和SK-HEP-1 细胞中miR-26a-5p相对表达量均显著降低(均P<0.05),其中SK-HEP-1 细胞中miR-26a-5p 相对表达量最低,见图1A。相比LO2,BEL-7402、SMMC-7721 和SK-HEP-1 细胞中IL-6 mRNA 相对表达量显著升高(P<0.05),其中SK-HEP-1 细胞的IL-6 相对表达量最高,见图1B。因此后续实验以SK-HEP-1作为研究对象。
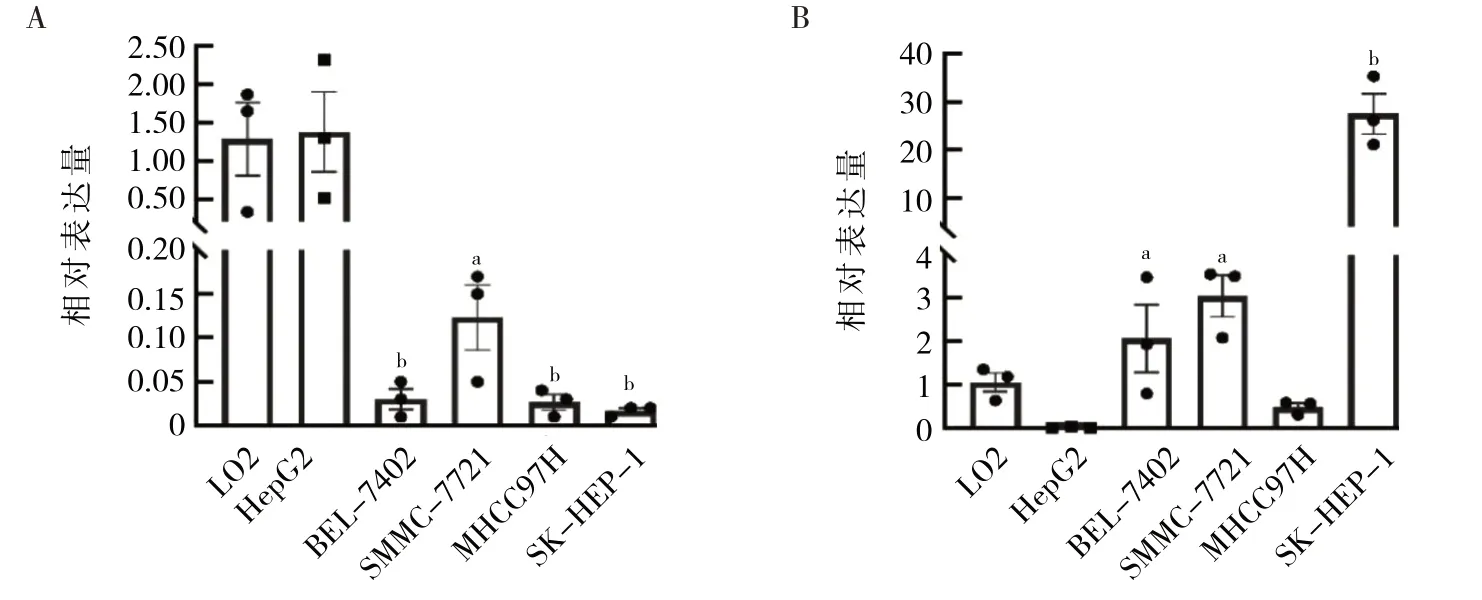
图1 6 组细胞miR-26a-5p 和IL-6 mRNA 相对表达量的比较(A:miR-26a-5p;B:IL-6)
2.2 3 组转染细胞中miR-26a-5p 和IL-6 表达的比较与模拟物对照组比较,miR-26a-5p 模拟物组细胞中miR-26a-5p相对表达量显著升高(P<0.01),可用于后续功能试验分析;miR-26a-5p 模拟物组IL-6 mRNA 和蛋白相对表达量均显著降低(均P<0.05)。空白对照组和模拟物对照组miR-26a-5p、IL-6 mRNA 和蛋白相对表达量比较,差异均无统计学意义(均P>0.05),见图2。
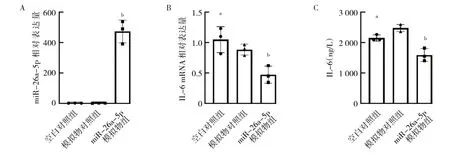
图2 转染细胞中miR-26a-5p和IL-6表达的比较(A:miR-26a-5p相对表达量;B:IL-6 mRNA 相对表达量;C:IL-6蛋白相对表达量)
2.3 转染miR-26a-5p 细胞荧光素酶活性的比较TargetScan 预测发现,IL-6 mRNA 的3'-UTR 存在miR-26a-5p 高度保守的靶向结合位点,见图3A。与模拟物对照组比较,miR-26a-5p 模拟物组IL-6 3'-UTR 荧光素酶相对活性显著降低(P<0.05);空白对照组和模拟物对照组荧光素酶相对活性比较,差异无统计学意义(P>0.05)。与miR-26a-5p 模拟物+Mut 质粒组比较,miR-26a-5p 模拟物+Wt 质粒组IL-6 3'-UTR 荧光素酶相对活性显著降低(P<0.05);miR-26a-5p 模拟物+Mut 质粒组和miR-26a-5p 模拟物+空载质粒组比较,荧光素酶相对活性差异无统计学意义(P>0.05),见图3B。说明miR-26a-5p 与靶基因IL-6 mRNA 3'-UTR 的结合作用是序列特异的。

图3 miR-26a-5p 与IL-6 mRNA 3'-UTR 的靶向结合关系(A:Wt 和Mut IL-6 3'-UTR 与IL-6 mRNA 的潜在结合位点示意图;B:6 组细胞荧光素酶相对活性的比较)
2.4 3 组转染细胞迁移能力的比较 相比空白对照组和模拟物对照组,miR-26a-5p 模拟物组细胞迁移数量显著降低(P<0.01),细胞间划痕的距离显著增大(P<0.01),见图4。提示miR-26a-5p 抑制细胞迁移。2.5 3 组转染细胞侵袭能力的比较 与模拟物对照组比较,miR-26a-5p 模拟物组细胞侵袭数显著减少(P<0.01);空白对照组和模拟物对照组细胞侵袭能力比较,差异无统计学意义(P>0.05),见图5。

图4 miR-26a-5p 对细胞迁移的影响(A:划痕实验检测48 h 后3 组细胞迁移情况,×40;B:3 组细胞迁移数量比较;C:3 组细胞间划痕距离比较)
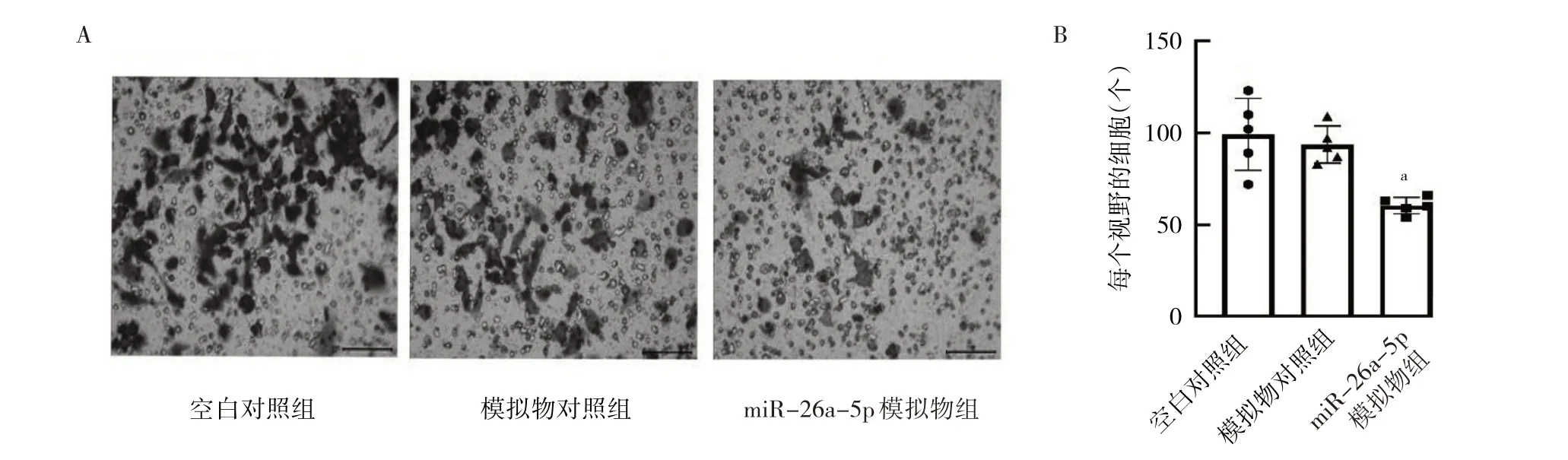
图5 miR-26a-5p 对细胞侵袭的影响(A:Transwell 实验检测3 组细胞的侵袭能力,×100;B:3 组细胞侵袭数比较)
2.6 3 组细胞STAT3 蛋白磷酸化水平和EMT 相关蛋白表达的比较 与模拟物对照组相比,miR-26a-5p 模拟物组p-STAT3/STAT3 表达水平显著降低(P<0.01),模拟物对照组与空白对照组比较,差异无统计学意义(P>0.05),提示STAT3 蛋白水平基本不变,但p-STAT3蛋白水平降低,见图6A-B。与模拟物对照组相比,miR-26a-5p 模拟物组E-cadherin 表达水平显著增加,Vimentin 表达水平显著降低,差异均有统计学意义(均P<0.05),见图6C-D。

图6 miR-26a-5p 对细胞STAT3 蛋白磷酸化及EMT 相关蛋白表达的影响(A:3 组细胞STAT3 和p-STAT3 蛋白电泳图;B:3 组细胞STAT3 和p-STAT3 蛋白相对表达量比较;C:3 组细胞E-cadherin 和Vimentin 蛋白电泳图;D:3 组细胞E-cadherin 和Vimentin 蛋白相对表达量比较)
2.7 3 组细胞EMT 相关基因mRNA 表达的比较 与模拟物对照组相比,miR-26a-5p 模拟物组细胞中CDH1 mRNA 表达水平显著升高,CDH2、SNAI1、SNAI2 mRNA表达水平显著降低,差异均有统计学意义(均P<0.01),见图7。

图7 3 组细胞EMT 相关基因mRNA 表达的比较
3 讨论
miR-26a-5p 全长22 nt,其表达失调与多种肿瘤演进过程有关[4-5]。研究发现,肝癌组织的miR-26a-5p 表达显著低于癌旁肝组织,且低表达的患者预后较差,总生存率低[6]。miR-26a-5p 在肝癌组织和细胞中均异常低表达,过表达miR-26a-5p 可有效抑制肝癌细胞的增殖和迁移[7-10]。miR-26a-5p 的下调与肝癌患者肿瘤复发、转移和预后不良显著相关。Yang 等[11]发现,肝癌患者miR-26a-5p 表达水平与IL-6 表达呈负相关;联合检测miR-26a-5p 和IL-6 可作为判断总生存期的独立预后指标。TargetScan 预测发现,IL-6 mRNA 的3'-UTR 是高度保守的miR-26a-5p 的靶向区。推测miR-26a-5p 可能通过参与IL-6 相关的信号传导途径对肝癌的发生、发展起调控作用[12-13]。
Trohatou 等[9]在体外培养HepG2 细胞时加入IL-6,结果发现原癌基因(v-myc avian myelocytomatosis viral oncogene homolog,c-Myc)激活,miR-26a-5p 的表达被抑制。与钱建升等[14]和Ma 等[15]发现的过表达miR-26a-5p 可抑制HepG2 和SMMC-7721 的增殖和迁移的结果一致。但要注意的是,不同肝癌细胞中miR-26a-5p 和IL-6 的表达水平不同[16]。本研究检测并比较了miR-26a-5p 和IL-6 mRNA 在正常人肝细胞和人肝癌细胞系中的表达情况,结果发现HepG2 中miR-26a-5p高表达,IL-6 mRNA 几乎不表达,而SK-HEP-1 刚好相反。使用化学合成miR-26a-5p 模拟物转染SK-HEP-1,结果发现胞内miR-26a-5p 相对表达量显著升高,IL-6 mRNA 相对表达量显著降低,IL-6 蛋白相对表达量也相应降低。双荧光素酶报告基因实验证实了miR-26a-5p 与IL-6 mRNA 3'-UTR 存在靶向关系,且两者结合存在序列特异性。划痕实验和Transwell 实验进一步证实,过表达miR-26a-5p 能显著抑制肝癌细胞迁移和侵袭。
IL-6 是肿瘤微环境中一种含量丰富的多能性细胞因子,通过Janus 激酶(Janus-activated kinase,JAK)/STAT 和NF-κB 等信号通路对肿瘤发生、发展产生直接或间接作用[17-20]。IL-6 信号激活会引起JAK 磷酸化,并诱导下游关键信号STAT3 磷酸化,活化的STAT3形成二聚体转移入核,激活调控基因的转录活性,从而发挥生物学效应[21]。研究发现,大多数肝细胞癌患者体内IL-6/STAT3 信号异常激活[22-23]。IL-6/STAT3 信号不仅对原发性肝癌有影响,还会通过形成促转移生态位造成肿瘤转移,导致继发性肝癌[24]。故STAT3 被认为是介导IL-6 功能的最主要转录因子。EMT 是上皮细胞去分化转化为间充质表型的生物学过程,被普遍认为参与了肝癌的早期转移进程[25-26]。EMT 发生时,上皮细胞分子标志物E-cadherin 表达降低,间质细胞分子标志物Vimentin 表达增加[27]。Zhang 等[28]在人肝癌细胞株SMMC-7721 和MHCC97H 中过表达STAT3,结果发现E-cadherin 表达显著下调,Vimentin 表达显著上调,进一步STAT3 信号传导通路在肝癌侵袭和转移过程中起重要作用[29-30]。
本研究在高转移肝癌细胞SK-HEP-1 中过表达miR-26a-5p,结果发现肝癌细胞迁移和侵袭被有效抑制,其可能机制是通过靶向抑制IL-6 mRNA,下调STAT3 磷酸化,升高上皮标志E-cadherin 表达和降低间质标志Vimentin 表达。即过表达miR-26a-5p 通过IL-6/STAT3 轴抑制肝癌细胞的迁移和侵袭,可能是治疗肝癌转移的潜在策略。

