武陵酱香型白酒七轮次高温堆积细菌群落多样性分析
孟镇,张媛媛,田雨,郭新光,康忠媛,姬钰,胡雯钦,陈家好*
(1.中国食品发酵工业研究院有限公司,北京 100015;2.全国食品发酵标准化中心,北京 100015;3.中轻检验认证有限公司,北京 100015;4.湖南武陵酒有限公司,湖南常德 415001)
中国白酒酿造具有悠久的历史,以独特的风味和酒文化成为世界六大名酒之一[1]。白酒的发酵过程与其他烈酒有很大的不同,通常是由谷物,如高粱和大米等在固态条件下通过多种微生物发酵产生[2-3]。酱香型是中国白酒三大典型香型之一,主要产区包括贵州、四川、山东、湖南等,因其“无色(或微黄)透明,酱香突出,幽雅细腻,醇厚协调,回味悠长,空杯留香持久”的特点,深受国内广大消费者的喜爱,在国际市场上也屡获好评[4]。酱香型白酒独特的风味主要源于其独特的酿造工艺,传统酱香型白酒采用“四高一长一大一多”的生产工艺,即高温制曲、高温堆积、高温发酵、高温馏酒和长期储存[5]等工艺。高温堆积工艺又称“二次制曲”[6],是酱香型白酒酿造过程中不可缺少的典型工艺之一,是指将粮食原料蒸煮糊化后,拌入高温大曲,在窖池旁边场地自然发酵的过程,期间可在空气和环境中网罗、富集微生物,形成独特的微生物群落结构,共同参与醅料糖化发酵,积累微生物酶类,形成风味前体物质、产酯产香[7]。根据研究发现,高温堆积的时间、温度和微生物群落结构等对酱香型白酒酒体风味质量等具有较大的影响[8]。
近年来,随着高通量测序技术的不断发展,由于其分析微生物群落多样性具有快速、通量高、更具全面性的优势[9-12],已被广泛用于白酒酿造过程中微生物群落结构的研究[13]。张春林等[14]采用高通量测序技术分析酱香型白酒二轮次堆积发酵过程中酒醅微生物群落结构组成情况,并探讨微生物与理化指标的相关性;孙利林等[15]采用高通量测序技术解析酱香型白酒第四轮次酿造过程中高温大曲、酒醅(堆积酒醅、窖内酒醅)和窖泥的细菌多样性,结果表明,堆积发酵微生物组成与发酵车间环境有关;王欢[16]采用高通量测序技术对酱香型白酒三轮、四轮、五轮次堆积发酵酒醅进行研究,共检出17 个细菌门、5 个真菌门,其中14 个细菌属是堆积酒醅中的重要菌属;王欢等[17]采用高通量测序技术对酱香型白酒机械化酿造不同轮次堆积发酵细菌菌群结构多样性进行分析,结果显示,7 各轮次中共检出14 个门,456 个属,Caulobacter和Rhodococcus为机械化酿造过程中的特有菌属,可能来源于机械设备和环境。
细菌是酱香型白酒堆积过程中生香和产酶的关键功能微生物,对酒体风味的形成有着重要的影响,不同地区、季节高温堆积发酵过程中微生物的结构存在着明显差异。本研究采用Illumina MiSeq高通量测序技术系统全面研究武陵酱香型白酒1—7 轮次高温堆积酒醅样品中细菌群落结构的分布特征和多样性,有助于科学认识酱香白酒不同产区的独特性以及不同酿造环境对白酒酿造的影响机制,为酱香型白酒高温堆积发酵调控提供理论依据。
1 材料与方法
1.1 材料、试剂及仪器
样品:取自湖北武陵酒有限公司(28.14°N,106.18°E)堆积发酵酒醅,采样时间为2020 年9 月—2021 年7 月。堆积酒醅样品从堆积1 d 开始至堆积结束(堆放的顶温达到50 ℃)每天取样。具体采样方案如图1 所示,每天分别从A(顶部)、B(中心)、C(中心层表面)、D(底层)、E(底层表面)同一位置进行取样,取样后将每一轮同一天A—E点采集的5 个样品等质量混合后置于无菌自封袋中,-80 ℃保存备用。将同一轮次所采集的样品等质量混合均匀后作为该轮次高温堆积样品,最终,1—7 轮次共获得7 个混合的样品。
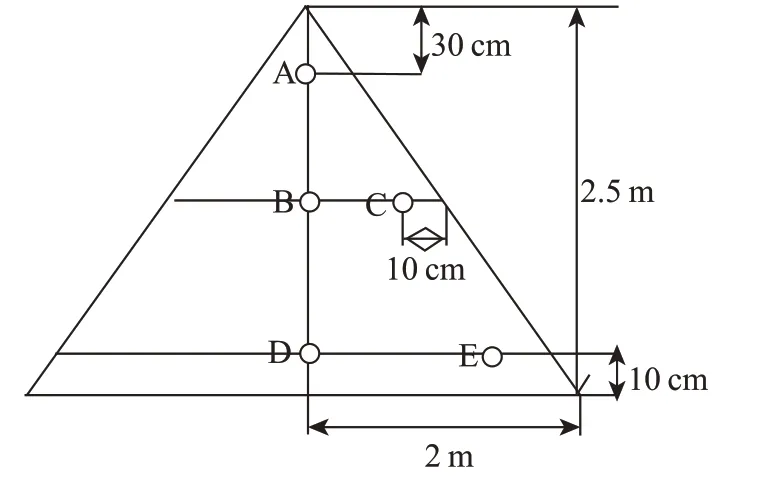
图1 高温堆积酒醅样品采样点
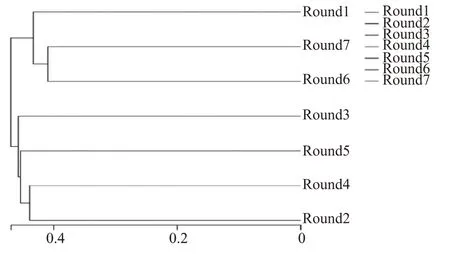
图3 基于UniFrac 非加权的堆积酒醅样品UPGMA 聚类
试剂及耗材:DNA 提取试剂盒,美国Omega BioTek 公司;AxyPrep DNA 凝胶回收试剂盒,美国AXYGEA 公司;rTaq DAN 聚合酶试剂盒,北京全式金生物技术有限公司;DNA marker,北京全式金生物技术有限公司;引物合成,生工生物工程(上海)股份有限公司。
仪器设备:ABI Gene AmpR 9700 型聚合酶链式反应(polymerase chain reaction,PCR)扩增仪,美国ABI 公司;DYY-8C 型高压电泳仪,北京六一仪器厂;JS-680C 凝胶成像仪,上海培清科技有限公司;Illumina MiSeq 测序平台,上海美吉生物医药科技有限公司;QuantiFlourTM-ST 蓝色荧光定量系统,美国Promega 公司。
1.2 试验方法
1.2.1 样品DNA 提取及16S rDNA 测序分析
采用E.Z.N.A.® Soil DNA Kit(D5625-01)进行样品提取。完成基因组DNA 抽提后,使用1%琼脂糖凝胶电泳检测基因组DNA,用NanoDrop2000 进行浓度的检测。使用细菌的16S rDNA 通用引物对样品提取的DNA 进行PCR 扩增,16S rDNA V4,可变区引物338F(5'-ACTCCTACGGGAGGCAG‐CAG-3')和806R(5'-GGACTACHVGGGTWTCTA‐AT-3),每个样本3 个重复,将同一样本的PCR 产物混合后用2 %琼脂糖凝胶电泳检测,使用AxyPrep DNA 凝胶回收试剂盒切胶回收PCR 产物,Tris-HCl 洗脱;2 %琼脂糖电泳检测。参照电泳初步定量结果,将PCR 产物用QuantiFlourTM-ST 蓝色荧光定量系统进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。再利用Illumina MiSeq 进行测序分析。
1.2.2 高通量测序
采用Illumina 高通量测序技术,基于Illumina MiSeq 测序平台,分别对细菌V3—V4 高变区序列进行测序分析(上海美吉生物医药科技有限公司)。
1.2.3 数据及图像处理
采用Microsoft Office Excel 2016 进行数据计算和分析。基于Illumina MiSeq 测序平台,利用R 语言、Origin 作图软件、QIIME 软件、SIMCA 14.1 绘制稀释曲线、样本层级聚类树和丰度图等。
2 结果与分析
2.1 测序统计结果和多样性指数分析
利用Illumina Miseq 高通量测序平台对不同轮次高温堆积酒醅样本进行测序分析,由表1 可知,8个样品中共得到细菌有效序列641505 条,平均每个样本91644 条,样品测序的覆盖率均大于0.988,保证了测序数据质量科学可靠。由图2 稀释性曲线可知,随着采样序列数的增加,样品覆盖度增加,当测序序列数>45000 时,样品OTU 稀释曲线趋于平坦,说明各样本的测序数据量合理,测序深度足够,与实际生物信息相符合,可覆盖样本中绝大多数细菌多样性信息。进一步说明本次测序结果质量较高,科学可靠,本实验测序结果可有效满足后续对酱香型白酒高温堆积酒醅样品中微生物群落结构的研究。
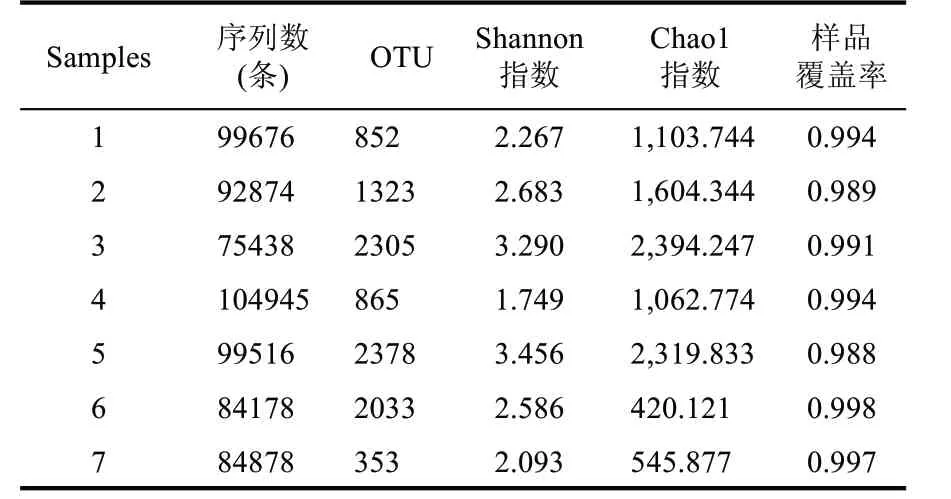
表1 高温堆积酒醅样品高通量测序数据统计结果
Alpha 多样性可以反映微生物群落的丰富度和多样性[18]。选取Chao1 指数和Shannon 指数对7 个轮次高温堆积酒醅样品的Alpha 多样性进行分析,Shannon 指数用来估算样品中微生物的多样性,Shannon 值越大,说明群落多样性越高;Chao1 指数是用Chao1 指数算法估计群落中含OTU 数目,在生态学中常用来估计物种总数,Chao1 值越大代表物种总数越多,表明群落的丰富度越高。由表1 可知,除4 轮次外,随着轮次的增加,Shannon 指数整体呈现先上升后降低的趋势,说明随着轮次的增加细菌多样性先增加后下降。Chao1 指数表明随着轮次增加,物种的总数先上升后下降,且6—7 轮次物种总数远低于前5 轮次的物种总数。
2.2 细菌群落结构组成差异
使用非加权组平均法(unweighted pair-group method with arithmetic mean,UPGMA)对样品进行聚类,综合序列同源性、OTU 的丰度和组成,了解武陵酱香型白酒不同轮次高温堆积酒醅样品细菌群落结构差异。图3 为1—7 轮次高温堆积酒醅样品的聚类结果,由图3 可知,各轮次高温堆积酒醅细菌群落结构组成具有明显差异。7 个轮次高温堆积酒醅样品聚类分成两支,1 轮次与6 轮次、7 轮次聚为一支;3 轮次、5 轮次、4 轮次和2 轮次聚为一支,说明1 轮次、6 轮次和7 轮次与3 轮次、5 轮次、4轮次和2 轮次中的细菌群落具有明显差异。
2.3 细菌群落结构多样性
2.3.1 门水平群落结构组成
通过USEARCH 将标签分组成具有97 %相似性的可操作分类单元(operational taxonomic unit,OTU),将每个OTU 与数据库进行比对,选取置信度阈值,即相似度在97 %以上的序列进行物种分类,得到每个OTU 的分类水平,即门、纲、目、科、属分类水平。
基于门水平细菌菌群结构见图4。如图4 所示,7 个轮次的高温堆积酒醅样品中共检测出39 个门,一轮次30 个,二轮次12 个,3 轮次13 个,4 轮次12 个,5 轮次18 个,6 轮次17 个,7 轮次18 个。在各轮次堆积样品中,变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)为各个轮次共有的优势细菌门(相对丰度≥1 %)。变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)在不同轮次高温堆积酒醅样品中相对丰度占89.51 %以上,变形菌门(Proteobacte‐ria)随着轮次的增加相对丰度占比逐渐升高,在第3 轮次时其相对丰度已达到50.91%以上,并在后面几个轮次中稳定在85.36 %~72.37 %,成为主导的优势菌门。厚壁菌门(Firmicutes)随着轮次增加相对丰度占比呈整体下降趋势,1—3 轮次中相对丰度较高在38.60 %以上,4—6 轮次时相对丰度稳定在10.07 %~16.01 %,7 轮次相对丰度又有明显的增加,达到24.41%。研究资料表明,厚壁菌门和变形菌门是浓香型[19-21]、酱香型[17]、清香型[22]和芝麻香型[21]白酒酿造过程中的主要细菌门。黎瑶依[23]采用高通量测序分析方法对茅台地区酱酒高温堆积酒醅进行分析,认为放线菌门和厚壁菌门为主要的细菌门。由此可见,本研究结论与其他研究者的结论具有一致性。
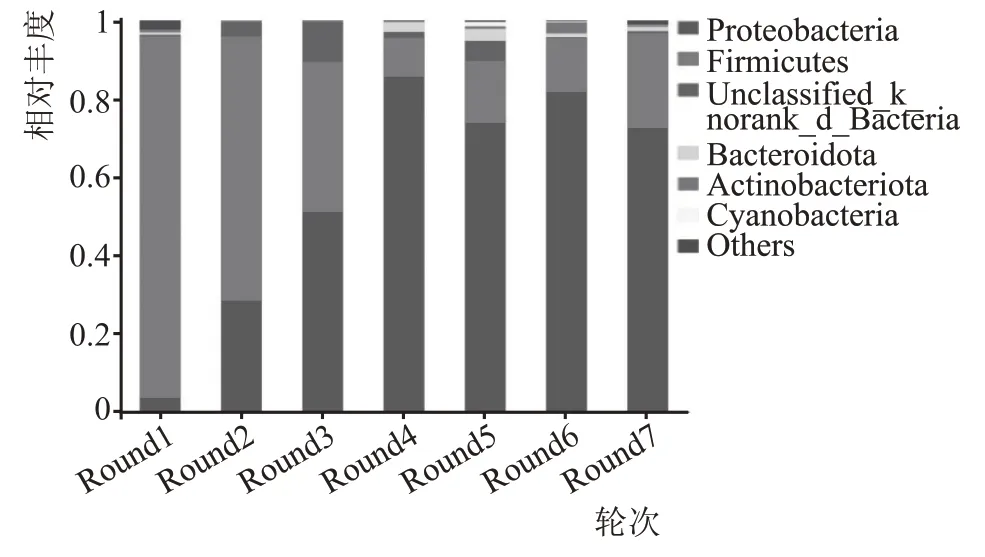
图4 不同轮次主要细菌菌群落结构(门水平)
2.3.2 属水平群落结构组成
基于属水平细菌菌群结构见图5,如图5 所示,7 轮次高温堆积酒醅样品中共检测出756 个属,1—7 轮次依次检出293 个、108 个、167 个、170 个、291个、180 个和249 个属,说明7 个轮次高温堆积酒醅样品中的主要细菌群落具有一定的差异。1 轮次高温堆积发酵酒醅中的优势菌属(>1 %)有4 个,分别为乳杆菌属(Lactobacillus)、小球菌(Pediococcus)、克罗彭施泰特氏菌属(Kroppenstedtia)和醋杆菌(Acetobacter),总相对丰度为89.20 %;2 轮次有3 个,为乳杆菌属(Lactobacillus)、醋杆菌(Acetobacter)和unclassified f__Bacteria,总相对丰度为98.32 %;3 轮次有4 个属,为醋杆菌(Acetobacter)、乳杆菌属(Lactobacillus)、unclassified f__Bacteria和劳尔氏菌属(Ralstonia),总相对丰度为97.04 %;4 轮次有8 个属,包括醋杆菌(Acetobacter)、乳杆菌属(Lactobacillus)、unclassified_Lachnospiraceae、un‐classified f__Bacteria、克罗彭施泰特氏菌属(Kroppenstedtia)、Muribaculaceae、Alistipes和Lachnospiraceae_NK4A136,总相对丰度为95.64 %;5 轮次有8个属,包括醋杆菌(Acetobacter)、unclassified f__Bacteria、乳杆菌属(Lactobacillus)、罗氏菌属(Roseburia)、琥珀酸弧菌属(Succinivibrio)、拟杆菌属(Bacteroides)、Chloroplast和克罗彭施泰特氏菌属(Kroppenstedtia),总相对丰度为85.06 %;6 轮次有6 个属,包括醋杆菌(Acetobacter)、Massilia、芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)、克罗彭施泰特氏菌属(Kroppenstedtia)和双歧杆菌属(Bifidobacterium),总相对丰度为90.86 %;7 轮次有8 个属,包括醋杆菌(Acetobacter)、罗彭施泰特氏菌属(Kroppenstedtia)、假单胞菌属(Pseudomonas)、乳杆菌属(Lactobacillus)、Ureibacillus、高温放线菌属(Thermoactinomyces)和小球菌属(Pediococcus),总相对丰度为91.24%。对各轮次优势菌属进行分析发现,各轮次中共有的优势菌属为乳杆菌属(Lactobacillus)和醋杆菌(Acetobacter)。
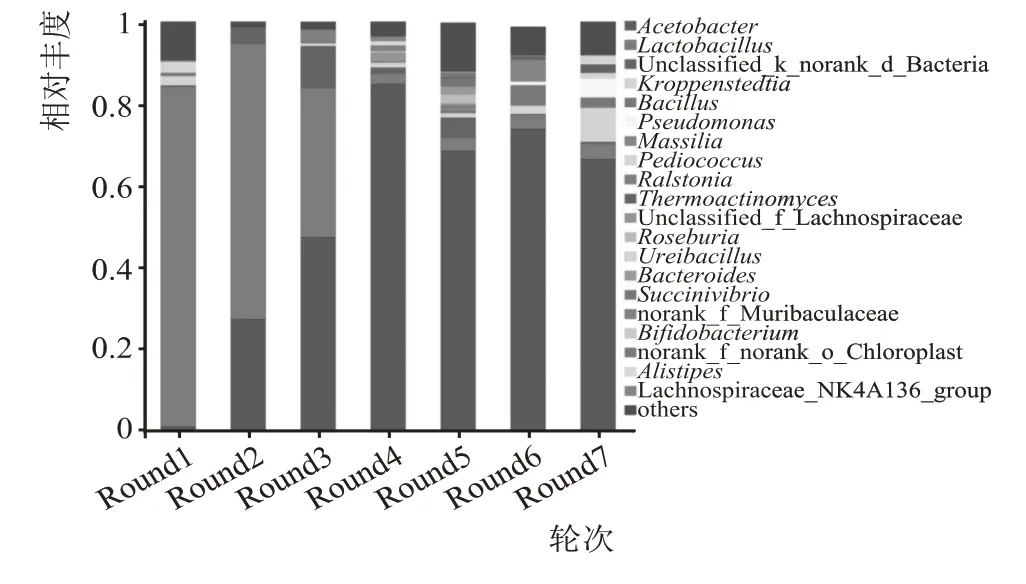
图5 不同轮次细菌群落结构(属水平)
由于各轮次发酵酒醅的不断蒸煮、发酵、糊化以及外界环境的改变,武陵酱香型白酒不同轮次高温堆积酒醅样品细菌群落结构多样性明显,具有一定的差异,但也具有一定的共性特征。在1—7 轮次中除1 轮次和5 轮次外,随着轮次的增加,高温堆积酒醅样品中细菌群落菌属逐渐增加;从3 轮次开始乳杆菌属(Lactobacillus)相对丰度占比逐渐减少,醋杆菌属(Acetobacter)逐渐增加,成为主导优势菌属。1 轮次样品的多样性较高,且大于其他轮次,可能是由于1 轮次高温堆积酒醅中除添加高温大曲外,酿造环境中细菌种属较高,额外添加的酿造高粱从外界带入大量的微生物,使酒醅样品中细菌群落结构更为丰富。5 轮次的微生物结构多样性大于其他轮次,可能因为5 轮次时处盛夏时节,环境中温度和湿度较高,有利于微生物的生长。
2.4 核心微生物群落及功能
参考Wolfe[24]和Hu[25]对核心微生物的定义,将平均相对丰度大于1 %,且至少出现在一个样品以上的属被定义为核心微生物属。研究发现武陵酱香型白酒各轮次高温堆积酒醅样品中细菌平均大于1 %,且出现在1 个样品以上的核心细菌属有5个,分别为乳杆菌属(Lactobacillus)、醋杆菌属(Acetobacter)、芽孢杆菌属(Bacillus)、克罗彭施泰特氏菌属(Kroppenstedtia)和unclassified f__Bacte‐ria,分别占各轮次总丰度的86.75 %、98.36 %、95.044.73 %、89.99 %、77.73 %、80.38 %和83.69 %,相对丰度均大于77.73 %,说明这5 个菌属一直稳定存在于各轮次高温堆积酒醅样品中,是主导性菌群结构,因此将这5 个菌属认定为武陵酱香型白酒核心微生物群落。
为进一步解析武陵酱香型白酒高温堆积过程中各轮次的核心微生物情况,对上述核心微生物在各轮次分布进行了分析。乳杆菌属(Lactobacillus)在1—3 轮次为优势菌属,该菌属在1 轮次相对丰度最高为83.16 %,2 轮次开始逐渐下降,到3 轮次时相对丰度降至36.47 %,4—7 轮次相对丰度较为稳定,保持在2.55 %~3.81 %之间。结果与王欢等[17]在酱香型白酒机械化酿造7 轮次高温堆积酒醅中细菌群落结构研究较为一致。相关研究表明,乳杆菌属(Lactobacillus)在多种香型白酒发酵过程都被检出过,是中国白酒发酵过程中的主要功能细菌属,其在白酒酿造过程中主要参与调控,可维持微生物间结构平衡,同时在发酵过程中代谢产生乳酸、乙酸等有机酸类物质,为白酒中风味物质的合成提供前体物,影响酒体风格的形成[26]。醋杆菌属(Acetobacter)在3—7 轮次为优势菌属,该菌属在1轮次相对丰度为1.02 %,2 轮次时上升至27.29 %,随后逐渐上升,4 轮次时达到最大值为84.79 %,5轮、6 轮、7 轮次后逐渐下降,但相对丰度变化不大,在66.36 %~73.72 %。该菌属是白酒酿造过程中重要的微生物,能够在白酒发酵过程中将乙醇转化为乙酸,为白酒中风味物质的合成提供前体物质[23]。王欢等[16]对酱香型白酒3 轮、4 轮、5 轮次堆积发酵酒醅样品的研究发现醋杆菌属(Acetobacter)为3 轮、4 轮、5 轮次堆积发酵过程中的优势菌属。
芽孢杆菌属(Bacillus)在1—7 轮次中相对丰度较低,研究发现,该菌属是清香型、酱香型白酒发酵过程的共有优势细菌属[27],能够代谢产生乙偶姻及4-甲基吡嗪等白酒中重要的风味物质,对白酒的风味物质有重要贡献[28]。克罗彭施泰特氏菌属(Kroppenstedtia)为1 轮、4 轮、5 轮、6 轮、7 轮次的优势菌属,研究表明,其为酱香型白酒[29]和芝麻香型白酒[30]大曲中优势菌属,但其在白酒酿造过程中的主要功能及作用目前尚不明确。
3 结论
本研究采用Illumina MiSeq 高通量测序技术对武陵酱香型白酒1—7 轮次高温堆积酒醅样品细菌群落结构特征进行分析,7 个轮次中共检出39 个门和756 个属。门水平上,各轮次共有的优势菌门(相对丰度≥1 %)为变形菌门(Proteobacteria)和厚壁菌门(Firmicutes);属水平上,武陵酱香型白酒7个轮次高温堆积酒醅样品中细菌群落结构具有多样性特点,同时有一致性和差异性;细菌平均相对丰度大于1 %,且出现在1 个样品以上的核心细菌属有5 个,分别为乳杆菌属(Lactobacillus)、醋杆菌属(Acetobacter)、芽孢杆菌属(Bacillus)、克罗彭施泰特氏菌属(Kroppenstedtia)和unclassified f__Bac‐teria;各轮次共有的优势菌属(相对丰度≥1%)为乳杆菌属(Lactobacillus)和醋杆菌(Acetobacter)。本研究结果揭示了武陵酱香型白酒1—7 轮次高温堆积酒醅样品中细菌群落结构与特征,为酱香型白酒高温堆积酿造过程中群落结构变化规律解析及精准调控提供了理论依据。

