牛乳中原生低聚半乳糖的酶法合成及响应面优化
罗俊溢,武伦玮,付永刚,巴根纳,韩仁娇 ,金丽娜
1.内蒙古伊利实业集团股份有限公司(呼和浩特 011500);2.内蒙古乳业技术研究院有限责任公司(呼和浩特 010110);3.国家乳业技术创新中心(呼和浩特 010110)
低聚半乳糖(Galacto-oligosaccharide,GOS)是在乳糖分子的半乳糖基侧以β-糖苷键的形式连接1~7个半乳糖基形成的混合杂聚糖[1-4]。现代医学及营养研究表明,食用GOS后会刺激肠道益生菌(以乳酸菌和双歧杆菌为主)的增殖,肠道益生菌菌株比例增加后,则会抑制肠道有害菌群的增长,并起到调节机体免疫反应和调节机体代谢产物的结构及组成等作用[5-6],进一步可实现改善机体对矿物元素的吸收[7]、便秘的预防和改善[8]、肥胖的预防和改善[9]、龋齿的预防[10]、血清胆固醇水平的降低[11]甚至肿瘤的防治[12]等对人体健康能产生积极影响的功能。因此将GOS的研究运用到新食品的开发具有重要意义。
经过提纯后的GOS的外观通常为半透明的微黄色或者无色,黏度较低、甜度约为蔗糖的25%,在酸性环境下稳定性好,对热的稳定性也较高,口感和品质均较为优异[13-14]。现阶段关于GOS的提取或制备方式主要有4种:一是天然分离法,主要从食品原料中直接分离出GOS,但是食品中的GOS通常表现为电中性,对其有效分离较难[14-15];二是水解法,主要通过对多糖进行水解,并提取水解产物中低聚糖,但多糖的成分相对复杂,其水解产物多样、结构复杂,以致GOS的转化率通常不高,难以获得含量较高的GOS产品[16];三是化学合成法,通过有机合成原理制备GOS,但是该法通常存在提取试剂毒性较大,且合成的低聚糖类混合物中的α-或β-键的结构缺乏特异性等缺点,使其很难大量运用于食品加工业中[17-18];四是酶法合成,主要通过一种特异性的β-半乳糖苷酶将乳糖转化为GOS,该酶可以特异性地催化乳糖末端的非还原性的β-d-半乳糖苷单元,使其水解为半乳糖苷,同时催化糖苷配基部分之间的糖苷键的水解并产生葡萄糖苷,通过乳糖的半乳糖基化反应催化GOS化合物的合成[19-20]。酶法合成GOS的优点在于反应温和、安全、高效,且不会产生有害副产物,因此非常适合将其直接运用于食品加工产业中,同时现已经商业化的GOS就是以乳糖为底物通过酶法合成所得。
对于新型酸奶的工业化生产,通常遇到的一个主要问题是若涉及新工艺的引入,其可能会促成较大的设备改造投入,给企业经营造成负担,如果需要利用牛奶中的乳糖通过酶的作用自合成GOS并做成酸奶,一般有2条途径:一是在牛奶的配料阶段加入酶进行合成,在这个阶段若需要达到合适的GOS产量,则需要多加一个酶解罐,增加产品生产投入;二是需要在牛奶的发酵阶段加入,但是一般酸奶的发酵时间在5 h左右,因此需要了解为了达到宣称含量[膳食纤维(以低聚半乳糖计)≥1.5%]的底物含量、酶添加量和酶解时间的基本关系,以更好地将其用于指导工业生产。
以牛乳中的乳糖为研究对象,通过酶法直接将牛乳中的乳糖合成为GOS,探究41 ℃条件下底物浓度、β-半乳糖苷酶添加量和反应时间对GOS产率的影响。
1 材料与方法
1.1 原料与试剂
β-半乳糖苷酶(来源两歧双歧杆菌,杜邦公司);牛奶(内蒙古伊利实业集团股份有限公司);乳糖(来源牛奶,荷兰菲仕兰公司);淀粉葡萄糖苷酶、麦芽二糖、麦芽三糖、麦芽四糖、麦芽五糖、麦芽六糖、麦芽七糖、乳糖标准品(HPLC≥98%)、氰基硼氢化钠:均为Sigma公司;甲醇(色谱纯)、乙腈(色谱纯)、二甲基亚砜(色谱纯):均为天津市永大化学试剂有限公司;甲酸铵、甲酸、2-氨基苯甲酰胺(均为上海安普有限公司);乳酸(分析纯,天津市永大化学试剂有限公司)。
1.2 仪器与设备
Agilent1260高效液相色谱仪(安捷伦科技有限公司);BSA223S分析天平[赛多斯科学仪器(北京)有限公司];PB-10 pH仪[赛多斯科学仪器(北京)有限公司];EYELAN-1100旋转蒸发仪、EYELAOSB-2100油浴锅(上海爱郎仪器有限公司);Sorvall ST8离心机(美国赛默飞公司)。
1.3 试验方法
1.3.1 牛奶中GOS含量的检测方法确立
参考文献[21-24]的方法,使用荧光标记-酶识别-高效液相色谱法定量测定牛奶中的GOS含量。
1.3.2 初始乳糖浓度对合成GOS的影响探究
牛乳中初始乳糖浓度分别设定为5.0%,5.5%,6.0%,6.5%和7.0%,将其高温灭菌(95 ℃,5 min)并冷却至41 ℃,加入0.1%β-半乳糖苷酶用于合成GOS,待反应3 h后灭酶(沸水浴10 min),冷却至室温后用于检测酶解液中的GOS含量。
1.3.3β-半乳糖苷酶添加量对合成GOS的影响探究
设定牛乳中的乳糖含量7.0%,高温灭菌(95 ℃,5 min)并冷却至41 ℃,分别添加0,0.05%,0.1%,0.15%和0.2%β-半乳糖苷酶,待反应3 h后做灭酶处理(沸水浴10 min),冷却至室温后用于检测酶解液中的GOS含量。
1.3.4 反应时间对合成GOS的影响探究
设定牛乳中的乳糖含量7.0%,高温灭菌(95 ℃,5 min)并冷却至41 ℃,添加0.1%β-半乳糖苷酶,待分别反应1,2,3,4,5,6和7 h后做灭酶处理(沸水浴10 min),冷却至室温后用于检测酶解液中的GOS含量。
1.3.5 牛奶中GOS合成的响应面法优化与验证
在单因素试验的基础上,以初始乳糖浓度、β-半乳糖苷酶添加量和反应时间为响应变量,分别用A、B、C表示,以GOS含量(Y)为响应值,通过响应面分析,完成酶解合成GOS的优化,选取优化结果予以验证预测值和实际值的差距。
1.4 数据分析
试验数据采用Origin、Excel、Design-Expert软件进行处理及作图,使用SPSS软件进行分析。
2 结果与分析
2.1 初始乳糖含量对GOS合成的影响
不同初始乳糖含量的牛乳在41 ℃酶解条件下对GOS合成的影响如图1所示。随着牛乳中初始乳糖含量的提高,GOS的合成量也随之上升,说明底物浓度对酶的水解效率呈正相关。牛乳中的初始乳糖含量大于6.5%时,GOS的合成速率减慢,说明在该酶浓度条件下,酶解效率逐渐接近饱和;而在初始乳糖含量6.0%~6.5%时,GOS的合成增长速率最快,说明在此区间酶的作用条件较适宜。同时考虑最终合成的GOS含量需要在1.5%以上及存在±0.2%的检测误差,进一步结合生产成本考量,选取初始乳糖含量5.5%,6.1%和6.7%作为响应面的优化设计值。

图1 初始乳糖含量对GOS合成的影响
2.2 β-半乳糖苷酶添加量对GOS合成的影响
41 ℃条件下不同β-半乳糖苷酶添加量对牛乳中β-半乳糖苷酶的酶解合成GOS效率方面的影响如图2所示。β-半乳糖苷酶添加量0时,GOS合成量为0,说明牛乳中的乳糖在该温度下自然水解无法形成GOS。β-半乳糖苷酶添加量0.05%时,GOS的合成量较少,β-半乳糖苷酶添加量0.10%时,相对于0.05%添加量,GOS合成量有明显的提高,说明酶对GOS合成量的影响是一个主要因素,当添加量0.15% GOS时合成量达到最大,而β-半乳糖苷酶添加量0.20%时,GOS合成量降低,分析原因是β-半乳糖苷酶添加量过多,同时该酶也会特异性地催化GOS末端的非还原性的β-d-半乳糖苷单元,使其水解为半乳糖苷,同时催化糖苷配基部分之间的糖苷键的水解并产生葡萄糖苷,进一步随着底物含量越来越少,GOS的合成速率会逐渐低于GOS的分解速率,从而导致宏观检测GOS含量的减少。结合生产成本控制考虑,响应面优化中β-半乳糖苷酶添加量选择0.05%,0.10%和0.15%。
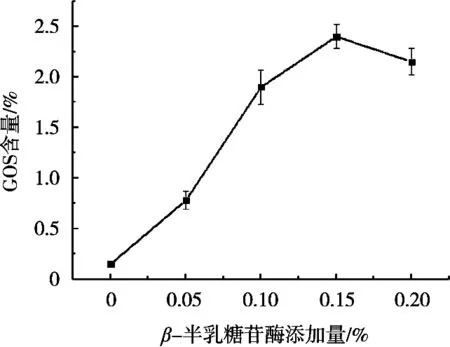
图2 β-半乳糖苷酶添加量对GOS合成的影响
2.3 酶解时间对GOS合成的影响
不同酶解时间对GOS合成的影响如图3所示。随着酶解时间的延长,牛乳中GOS的合成量也在不断提高,酶解时间在前2 h,牛乳中的GOS含量增长缓慢,说明前2 h酶的状态处于一种活化的状态,分解效率不高。但在酶解3~4 h,GOS的合成速率有较明显提升,说明此时酶的活化已完成,且酶解效率也能达到最大,但酶解达5 h后,GOS的合成速度减慢,分析原因是此时剩余的底物不足以支持酶的高效作用。酶解时间7 h时,GOS合成量出现降低,说明此时的底物不够合成GOS,同时酶对GOS的分解速率大于其合成速率。考虑酶解时间在5 h后变化趋势较小,从第3小时开始GOS含量达1.5%左右,因此重点研究3~5 h过程中GOS含量的变化情况。

图3 酶解时间对GOS合成的影响
2.4 响应面优化牛乳中GOS的合成
2.4.1 试验模型建立与显著性检验
通过单因素试验,确定按乳糖含量(A)、β-半乳糖苷酶添加量(B)、酶解时间(C)三因素三水平进行试验,Box-Behnken试验设计因素和水平见表1,试验设计及结果见表2。

表1 响应面试验设计因素和水平
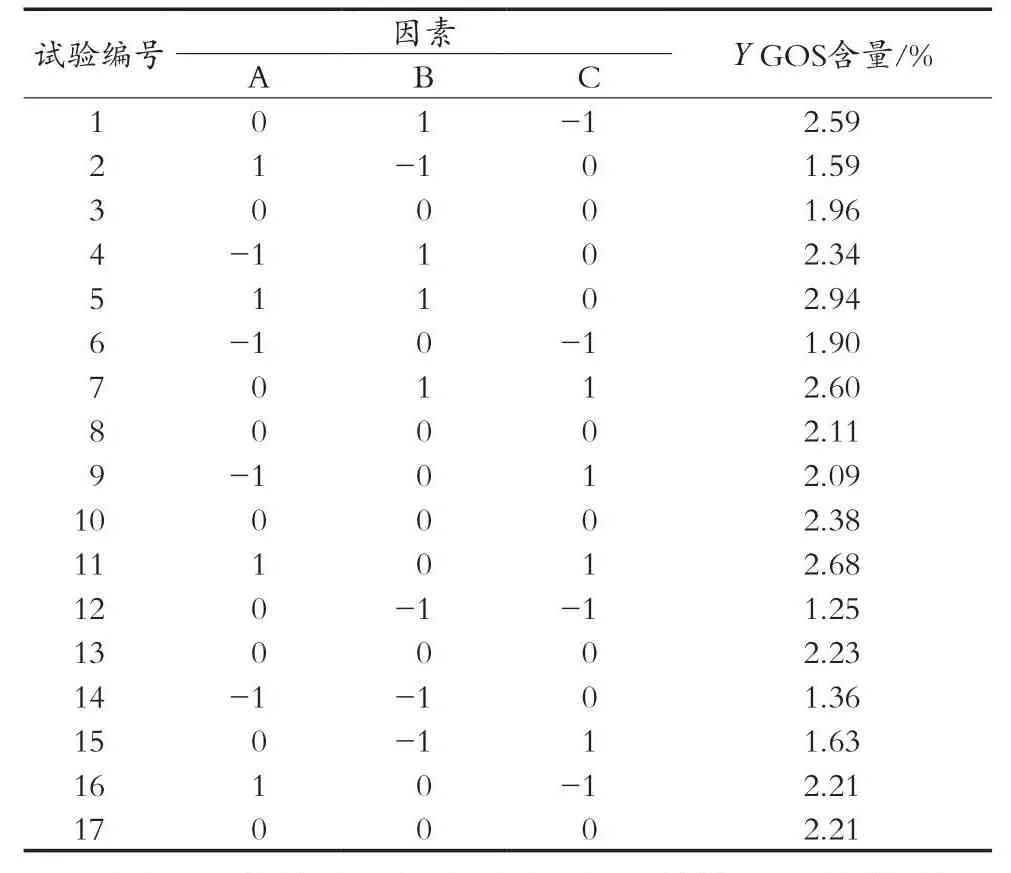
表2 响应面试验设计及结果
以GOS含量(Y)为响应值,利用SPSS软件对试验数据进行分析,得到拟合方程:Y=2.234+0.187 5A+0.566 3B+0.176 3C+0.105AB-0.02AC-0.107 5BC+0.061 8A2-0.220 8B2-0.034 3C2。
对回归模型进行进一步的显著性检验,结果见表3。模型的F值为37.893 8(P<0.000 1),表明整体模型达到显著,FLackoffit值为0.989 5(P=0.482 675),失拟结果不显著,说明不确定因素对试验结果的干扰较小。模型中R2=0.979 8,Radj2=0.954 0,表明该模型可以很好地解释GOS合成量的变化,即该模型的拟合度良好,可用于描述GOS合成量与乳糖含量、β-半乳糖苷酶添加量、酶解时间之间的关系。由表3还可以得出,因素A(乳糖含量)和C(酶解时间)对牛乳中GOS合成含量达到显著水平,因素B(β-半乳糖苷酶添加量)对牛乳中GOS合成达到极显著水平。乳糖含量、β-半乳糖苷酶添加量及酶解时间对牛乳中GOS的合成影响顺序为β-半乳糖苷酶添加量>乳糖含量>酶解时间。该试验所建立的模型中A和B、B和C及A和C之间的交互影响均不显著。此外,B2对GOS合成的影响达到显著水平,而A2与C2对GOS合成率的影响不显著。
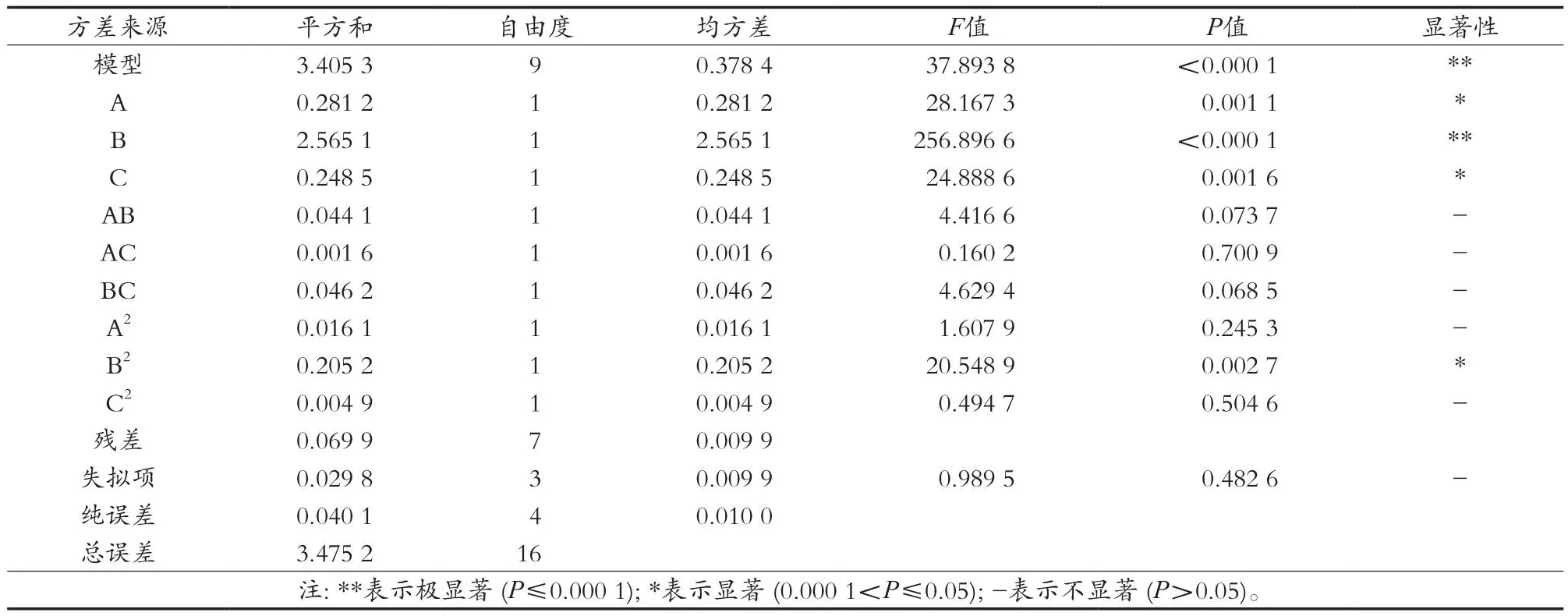
表3 响应面分析结果及显著性检验
2.4.2 响应面分析
利用Design-Expert软件对试验数据进行二元多次回归拟合,交互作用的等高线及响应曲面如图4所示,通过对比分析3组图中的曲线的平滑与陡峭程度,可以直观看出各因素之间的交互作用对GOS合成量的影响。从图4(a)可以看出,β-半乳糖苷酶添加量对牛乳中GOS合成量的影响大于牛乳中的乳糖含量。从图4(b)可以看出,β-半乳糖苷酶添加量对牛乳中GOS合成量的影响大于酶解时间。从图4(c)可以看出,乳糖含量和酶解时间对牛乳中GOS合成量的影响不明显。这与方差分析结果相吻合。

图4 响应曲面图
2.4.3 最佳工艺条件的预测与检验
通过Design-Expert软件预测出牛乳中原生GOS合成的最佳工艺参数:牛乳中的乳糖含量6.12%、β-半乳糖苷酶添加量0.082%、酶解时间4.2 h,在此条件下GOS合成量为2.12%。鉴于工艺的可操作性,将其调整为乳糖含量6.0%±0.2%,β-半乳糖苷酶添加量0.09%±0.01%,酶解时间4.5±0.5 h。经验证试验,在此条件下牛乳中GOS合成量达2.07%±0.15%。
3 结论
通过单因素试验和响应面分析法中的Box-Behenken中心组合方法,得到理论最佳工艺,对酶法合成低聚半乳糖的配方工艺进行优化,并很好地证明模型的可靠性。其中,最佳响应优化理论值为牛乳中的乳糖含量6.12%、β-半乳糖苷酶添加量0.082%、酶解时间4.2 h,理论合成量为2.12%。为增强工艺的可操作性,经微调后得到最适酶法合成GOS的工艺条件:加酶量0.09%±0.01%、牛乳中初始乳糖含量6.0%±0.2%、反应时间4.5±0.5 h。在此条件下,GOS合成量达2.07%±0.15%。其中各因素对GOS合成量的影响顺序为β-半乳糖苷酶添加量>乳糖含量>酶解时间。通过对41 ℃温度下酶法合成GOS的配方工艺优化的基础探究,有助于在真实发酵环境下,对于酶法合成GOS的酸奶开发提供必要的指导和参考。

